Чтобы сделать органоид мозга, берут стволовые клетки, переводят их в одноклеточную суспензию и дают клеткам снова собраться в агрегат — сформировать шар
МЕНЮ
Главная страница
Поиск
Регистрация на сайте
Помощь проекту
Архив новостей
ТЕМЫ
Новости ИИ
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Искусственный интеллект
Слежка за людьми
Угроза ИИ
ИИ теория
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Психология ИИ
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Промпты. Генеративные запросы
Распознавание лиц
Распознавание образов
Распознавание речи
Творчество ИИ
Техническое зрение
Чат-боты
Авторизация
2026-02-13 11:08

Органоиды мозга или церебральные органоиды — это трёхмерные миниатюрные фрагменты мозговой ткани, развивающиеся из стволовых клеток. Они растут и формируют базовую архитектуру человеческого мозга.
Этот текст — перевод лонгрида Brain Organoids на Serious Science. Кликните, чтобы ознакомиться с оригинальной публикацией.
Создание органоидов мозга
Долгое время нейробиология опиралась на животные модели, и они были очень полезны для понимания мозга животных. Но, разумеется, людям важно понимать человеческий мозг. Примерно с начала века учёные начали работать с человеческими стволовыми клетками, пытаясь получить человеческие нейроны. В двухмерной клеточной культуре это хорошо работает, и можно получать качественные, чистые популяции определённых типов нейронов. Однако такие культуры очень простые: они почти не интегрированы друг с другом и в них нет архитектуры, которую мы видим в реальном человеческом мозге. Именно с этого я и начала.
Чтобы сделать органоид мозга, берут стволовые клетки, переводят их в одноклеточную суспензию и дают клеткам снова собраться в агрегат — сформировать шар. Затем клетки внутри этого шара, по сути, пытаются сделать эмбрион. Они, очевидно, дезорганизованы, поэтому не могут действительно его сформировать, но начинают производить разные типы зародышевых клеток, из которых должны возникнуть разные системы органов. После этого их направляют в сторону мозговой идентичности, чтобы большая часть ткани в итоге стала очень примитивной мозговой тканью. Ключевой момент — и это пришло из области органоидов — поместить клетки в специальный богатый белками поддерживающий гель, который имитирует окружение, с которым они сталкивались бы в эмбрионе.
Метод, который разработала я (и с тех пор появилось много других методов), устроен очень минималистично. Клетки на самом деле сами знают, что делать: мозг в эмбрионе развивается сам по себе, без того чтобы кто-то вмешивался и добавлял факторы роста или другие соединения. И информации извне, которая задаёт раннее паттернирование мозга, на самом деле не так много: большая её часть заключена в самой ткани. Поэтому всё, что нужно, — запустить клетки, обеспечив им правильное питание для поддержки роста. Это немного похоже на садоводство: вы сажаете семя и вам не приходится растить его самостоятельно. Вы просто даёте ему нужные питательные вещества, солнечный свет, почву, удобрения и воду — и получаете растение.
Важно, что мы не хотим получить просто шар, состоящий из самых разных органов. Чтобы этого избежать, мы убираем определённые факторы роста и липиды из раствора, в котором выращиваются клетки. Это очень простая вещь: на самых ранних этапах развития первое решение, которое должна принять эмбриональная или плюрипотентная стволовая клетка, — это решить, кем она станет: мозгом или всем остальным. Это первое решение связано с процессами эпителиально-мезенхимального перехода и гаструляции: клетки, которые не проходят гаструляцию, станут мозгом. А гаструлирующие клетки зависят от определённых факторов роста и липидов — поэтому достаточно убрать их, и клетки просто сформируют эту раннюю, первичную мозговую ткань.
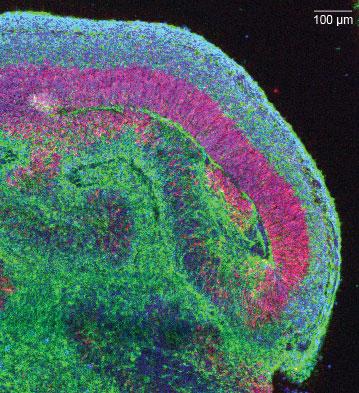
Срез одного «долькового» участка кортикальной ткани внутри органоида (нейроны — зелёным, нервные стволовые клетки — красным, все ядра клеток окрашены в синий). Фото: Мэделин Ланкастер / IMBA
Архитектура и размер
Если посмотреть на наши органоиды мозга, вы не увидите форму мозга. Вместо этого вы увидите отдельные мозговые области, расположенные рядом друг с другом, и каждая из них будет выглядеть так же, как отдельная мозговая область у человека на самых ранних стадиях развития. То есть если бы я взяла развивающийся плодный мозг, разобрала его на регионы, разложила их на столе — и затем сделала бы то же самое с моими органоидами мозга, — было бы видно, что они похожи. Просто в органоиде эти части собраны почти случайным образом: локальная разметка всё же есть — области, которые должны находиться рядом, чаще оказываются рядом, — но в целом органоид не имеет формы мозга.
Наши органоиды мозга содержат около миллиона клеток и вырастают примерно до половины сантиметра в длину. С одной стороны, они довольно крупные: чтобы их увидеть, микроскоп не нужен. С другой стороны, для мозга половина сантиметра — это очень мало.
Наши органоиды — модель развивающегося мозга, и они не могут развиваться дальше и формировать полноразмерную мозговую ткань, потому что в них нет кровеносных сосудов.
Вообще-то человеческий мозг развивается без сосудов в течение первого триместра беременности. На этом этапе он представляет собой очень тонкий эпителий с большой полостью, заполненной жидкостью, а кровь поступает снаружи — из сосудистой системы плода, — и питательные вещества попадают внутрь с помощью диффузии. Поэтому наши органоиды так хорошо развиваются примерно до середины гестации: даже в нормальном развитии кровеносных сосудов внутри самой мозговой ткани не появляется до примерно второго триместра. Конечно, мозг плода в первом триместре всё равно намного больше, чем миллион клеток: толщина эпителия в органоидах и в мозге плода одинаковая. Однако у плода всё организовано лучше, поэтому эпителий там более непрерывный, а заполненное жидкостью пространство — больше.
Органоиды производят нейроны примерно до шести месяцев: по срокам это очень хорошо совпадает с тем, что происходит in vivo. Пока они образуют новые нейроны, более ранние нейроны начинают погибать, но они заменяются — поэтому органоиды продолжают расти. Однако после шести месяцев органоиды переключаются и начинают производить глию, потому что in vivo происходит то же самое; и когда нейральные стволовые клетки перестают делать нейроны, уже нечем заменять клетки, которые погибают. Поэтому примерно после 6 месяцев, достигая размера около половины сантиметра, они перестают расти и начинают уменьшаться, и в итоге получается шар из глии — потому что глия невероятно устойчива, а нейроны — нет.
Чтобы это преодолеть, мы разработали в лаборатории специальный метод: примерно на втором месяце, после того как органоиды сформировали исходную архитектуру, но нейральные стволовые клетки всё ещё производят нейроны, мы нарезаем их на толстые срезы и помещаем на границу воздух—жидкость. Так мы можем поддерживать нейроны живыми годами; у нас действительно есть органоиды возрастом 2,5 года. Это наш способ справиться с проблемой диффузии питательных веществ и кислорода. Конечно, такие срезы выглядят несколько искусственно, но именно так мы можем наблюдать формирование красивых нервных трактов.
Сейчас большой интерес вызывает поиск способа встроить кровеносные сосуды в органоиды и тем самым преодолеть ограничение по размеру.
Многие считают, что первый шаг — то, что мы вообще научились выращивать органоиды, — был огромным скачком. Мне, разумеется, тоже хочется так думать, потому что я сыграла в этом большую роль, но на самом деле, как мне кажется, гораздо сложнее — добиться появления в них сосудов и заставить их развиваться дальше того уровня, на котором они сейчас останавливаются.
Пока что по опубликованным работам видно, что сосуды могут прорастать в органоиды, но прорастают они так, что мозговая ткань повреждается, а этого, конечно, не происходит in vivo. Думаю, дальнейший прогресс потребует аккуратных описательных исследований того, что происходит in vivo, и только потом — попыток воспроизвести это in vitro.
Текущие исследования
Моделирование неврологических заболеваний
Моделирование нарушений нейроразвития в органоидах — это направление, в котором сейчас движется большинство групп в этой области. Можно назвать практически любое неврологическое заболевание — и найдётся кто-то, кто пытается смоделировать его в органоидах мозга. Вероятно, наибольший прогресс будет в случае более тяжёлых нарушений развития: если в мозге пациентов видны морфологические отличия, то, скорее всего, что-то можно будет увидеть и в органоидах.
Первым примером нейроразвитийного заболевания, которое смоделировали, была генетическая форма микроцефалии — состояние, при котором мозг развивается неправильно, из-за чего голова оказывается меньше нормы. Мы видели, что органоиды с мутацией микроцефалии были меньше, чем нормальные. Это стало успешным подтверждением принципиальной возможности, потому что мышиные модели для микроцефалии плохи: если сделать ту же генетическую мутацию у мыши, мозг выглядит относительно нормально; его очень трудно отличить от мозга обычной мыши. А вот в человеческих органоидах мы могли увидеть разницу в размере, а затем заняться клеточной биологией и разобрать, что происходит. Оказалось, что основная проблема — преждевременная дифференцировка: нейральные стволовые клетки слишком рано начинают производить нейроны, и из-за этого пул стволовых клеток истощается слишком рано.
После этой работы следующим логичным шагом стало изучить микроцефалию, вызванную вирусом Zika. Если мы смогли смоделировать генетическую версию болезни, сможем ли мы смоделировать и индуцированную вирусом? Это и есть одна из больших историй успеха органоидов мозга. ВОЗ объявила Zika Public Health Emergency в январе–феврале 2016 года, и уже к марту была опубликована первая работа про Zika в органоидах мозга. С тех пор появилось много более глубоких исследований о том, что именно делает вирус Zika, какие клетки он поражает, на какой рецептор нацелен и почему убивает клетки. Очевидна особая уязвимость нейральных стволовых клеток у плода, тогда как взрослый мозг, по-видимому, переносит инфекцию Zika без серьёзных последствий. Поэтому, понимая, чем стволовые клетки плода отличаются, можно понять механизм болезни и найти потенциальные способы лечения. И сейчас уже есть исследования, где в органоидах мозга начали разрабатывать лекарства и нашли эффективные соединения, которые, похоже, либо подавляют способность Zika поражать нейральные стволовые клетки, либо модифицируют ответ самих нейральных стволовых клеток, чтобы предотвратить их гибель.
Есть и исследования других генетических состояний: например, лиссэнцефалия — когда мозг гладкий и у него нет привычных складок и борозд. В органоидах складки обычно не формируются, потому что это более ранняя стадия развития. Однако учёные всё равно могут изучать клеточный дефект и видят проблему с миграцией нейронов (то есть с тем, как нейроны перемещаются от места, где они впервые образовались, к своей конечной позиции в мозге), и, по-видимому, именно это и лежит в основе расстройства у пациентов. Это лишь несколько примеров; мне кажется, именно такие генетические мальформации удаётся моделировать особенно хорошо.
То есть в наших органоидах мы можем видеть проблемы, связанные с архитектурой мозга, но другие расстройства моделировать сложнее. Например, шизофрению: когда вы смотрите на МРТ мозга пациента, вы не можете сказать, шизофрения это или нет, — то есть в структуре мозга нет ничего, что, насколько мы знаем, позволяло бы поставить этот диагноз. В конечном счёте человека делает шизофреническим набор поведенческих и когнитивных трудностей. В органоидах мы можем изучать клеточную биологию, архитектуру и молекулярную идентичность, но к функциональным исследованиям мы только подступаемся; поэтому дойти до чего-то вроде шизофрении или аутизма значительно труднее.
С аутизмом ситуация такая: есть несколько форм заболевания, которые явно генетические и моногенные. В таком случае можно внести мутацию, например, в гене нейрексина: мутация нейрексина почти всегда приводит к аутизму. Проблема — в определении: что вы имеете в виду, говоря, что у этих пациентов аутизм, когда для пациента с мутацией нейрексина это одно, а для пациента с другой мутацией — другое? Но по крайней мере в тех случаях, где вы можете внести мутацию, у вас может быть и контрольная клеточная линия без этой мутации, а это очень полезно. Тогда можно смотреть клеточно-биологические показания, которые могут сообщить что-то о заболевании: они демонстрируют, что делают эти гены и почему они нужны. Сейчас учёные активно проводят такую работу на органоидах мозга.
И даже нейродегенеративные заболевания сейчас изучают в органоидах — например, болезнь Альцгеймера. Я скептически отношусь к тому, насколько реально моделировать такие очень поздно начинающиеся расстройства, поскольку они явно связаны со старением. Но это может оказаться возможным, если удастся индуцировать в органоидах какой-то возрастной режим или использовать клетки пациентов с наследственной формой Альцгеймера (хотя такие случаи болезни в развиваются меньшинстве случаев). Последнее как раз сделали в недавнем исследовании: учёные показали, что могут получить там белковые агрегаты — один из ключевых клеточных признаков нейродегенерации. У них получились два типа агрегатов — и бляшки, и клубки, — которые наблюдают у пациентов. Это довольно поразительно, потому что в мышиных моделях болезни никогда не удаётся получить оба типа; даже чтобы получить один, нужно вводить несколько генетических мутаций, а в 2D-культурах этого тоже раньше не наблюдали. Так что органоиды дают нам то, чего не удавалось получить на прежних моделях.
Развитие мозга и межвидовые сравнения
Как мозг эволюционировал и чем он отличается от мозга других животных — один из базовых вопросов, и я не могу придумать модельную систему, кроме органоидов, с помощью которой на него можно было бы ответить. Сейчас немногочисленные лаборатории, которые этим занимаются, в основном просто наблюдают: выращивают органоиды из разных видов и смотрят, что различается, а также используют более молекулярный подход — например, RNA-seq (секвенирование РНК), то есть определяют с помощью секвенирования, какие гены активны в разных клетках органоида. Можно вырастить органоиды, диссоциировать их и идентифицировать конкретные типы клеток, которые там присутствовали. Если делать это в разные моменты времени, то выясняется, что разные зрелые типы клеток — нейроны и глия — образуются у человека немного медленнее, чем у шимпанзе.
Мы видим это в органоидах, но на самом деле этого и следовало ожидать по данным предыдущих исследований.
Доминирующая модель, объясняющая, почему у нас такие большие мозги, основана на понятии, которое называется неотения: по сути, это означает, что наш мозг дольше созревает. Это относится ко всем уровням развития нейронов: от нейрогенеза — то есть просто более медленного образования нейронов — до полноценного созревания нейронов. Наши нейроны остаются очень незрелыми даже при рождении и достигают максимальной зрелости только спустя несколько лет жизни.
Кроме того, происходят дополнительные события развития — например, прунинг и перестройка сетей в подростковом возрасте. Настолько крупное событие нейроразвития примерно в 15 лет совершенно неслыханно ни для какого другого вида.
Смысл этой модели неотении в том, что растягивание всех процессов даёт каждому типу клеток — или каждой стадии — больше времени на расширение. Для стадии нейрогенеза это означает больше возможностей произвести больше нейронов: если вы дольше находитесь в этом режиме, вы сделаете больше нейронов. А если вы тратите больше времени на созревание нейронов, то нейроны достигают более впечатляющего уровня зрелости. Действительно, у человеческих нейронов структура намного сложнее, чем у нейронов мыши, и мы видим это и в наших органоидах. Когда мы впервые это увидели, я была поражена: нейронные сети выглядели как паутина — настолько невероятно сложные, с огромными и переплетёнными дендритными деревьями. Мышиные нейроны, на которые я привыкла смотреть раньше, гораздо проще.
Так что созревание различается между видами, но типы клеток, похоже, одни и те же. Вы не находите какого-то особого типа клеток, который существует только у человека. По крайней мере, если сравнивать внутри человекообразных обезьян, это скорее вопрос количества, а не качества. Я шучу, что если бы у шимпанзе мозг увеличился в три раза — примерно настолько, какова разница между нами, — он, вероятно, сидел бы здесь, пил кофе, разговаривал, изобретал умные устройства и так далее. Но между приматами и грызунами ситуация другая: у первых появилось что-то, чего нет у вторых. Например, есть определённые нейроны, которые называются нейроны фон Экономо, и у грызунов их просто не обнаруживают.
Связность и активность мозга
Ещё одна большая часть исследований органоидов мозга сейчас — это электрофизиология, то есть изучение согласованной нейронной активности, чтобы понять, как в мозге собираются базовые нейронные сети. Речь идёт о сетях, которые генетически заданы и как бы заранее запрограммированы, а не о тех, что участвуют в обучении или памяти.
В наших органоидах мы видим определённые правила формирования связности, которые совпадают с тем, что наблюдают in vivo: нейроны с определённой идентичностью (то есть определённого типа) проецируют свои отростки строго определённым образом — и это предзадано. Это происходит не потому, что они чему-то учатся или уже получают какой-то входящий сигнал; их, вероятно, просто притягивают определённые молекулярные факторы, которые секретируются (выделяются) — скорее всего, внутри ткани, — и именно это задаёт их рисунок проекций. Например, мы знаем, что нейроны глубоких слоёв коры дают проекции на гораздо большие расстояния, тогда как нейроны более поверхностных слоёв проецируются на меньшие расстояния. И ровно это мы видим в наших органоидах: поверхностные нейроны проецируются внутри органоида, а нейроны глубоких слоёв проецируются очень далеко и выходят за пределы органоида, отправляя отростки на большие расстояния — на несколько миллиметров.
С помощью электрофизиологических методов мы можем смотреть на нейронную активность «на входе» и «на выходе» и по морфологии (по форме и строению) пытаться предположить, что находится между ними. Например, мы можем стимулировать один нейрон и регистрировать сигнал у другого: мы не знаем, сколько соединений — то есть синапсов — находится между ними, но можем оценить это по тому, сколько времени заняла передача сигнала. Однако на данный момент мы не можем определить реальный пространственный рисунок связей и их пространственную топологию (то есть то, как именно связи организованы в пространстве и как устроена геометрия сети).
Мне также очень хотелось бы поместить некоторые органоиды в МРТ, чтобы увидеть более крупномасштабные структуры. Другие учёные делали это для грызунов, а наши органоиды примерно такого же размера, как мозг небольшого грызуна. Для нас это могло бы позволить выявить конкретные правила на макроуровне, которые повторяются от органоида к органоиду. А затем можно проверить, различаются ли эти правила между органоидами разных видов.
Есть ли у церебральных органоидов сознание?
Мне часто задают вопрос — особенно медиа, — могут ли наши органоиды мозга быть сознательными. Когда мне впервые задали этот вопрос, я сразу ответила: «Нет!», потому что для меня это было очевидно: думаю, если бы вы посмотрели на органоид, вы тоже не решили бы, что у него есть сознание. Но на самом деле важно понимать, почему.
Нас интересует эволюция человеческого мозга и то, что делает наш мозг особенным. И это не только сознание, потому что сознание есть и у других животных; скорее речь о мышлении более высокого порядка, языковых способностях, социальном развитии, а также о других когнитивных возможностях. Нас интересует, что именно отличает человеческий мозг и даёт нам эти способности. А затем, опираясь на это знание, можно задать вопрос: а могут ли органоиды мозга обладать какими-то из тех характеристик, которые обеспечивают эти способности?
Если сравнить человеческий мозг, например, с мозгом шимпанзе или мыши, первое, что бросается в глаза, — он действительно большой. И дело не только в соотношении размера мозга к размеру тела, но и в абсолютных величинах. И хотя, например, мозг слона больше нашего, в коре больших полушарий у нас больше нейронов. Эти числа трудно по-настоящему осознать: речь идёт о 80–100 миллиардах нейронов. Если перевести это в то, сколько нейронов образуется каждый час во время гестации, получится 12 миллионов. В коре мыши — 4 миллиона.
То есть развивающийся человеческий плод каждый час производит три полные коры мыши.
Это невероятное количество нейронов.
Мы подсчитали, что в наших органоидах примерно миллион нейронов: с одной стороны, это звучит как очень много, но с другой — это всего лишь четверть мышиной коры и во много раз меньше того, что есть у человека. Думаю, это первая причина, по которой можно отвергнуть возможность сознания: органоиды просто недостаточно большие.
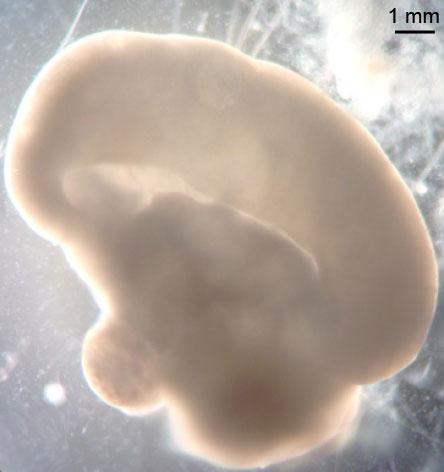
Целый органоид, снятый в светлом поле. Обратите внимание на крупную долю кортикальной ткани и общий размер органоида — около 1 см в длину. Фото: Мэделин Ланкастер / IMBA
Вторая причина — архитектура. Наш мозг работает так, как работает, потому что он соединён определённым образом, а информация передаётся направленно. Можно было бы взять все наши нейроны, перемешать их и затем сделать шар из нейронов (примерно так же, как мы делаем органоиды из стволовых клеток), но он не функционировал бы как мозг, потому что организация была бы недостаточной.
И третье. Кристоф Кох, известный профессор, занимающийся проблемой сознания, тоже отвечал на вопрос о сознании у органоидов: «Ну и о чём бы они тогда были сознательны?» У них не было вообще никакого опыта. Некоторые также пытаются провести параллель с «синдромом запертого человека» — состоянием, при котором пациент остаётся в сознании, но из-за полного паралича не может двигаться или общаться устно. Но у этих пациентов есть жизненный опыт: у них есть друзья и семья, у них была насыщенная жизнь — а потом они оказываются «заперты» в теле. И да, это страдание. Но у органоида нет ничего подобного — ак о чём ему быть сознательным? Ни о чём.
В итоге наши органоиды примерно размером с мозг речного рака. Но мозг речного рака на самом деле лучше, чем наши органоиды, потому что он организован и находится внутри тела, которое получает сенсорный вход и взаимодействует со средой. Поэтому, хотя органоиды и на много далеки от чего-то хотя бы приблизительно сознательного, они очень мощный инструмент для понимания развития мозга и ранних стадий заболеваний.
Источник: postnauka.org