Лактатный челнок: как астроциты "кормят" нейроны
МЕНЮ
Главная страница
Поиск
Регистрация на сайте
Помощь проекту
Архив новостей
ТЕМЫ
Новости ИИ
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Искусственный интеллект
Слежка за людьми
Угроза ИИ
ИИ теория
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Психология ИИ
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Промпты. Генеративные запросы
Распознавание лиц
Распознавание образов
Распознавание речи
Творчество ИИ
Техническое зрение
Чат-боты
Авторизация
2025-06-20 11:25

Введение
Головной мозг — один из самых энергозатратных органов человеческого тела. Долгое время считалось, что основным топливом для нейронов служит исключительно глюкоза, поступающая через гематоэнцефалический барьер и глюкозные транспортеры. Однако исследования последних десятилетий показали, что астроциты — основные глиальные клетки, окружающие нейроны — играют ключевую роль в энергетическом обмене мозга.
Астроцит-нейрон-лактатный челнок (astrocyte-neuron lactate shuttle, ANLS) — это механизм, через который астроциты «кормят» нервные клетки, а именно, перерабатывая глюкозу, поставляют нейронам лактат, который затем превращается в пируват и используется в митохондриях для аэробного гликолиза.
Первоначально считалось, что лактат является лишь побочным продуктом гликолиза и не играет значимой роли в энергетическом обмене головного мозга. Однако работы последних десятилейтий демонстрируют, что он не только является важным источником энергии для нейронов, но и выполняет сигнальные функции, влияя на когнитивные процессы, нейрогенез, синаптическую пластичность и развитие нейродегенеративных заболеваний. Дисбаланс лактата может приводить к когнитивными дисфункциям, прогрессированию нейродегенераций, а также к онкогенезу. В этой статье мы рассмотрим, как лактатный челнок влияет на работу мозга.
Лактат как источник энергии
Астроциты — это не просто «поддерживающие» клетки мозга. В числе их множества функций формирование гематоэнцефалического барьера (ГЭБ), где астроциты являются основными клетками, поглощающими глюкозу из крови. Затем, метаболизируя глюкозу до лактата, астроглия транспортирует его в межклеточное пространство, откуда он может поглощаться нейронами через монокарбоксилатные транспортеры (MCT). В частности, MCT1 и MCT4 экспрессируются на мембранах астроцитов и обеспечивают выход лактата в внеклеточную среду, тогда как нейроны экспрессируют MCT2, ответственный за поглощение лактата и его дальнейшее использование [1, 2].
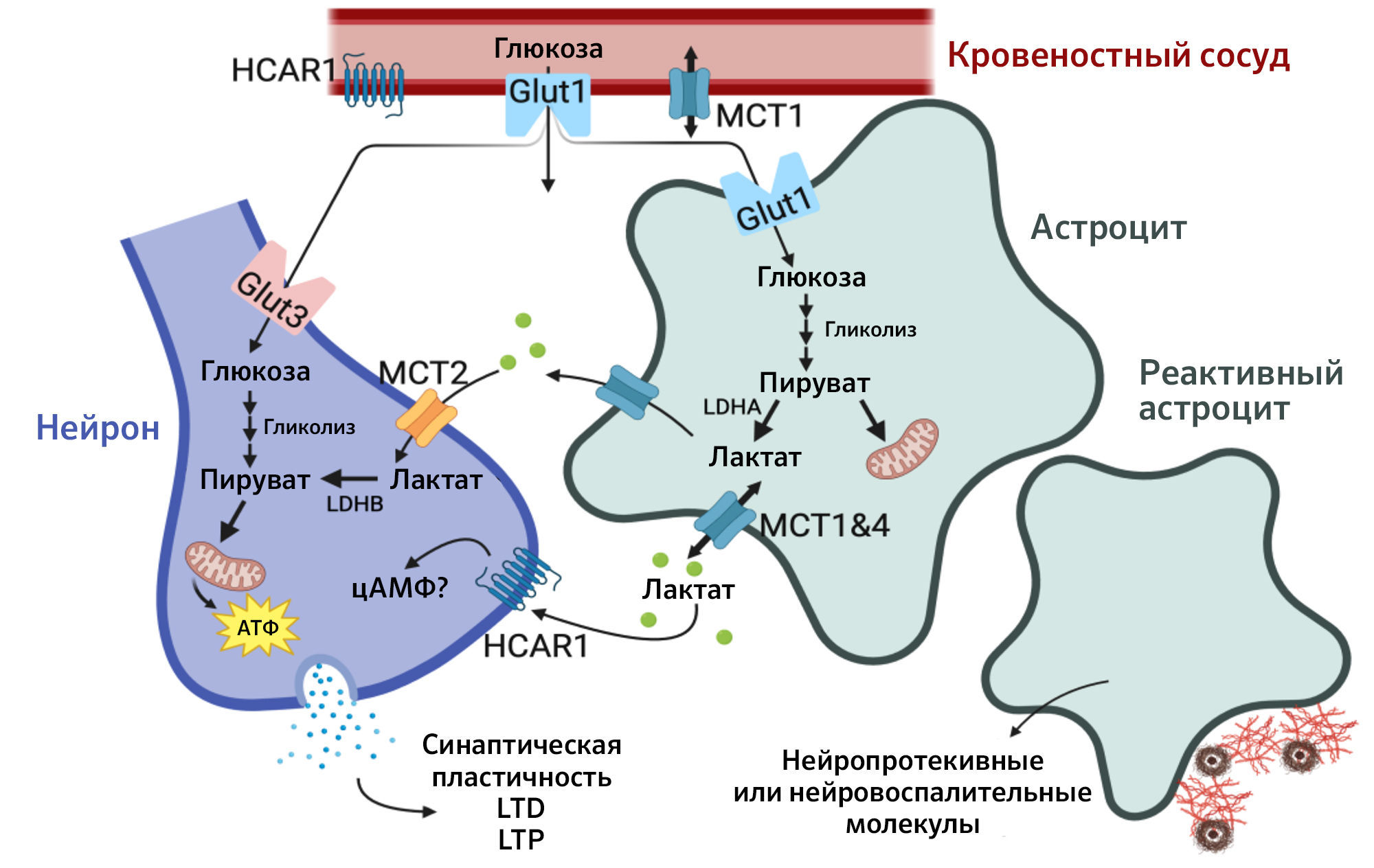
Рис.1
При нейрональной активности глутамат высвобождается в синаптическую щель, а глюкоза поступает из кровеносных сосудов и поглощается астроцитами. Внутри астроцитов глюкоза превращается в пируват через гликолиз. В астроглии преимущественно экспрессируется LDHA, что способствует превращению глюкозы в лактат. В нейронах доминирует LDHB, которая превращает лактат в пируват для последующего окисления в митохондриях. Лактат выделяется из астроцитов через транспортеры MCT1/4 в межклеточное пространство, откуда нейроны с помощью MCT2 поглощают его для аэробного использования, поддерживая клеточные процессы, необходимые для гомеостаза мозга.
Сокращения: цАМФ — циклический аденозинмонофосфат; GLUT — глюкозный транспортер; HCAR1 — гидроксикарбоксильный рецептор 1; LDH — лактатдегидрогеназа (A и B); MCT — монокарбоксилатный транспортер; LTD — долгосрочное подавление (long-term depression) — уменьшение синаптической пластичности; LTP — долговременная потенциация (long-term potentiation) — увеличение синаптической пластичности [2].
Хотя нейроны могут использовать глюкозу напрямую, их способность к гликолизу ограничена низкой экспрессией гликолитических ферментов. В нормальных условиях до 20–30 % всей энергии нейронов обеспечивается за счет лактатного челнока, но в условиях повышенной активности и стресса этот показатель возрастает до 50 % . Остальная часть энергии нейронов поступает из окисления глюкозы в митохондриях и альтернативных субстратов, таких как кетоновые тела. Однако даже при наличии глюкозы нейроны остаются зависимыми от лактата, так как его использование позволяет снизить нагрузку на гликолитические пути и оптимизировать энергетический обмен, значительно ускорив его [3]. Сами по себе астроциты требуют гораздо меньше энергии для функционирования, чем нейроны, благодаря чему могут передавать значительную часть энергетического субстрата, к которому они имеют исключительный доступ, другим нервным клеткам, выступая в роли медиаторов для дополнительного энергоснабжения. Исключительность доступа астроцитов к энергетическим ресурсам обеспечивается наличием у них глюкозных транспортеров GLUT1, которые отличаются от нейрональных GLUT3 более высокой аффинностью к глюкозе и способностью захватывать ее из кровотока в первую очередь, а также благодаря периваскулярными отросткам [3, 4].
В условиях дефицита ресурсов астроциты могут получать глюкозу с помощью расщепления гликогенового депо. Этот механизм играет большую роль при гипогликемии, воспалении и консолидации памяти. Процесс накопления астроцитарного гликогена нарушается при депривации сна. Как было показано, при длительном бодрствовании мозга запасы гликогена в астроцитах истощаются, а их восстановление происходит только во время сна [5].
Лактат как сигнальная молекула
Помимо энергетической функции, лактат выполняет роль сигнальной молекулы, влияя на процессы памяти и пластичность синапсов. В гиппокампе, ключевой области, ответственной за обучение и память, он активирует NMDA-рецепторы и стимулирует экспрессию генов, связанных с пластичностью нейронов (Arc, c-fos и zif268). Лактат способствует усилению передачи сигналов в синапсах и повышает уровни D-серина, необходимого для активации NMDA-рецепторов. Этот процесс важен для консолидации памяти и формирования долговременных нейронных связей.
Для перехода памяти от краткосрочнои? в долгосрочную необходимо, кроме прочего, высвобождение норадреналина. При повышении концентрации этого нейромедиатора в астроцитах происходит гликогенолиз, с помощью чего синтезируется лактат, который служит не только источником энергии, но и сигнальной молекулой для активации и вовлечения соседних астроцитов [1, 6].
Концентрация лактата в гиппокампе увеличивается во время активного обучения, что указывает на его участие (или, по крайней мере, на активный гликолиз) в процессах нейропластичности. Исследования показали, что активация рецепторов каннабиноидов (CB1) повышает концентрацию лактата, тем самым улучшая процесс обучения. Экспериментальные данные подтверждают, что блокирование передачи лактата от астроцитов к нейронам через MCT (монокарбоксилатный транспортер), как и блокирование гликогенолиза, приводило к ухудшению памяти и возникновению амнезии [6]. Кроме того, было показано что in vitro лактат усиливает пролиферацию неи?рональных клеток, предшественников нейронов гиппокампа, что может указывать на его роль в нейрогенезе [1].
Лактат и нейропротекция
Лактат играет важную роль в защите мозга от повреждений, вызванных гипоксией/ишемией и воспалительными процессами.
При черепно-мозговых травмах и инсультах активация лактатного челнока способствует снижению нейронального повреждения за счет поддержки энергетического метаболизма нейронов. В условиях ишемии, на модели депривации кислорода и глюкозы (OGD) in vitro было показано, что введение лактата снижает внутриклеточную концентрацию кальция в нейронах и астроцитах, уменьшая воспалительный ответ и повышая клеточную выживаемость [6].
На модели окклюзии средней мозговой артерии (MCAO) у крыс было установлено, что лактат, поступающий от астроцитов, позволяет нейронам поддерживать активность даже при сниженной доставке глюкозы, помогая нейронам выживать в условиях ишемии [8].
Нейропротекторные свойства лактата могут быть обусловлены его способностью активировать гидроксикарбоксильный рецептор 1 (HCAR1), одним из агонистов которого он является. Активация HCAR1 запускает каскад защитных процессов в мозге, приводящих к активации сигнальных путей AMPK и Akt. Это, в свою очередь, способствует нейро- и ангиогенезу, что может улучшать мозговое кровообращение и восстановление тканей после повреждения [9, 10].
Лактат и нейродегенеративные заболевания
Нарушение лактатного обмена ассоциировано с рядом нейродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона.
В отличие от нейронов, микроглиальные клетки предпочитают использовать глюкозу в качестве основного источника энергии. Метаболический сдвиг приводит к переключению микроглии с окислительного фосфорилирования на гликолиз, что ведет к накоплению лактата и способствует образованию ?-амилоида [11].
Воздействие ?-амилоида на астроциты изменяет их способность поглощать глюкозу и метаболизировать её, а кроме того, сам лактат участвует в эпигенетической модификации — лактилировании гистонов, что усугубляет дефицит энергии в нейронах и повышает уровень оксидативного стресса. Кроме того, нейровоспаление, связанное с болезнью Альцгеймера, приводит к повышенному высвобождению глутамата и АТФ через коннексины, что может усиливать повреждение нейронов [1, 11].
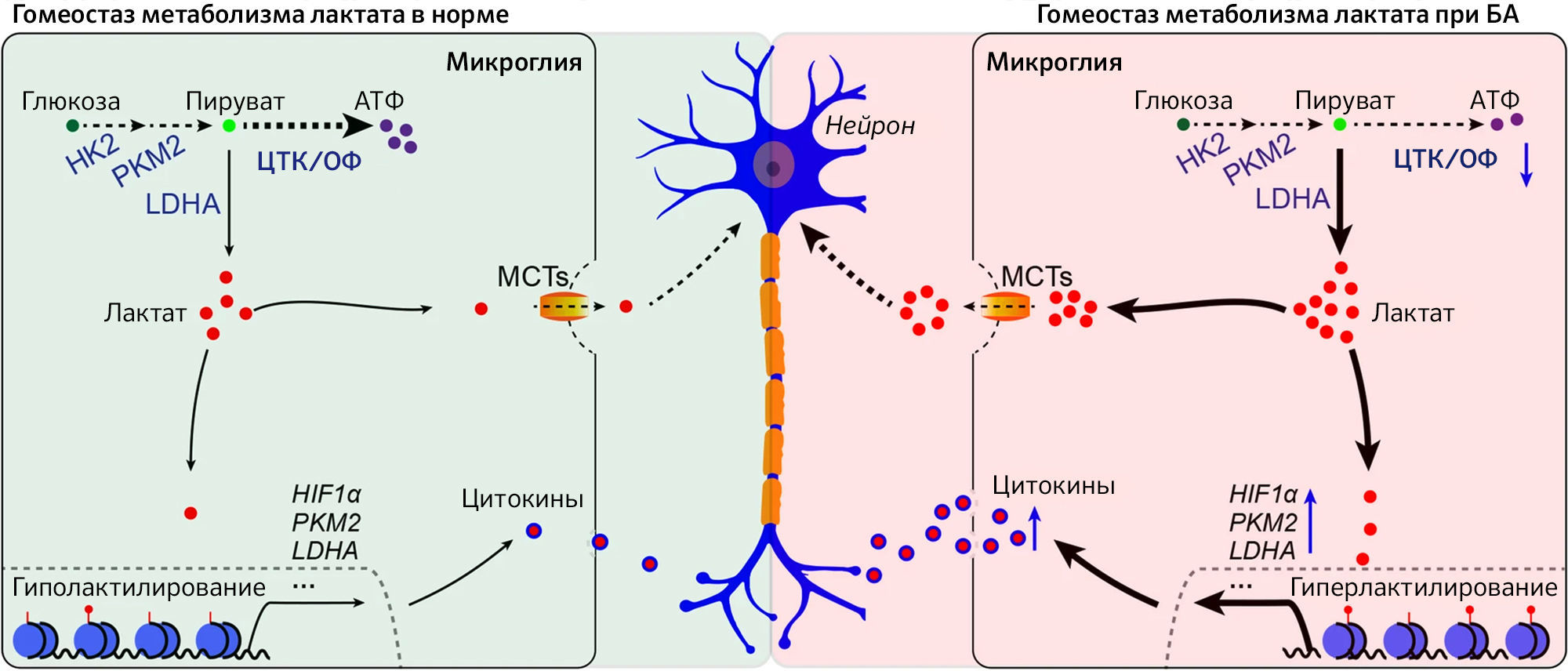
Рис. 2
В здоровом состоянии микроглия поддерживает гомеостаз метаболизма лактата. Однако с возрастом или в процессе развития болезни Альцгеймера микроглия усиливает экспрессию гликолитических ферментов и переключает метаболизм с окислительного фосфорилирования (ОФ) на аэробный гликолиз, что приводит к накоплению лактата и гиперлактилированию гистонов. С одной стороны, лактат выводится во внеклеточное пространство через монокарбоксилатные транспортеры (MCT), усиливая ацидоз и провоцируя нейротоксичность. С другой стороны, лактат транспортируется в ядро, где вызывает лактиляцию гистонов, что, в свою очередь, активирует транскрипцию гликолитических генов, усиливая нарушение метаболизма лактата и нейровоспаление в патогенезе болезни Альцгеймера [11].
В случае болезни Паркинсона особо уязвимы дофаминергические нейроны. Их высокая метаболическая активность делает их чувствительными к дефициту энергии и дисфункции астроцитов. Поражаемые болезнью Паркинсона области мозга, в частности, черная субстанция, содержат относительно меньшее количество астроцитов, чем другие части мозга, что, как считается, дополнительно делает дофаминергические нейроны уязвимыми к разрушению.
Депривация глюкозы и повышенное поступление лактата, возникающее при метаболическом сдвиге, способствует синтезу и накоплению белка ?-синуклеина, что приводит к окислительному стрессу и дальнейшему разрушению дофаминергических нейронов.
Лактат способен активировать глиальные клетки, способствуя высвобождению провоспалительных цитокинов и нейровоспалению. Кроме того, он может изменять синтез жирных кислот, способствуя образованию липидных капель, которые в свою очередь активируют глию и усиливают воспалительный процесс. Нейровоспаление, окислительный стресс и митохондриальная дисфункция усугубляют дегенерацию нейронов, а также способствуют накоплению ?-синуклеина и образованию телец Леви. Кроме того, астроциты могут превращать L-DOPA в дофамин, и при метаболических нарушениях не могут обеспечивать адекватных уровней этого нейромедиатора, что усугубляет клинические проявления заболевания и снижает эффективность лечения [1, 2, 12].
Лактат и онкогенез
Хотя лактат в большинстве случаев выполняет защитную функцию, его избыток может способствовать росту опухолей головного мозга, в частности глиобластомы. Лактат действует как сигнальная молекула, активирующая HCAR1, что помимо положительных эффектов может способствовать трансформации эпителия в мезенхиму. Исследования показали, что глиобластомные клетки активно используют лактат в качестве метаболического субстрата, что способствует их выживанию и росту. Лактат увеличивает экспрессию монокарбоксилатных транспортеров MCT1 и HCAR1, которые в большом количестве находятся на опухолевых клетках, чем обусловлена их повышенная адаптация к гипоксическим условиям.
Более того, лактат играет роль сигнальной молекулы в опухолевом микроокружении, усиливая ангиогенез и способствуя инвазии опухоли. Он активирует путь PI3K/Akt, который участвует в регуляции клеточной пролиферации и устойчивости к апоптозу. Это делает метаболизм лактата важной терапевтической мишенью при лечении глиобластомы, поскольку ингибирование его транспорта может снизить скорость роста опухолевых клеток и их адаптационные возможности в условиях дефицита питательных веществ и кислорода [10].
Несмотря на то, что гипотеза астроцит-нейрон-лактатного челнока подкреплена множеством работ, было также показано, что при определенной стимуляции в нейронах протекает гликолиз с образованием лактата. Это указывает на то, что астроцит-нейрон-лактатный челнок может быть только одним из метаболических путей в нейронах, реализующимся в определенных условиях и на данный момент все еще изучается, в каких именно [1].
Заключение
Лактат играет центральную роль в метаболизме мозга, выполняя как энергетические, так и сигнальные функции. Он не только обеспечивает нейроны энергией, но и участвует в регуляции синаптической пластичности, нейропротекции и нейрогенезе.
Его роль в патогенезе нейродегенеративных заболеваний делает лактат перспективной мишенью для терапии болезней Альцгеймера и Паркинсона. Исследования показывают, что модуляция лактатного обмена может уменьшить накопление ?-синуклеина, снизить уровень воспаления и улучшить энергетическое снабжение нейронов. В контексте инсульта и черепно-мозговых травм использование лактата может помочь ограничить повреждения и ускорить восстановление нервной ткани. Кроме того, лактат может служить мишенью для лечения глиобластомы, так как путь с участием лактата задействован в росте и инвазии этой опухоли.
Литература
1. Горина Я. В., Салмина А. Б., Ерофеев А. И. и др. Метаболическая пластичность астроцитов //Журнал эволюционной биохимии и физиологии. — 2021.
2. Wu A., Lee D., Xiong W. Lactate Metabolism, Signaling, and Function in Brain Development, Synaptic Plasticity, Angiogenesis, and Neurodegenerative Diseases //International Journal of Molecular Sciences. — 2023. DOI: 10.3390/ijms241713398.
3. Lajtha A. Handbook of neurochemistry and molecular neurobiology: brain energetics //Integration of molecular and cellular processes. – 2007.
4. Mason S. Lactate Shuttles in Neuroenergetics–Homeostasis, Allostasis and Beyond //Frontiers in Neuroscience. — 2017DOI: 10.3389/fnins.2017.00043.
5. Petit, Jean-Marie et al. Genes involved in the astrocyte-neuron lactate shuttle (ANLS) are specifically regulated in cortical astrocytes following sleep deprivation in mice //Sleep — 2013. Doi:10.5665/sleep.3034
6. Fern?ndez-Moncada I., Fundazuri U. B., Lavanco G. и др. A lactate-dependent shift of glycolysis mediates synaptic and cognitive processes //bioRxiv. — 2023. DOI: 10.1101/2023.03.15.532748.
7. Babenko V. A., Varlamova E. G., Saidova A. A., Turovsky E. A., Plotnikov E. Y. Lactate protects neurons and astrocytes against ischemic injury by modulating Ca2+ homeostasis and inflammatory response //FEBS Journal. — 2024. DOI: 10.1111/febs.17051.
8. Bhatti, M.S., Frostig, R.D. Astrocyte-neuron lactate shuttle plays a pivotal role in sensory-based neuroprotection in a rat model of permanent middle cerebral artery occlusion //Sci Rep. — 2023. DOI: 10.1038/s41598-023-39574-9
9. Colucci A. C., Tassinari I. D., Loss E. D., de Fraga L. S. History and Function of the Lactate Receptor GPR81/HCAR1 in the Brain: A Putative Therapeutic Target for the Treatment of Cerebral Ischemia //Neuroscience. — 2023. DOI: 10.1016/j.neuroscience.2023.06.022.
10. Longhitano L., et al. Lactate Induces the Expressions of MCT1 and HCAR1 to Promote Tumor Growth and Progression in Glioblastoma //Frontiers in Oncology. — 2022. DOI: 10.3389/fonc.2022.871798.
11. Zhao, Y., Xu, H. Microglial lactate metabolism as a potential therapeutic target for Alzheimer’s disease //Mol Neurodegeneration — 2022 DOI: 10.1186/s13024-022-00541-z
12. Sian-Hulsmann, J.; Riederer, P.; Michel, T.M. Metabolic Dysfunction in Parkinson’s Disease: Unraveling the Glucose–Lipid Connection //Biomedicines. — 2024. DOI: 10.3390/biomedicines12122841
Источник: medach.pro