Об открытии микроРНК и их роли в посттранскрипционной регуляции работы генов
МЕНЮ
Главная страница
Поиск
Регистрация на сайте
Помощь проекту
Архив новостей
ТЕМЫ
Новости ИИ
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Искусственный интеллект
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Психология ИИ
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Творчество ИИ
Техническое зрение
Чат-боты
Авторизация
2024-11-17 11:29

Эволюция многоклеточных организмов от одноклеточных предков, где каждый тип клеток приобрел специализированные функции, требовала все более сложных механизмов регуляции экспрессии генов. Помимо транскрипционной регуляции, опосредованной факторами, связывающимися с ДНК, которые действуют на регуляторные последовательности, по мере появления все более сложно организованных организмов возникли и другие формы систем контроля. На протяжении сотен миллионов лет гены крошечных некодирующих молекул РНК, называемых микроРНК, распространялись по геномам многоклеточных организмов, осуществляя посттранскрипционный контроль стабильности мРНК и трансляции белков. МикроРНК и то, каким образом они осуществляют регуляцию работы генов, оставались совершенно неизвестным явлением до открытия Виктором Амбросом и Гэри Равканом в 1993 году. Два лауреата Нобелевской премии исследовали мутантных нематод C. elegans с дефектами развития, вызванными изменениями в генетических локусах lin-4 и lin-14. Специалисты из лаборатории Амброса клонировали ген lin-4 и обнаружили, что он не кодирует белок. Вместо этого в нем была закодирована короткая некодирующая РНК из 22 нуклеотидов. Одновременно с этим ученые из лаборатории Рувкуна определили, что lin-4 регулирует lin-14 посредством нескольких элементов в его 3' нетранслируемой области (3'-UTR). Сравнив информацию о последовательности, они выявили частичную комплементарность последовательностей между короткой некодирующей РНК lin-4 и элементами 3'-UTR lin-14. Это стало первым подходом к изучению концептуально нового типа регуляторных РНК — микроРНК. В 2000 году лаборатория Рувкуна обнаружила высококонсервативную микроРНК let-7, а впоследствии гомологичные микроРНК были идентифицированы у различных видов животных, в том числе у людей. Это привело к тому что все больше усилий было направлено на клонирование и секвенирование для обнаружения микроРНК у представителей всего животного мира. Вследствие этого было установлено, что микроРНК — это большая группа регуляторов, контролирующих работу обширных сетей генов, кодирующих белки. Открытие Амброса и Рувкуна оказалось совершенно неожиданным и раскрыло эволюционно консервативный механизм посттранскрипционной регуляции экспрессии генов, опосредованный микроРНК, который играет решающую роль в онтогенезе и функционировании тканей взрослого животного организма.
Введение
Контроль того, когда и где конкретный ген должен транскрибироваться в РНК и транслироваться в белок, является фундаментальным аспектом существования жизни (см. рис. 1). Например, инсулин вырабатывается в ?-клетках островков поджелудочной железы, тогда как опсины экспрессируются в сетчатке глаза. Инструкции по точной регуляции генов, специфичной для того или иного типа клеток, закодированы в самом генетическом материале и работают благодаря ДНК-связывающим белкам, узнающим определенные последовательности. За открытие того, как регулируются гены, Франсуа Жакоб и Жак Моно были удостоены Нобелевской премии по физиологии и медицине в 1965 году. У одноклеточных и многоклеточных эукариот спектр ДНК-связывающих факторов транскрипции является довольно консервативной системой (King et al., 2008), тогда как у многоклеточных организмов развились дополнительные уровни регуляции генов, чтобы гарантировать правильное производство РНК и белков в любой момент времени в каждом типе клеток.
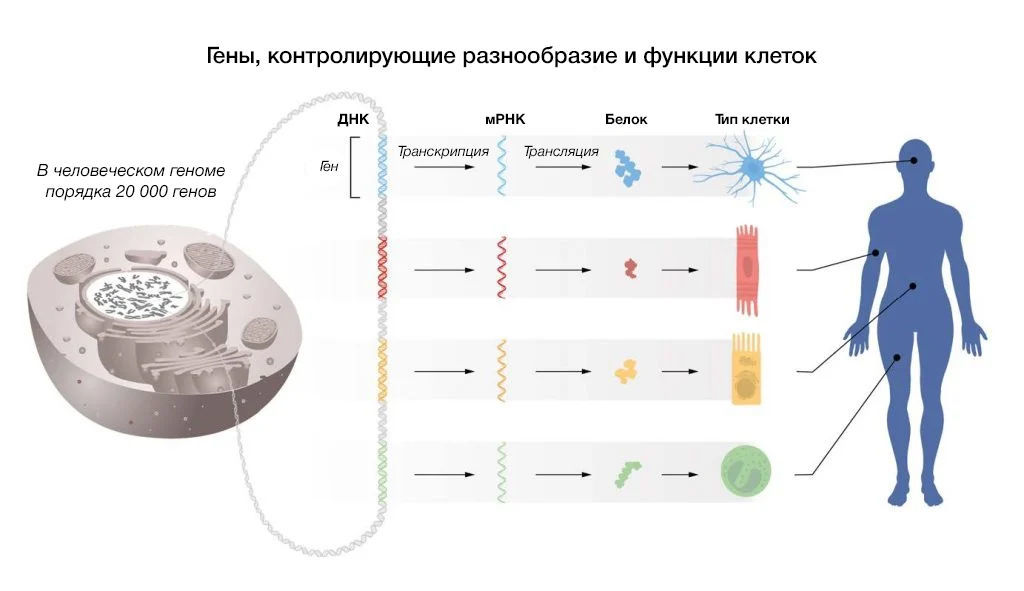
Рис. 1 | Регуляция клеточно-специфических функций.
В каждой клетке содержится одинаковый набор хромосом и, следовательно, одинаковый набор генов. Клеточно-специфические функции оказываются возможны только тогда, когда в каждом типе клеток активируется определенная группа генов.
Эукариотические модельные организмы бесценны для генетических исследований, ведь благодаря им удалось совершить множество неожиданных открытий. Более пятидесяти лет назад Сидни Бреннер предложил для этой роли червя-нематоду Caenorhabditis elegans (C. elegans). Высокая скорость смены поколений, прозрачное тело и простота генетических манипуляций стали теми факторами, которые способствовали молекулярно-биологическим исследованиям на этом животном. Сидни Бреннер, Джон Салстон и Роберт Хорвиц изучали C. elegans, чтобы разгадать, как осуществляется контроль над делением, дифференцировкой и апоптозом во время эмбриогенеза органов. За свои открытия они были удостоены Нобелевской премии по физиологии и медицине 2002 года.
В 1970-х годах скрининг мутагенеза C. elegans, проведенный в лаборатории Бреннера, выявил мутанта lin-4 (e912). У этих червей оказался поразительный фенотип: многие типы клеток и морфологические структуры полностью отсутствовали, а из-за сбоя в развитии вульвы яйца накапливались внутри особи (рис. 2) (Horvitz and Sulston, 1980; Chalfie, Horvitz and Sulston, 1981). По всей видимости, причиной тому было повторение программ развития определенных клеточных линий.
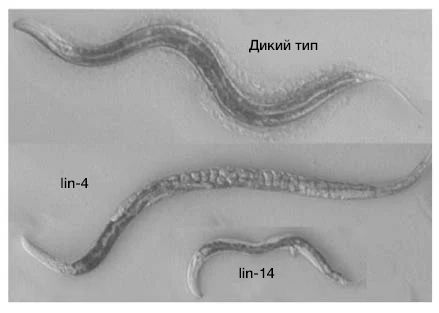
Рис. 2 | Гетерохронные мутанты — нематоды с дефектами эмбрионального развития.
Нематоды с мутантными генами lin-4 и lin-14 — животные с нарушением эмбриогенеза. У червей с мутантным lin-4 повторяются программы развития клеточных линий, вследствие чего у самок накапливаются яйцеклетки, а вульва не формируется, в то время как мутанты lin-14 небольшого размера и лишены личиночной фазы развития.
Выраженное нарушение развития червя, наблюдаемое у мутантов lin-4, предполагает, что lin-4 кодирует главный регулятор временного хода развития. Было описано большое количество других гетерохронных мутантов с различными дефектами эмбриогенеза, как например, второй мутант — lin-14, — которого обнаружили в лаборатории Хорвица (Ferguson, Sternberg and Horvitz, 1987).
Тем временем Виктор Амброс присоединился к лаборатории Хорвица после окончания работы с Дэвидом Балтимором над своей диссертацией PhD, посвященной структуре и репликации генома полиовируса. Будучи постдокторантом, Амброс немедленно приступил к генетическому анализу гетерохронных мутантов и определил, что у lin-14 имеются онтогенетические нарушения временного хода развития, которые были противоположны тем, что наблюдались у мутанта lin-4 (рис. 2). У мутантов lin-14 программы развития на личиночной стадии полностью отсутствовали (Амброс и Хорвиц, 1984). Примечательно, что, как позже обнаружил Амброс, lin-4 является отрицательным регулятором lin-14 (Ambros, 1989).
В этот период Гэри Равкан защитил докторскую диссертацию по генетике бактерий под руководством Фредерика Аузубеля. Путешествуя по Европе, он заинтересовался генетикой червей, узнав об анализах клеточных линий гетерохронных мутантов (Chalfie, Horvitz and Sulston, 1981; Ruvkun, Wightman and Ha, 2004). Последующие обсуждения с Мартином Чалфи и Робертом Хорвицем еще больше подогрели его интерес к использованию C. elegans для изучения данных вопросов. В 1982 году Рувкун начал проведение совместных исследований с лабораториями Уолтера Гилберта и Роберта Хорвица.
Открытие посттранскрипционной регуляции генов посредством микроРНК
В лаборатории Хорвица Амброс и Рувкун начали долгую работу по клонированию lin-14. В то время выявление последовательности ДНК для генетически определенного локуса было сложной задачей. После многих лет упорных экспериментов они успешно идентифицировали область генома, используя классический подход полиморфизма длины рестрикционных фрагментов (Ruvkun et al., 1989). В этот период и Амброс, и Рувкун получили должности преподавателей (Амброс — в Гарвардском университете, а Рувкун — в Клинической больнице штата Массачусетс и Гарвардской медицинской школе). Преданные теме своего исследования, они продолжили молекулярный анализ. Рувкун показал, что lin-14 является ядерным белком, экспрессирующимся на определенных стадиях онтогенеза, экспрессия высока на стадии L1 и изменяется у мутантов lin-4 и lin-14 (Ruvkun and Giusto, 1989). Интересно, что были обнаружены мутанты lin-14 с приобретением функции с делециями в 3'-UTR (Ruvkun и Giusto, 1989; Wightman и др., 1991), что привело к тому, что белок lin-14 обнаруживался и по завершении стадии L1 (Arasu, Wightman and Ruvkun, 1991; Wightman et al., 1991). Разрушение элементов 3'-UTR не оказало влияния на аминокислотную последовательность белка, поэтому Рувкун предположил, что, по всей видимости, переключение в определенный момент времени у lin-14 опосредовал посттранскрипционный механизм, влияющий на стабильность мРНК, ядерный экспорт или трансляцию (Wightman et al., 1991).
В отличие от мутантов lin-14, которых удалось выявить несколько, был обнаружен только один мутант lin-4 (e912). Лаборатория Амброса приступила к клонированию гена lin-4, используя полиморфизм длин рестрикционных фрагментов и Саузерн-блоттинг. «Прогуливаясь по хромосоме» и многократно проверяя меньшие геномные фрагменты на их способность спасать фенотип мутантов lin-4, они определили фрагмент рестрикционного фермента Sal l длиной 693 пары оснований. После многократных предсказаний открытой рамки считывания и повторного секвенирования клонов для исключения ошибок ученые заподозрили, что ген lin-4 может быть некодирующей РНК из-за его короткой последовательности открытой рамки считывания (ОРС). Мутации сдвига рамки, введенные в геном C. elegans, не повлияли на функцию lin-4, что подтвердило это предположение. В 1991 году лаборатория начала исследовать транскрипт lin-4 с помощью нозерн-блоттинга и анализа защиты от РНКазы, выявив два коротких транскрипта РНК длиной 61 и 22 нуклеотида (нт) (рис. 3).
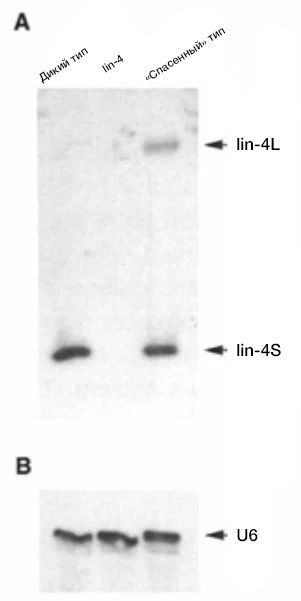
Рис. 3 | Идентификация двух коротких транскриптов lin-4.
Нозерн-блот всей РНК из дикого типа, мутанта lin-4 (e912) и мутанта lin-4 (e912), чей фенотип был спасен благодаря фрагменту Sal I. Транскрипты были обнаружены с помощью введения радиоактивно меченного РНК-зонда lin-4; проводилось сравнение с контролем для нанесения U6.
Независимо определив последовательности как lin-4 (лаборатория Амброса), так и lin-14 (лаборатория Рувкуна), вечером 11 июня 1992 года Амброс и Рувкун обменялись данными по ним. Оба заметили очевидную частичную комплементарность между некодирующей РНК lin-4 и несколькими элементами в 3'-UTR lin-14 (рис. 4).
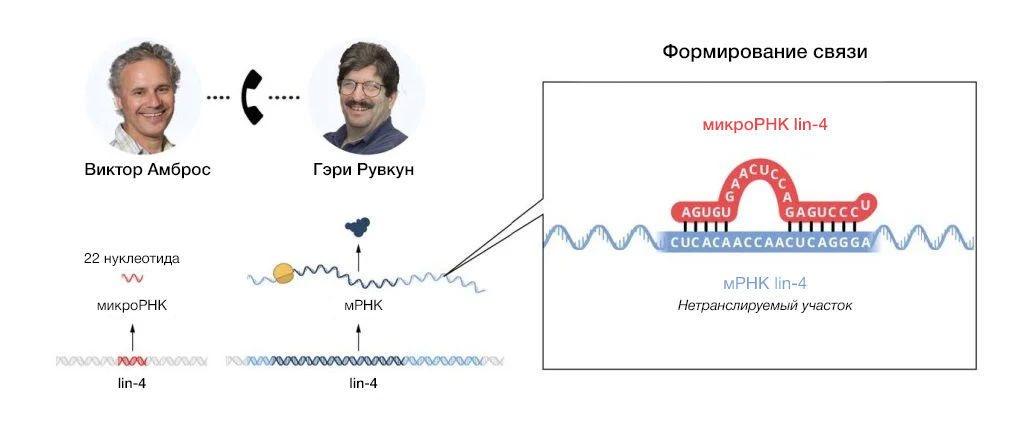
Рис. 4| Комплементарные элементы последовательности в РНК lin-4 и lin-14
При сравнении клонированных последовательностей для lin-4 и lin-14 было выявлено, что короткая РНК lin-4 длиной 22 нуклеотида была частично комплементарна повторяющимся элементам в области 3’-UTR lin-14.
Осознавая значимость своего наблюдения, обе лаборатории провели ряд дополнительных экспериментов, демонстрирующих, что микроРНК lin-4 регулирует работу мРНК lin-14 посредством спаривания азотистых оснований с элементами, расположенными в [области] 3'-UTR. Фундаментальное открытие ученых было представлено в двух статьях, опубликованных одна за другой в Cell в 1993 году (Lee, Feinbaum and Ambros, 1993; Wightman, Ha and Ruvkun, 1993).
Лаборатория Амброса использовала последовательность lin-4 C. elegans для идентификации соответствующих клонов-носителей lin-4 у других видов нематод (C. briggsae, C. remanei и C. vulgaris). В ходе проведенных экспериментов было показано, что клоны lin-4 других нематод могут спасти фенотип мутанта lin-4 у C. elegans. Был также проведен скрининг более 20 000 мутагенизированных хромосом для выявления второго мутанта lin-4 (ma161), у которого была однонуклеотидная мутация. Примечательно, что эта мутация присутствовала в комплементарной последовательности, следовательно, комплементарность оснований микроРНК lin-4 и элементов 3'-UTR lin-14 по отношению друг ко другу действительно функционально значима (Lee, Feinbaum and Ambros, 1993).
Лаборатория Рувкуна сравнила количество РНК и белка lin-14 у дикого типа и у мутантов с приобретением функции lin-14. Титр белка lin-14 у мутантов был повышен в 4–7 раз, содержание же РНК в обеих группах не различалось; это свидетельствует о том, что lin-14 регулируется уже после транскрипции РНК. Перенос 3'-UTR из гена lin-14 в репортерный ген привел к посттранскрипционной регуляции репортерного гена, которая была сходна с таковой для lin-14. Это говорит о том, что гетерологичного фрагмента 3'-UTR было вполне достаточно для контроля трансляции мРНК. В ходе экспериментов многократно проводился перенос меньших фрагментов 3'-UTR гена lin-14 в ген-репортер, до тех пор, пока не был идентифицирован функциональный фрагмент 3'-UTR длиной 124 нт. Эта область 3'-UTR содержала несколько последовательностей, частично комплементарных lin-4, и, кроме того, она присутствовала у C. briggsae (Wightman, Ha and Ruvkun, 1993).
Был проведен статистический анализ-сравнение недавно обнаруженной микроРНК lin-4 с обширной базой данных нуклеотидных последовательностей всех видов; в результате совпадающие последовательности были выявлены исключительно среди других нематод Caenorhabditis, например, C. briggsae. Ключевым вопросом оставалось то, было ли наличие микроРНК особенностью, уникальной для нематод, или же она сохранилась во всем животном мире (с далеко идущими функциональными последствиями)?
Открытие эволюционно консервативной микроРНК let-7
После новаторского открытия первой микроРНК — lin-4 — прошло семь лет, прежде чем был обнаружен второй ген микроРНК, let-7. В лаборатории Рувкуна провели генетический скрининг, сосредоточившись на мутантах, которые подавляли синтетический стерильный фенотип штамма, несущего мутации в локусах lin-14 и egl-35 (Reinhart et al., 2000). Оказалось, что let-7 кодирует короткую РНК из 21 нуклеотида, которая была комплементарной к 3'-UTR различных генов, ассоциированных с гетерохронией при онтогенезе, таких как lin-14, lin-28, lin-41, lin-42 и daf-12. Утрата let-7 приводила к повторению судьбы личиночных клеток у взрослых животных. Обнаружение второго гена микроРНК позволило предположить, что микроРНК могут играть более широкую роль в регуляции сроков формирования клеточных линий на разных стадиях развития.
Следующий прорыв произошел, когда ученые из лаборатории Рувкуна обнаружили, что ген let-7, в отличие от lin-4, эволюционно более консервативен у большого количества животных. В результате сравнения последовательностей микроРНК let-7 с базами данных нуклеотидов были обнаружены совпадающие последовательности как у плодовой мушки, так и у человека (Pasquinelli et al., 2000). Одной из идентифицированных мишеней let-7 у нематод был lin-41 (Reinhart et al., 2000) — белок, ортологи которого найдены у рыбок данио и дрозофилы. Обнадеживает то, что 3'-UTR ортологических последовательностей lin-41 как у рыбки данио, так и у плодовых мушек оказались комплементарны к let-7 (Pasquinelli et al., 2000). Кроме того, микроРНК let-7 была обнаружена в некоторых тканях человека, что указывает на ее значимость для экспрессии генов в клетках млекопитающих в целом.
Как и в случае с нематодами, анализ онтогенеза плодовой мушки показал регуляцию экспрессии микроРНК let-7 во времени, что предполагает консервативную роль let-7 у насекомых, ракообразных и нематод (Pasquinelli et al., 2000). Примечательно, что временная экспрессия let-7 была обнаружена даже у взрослых стадий моллюсков и кольчатых червей (Pasquinelli et al., 2000), т. е. у видов, которые в ходе онтогенеза не проходят стадию личинки. Более того, у позвоночных не наблюдается отчетливых личиночных стадий, однако существует хронозависимая регуляция экспрессии let-7 в ходе онтогенеза (например, такая экспрессия хорошо выражена у рыбок данио). Поразительно, но оказалось, что экспрессия let-7 регулируется в течение онтогенеза у билатерально-симметричных животных, и, возможно, эволюция такой экспрессии происходила после появления этих животных из диплобластических организмов, т. е. тех, которые развиваются из двух первичных зародышевых листков, а не из трех (в числе последних — люди и другие позвоночные) (рис. 5). Открытие крайне эволюционно консервативного let-7 в значительной степени повысило интерес к микроРНК как посттранскрипционным регуляторам экспрессии генов.
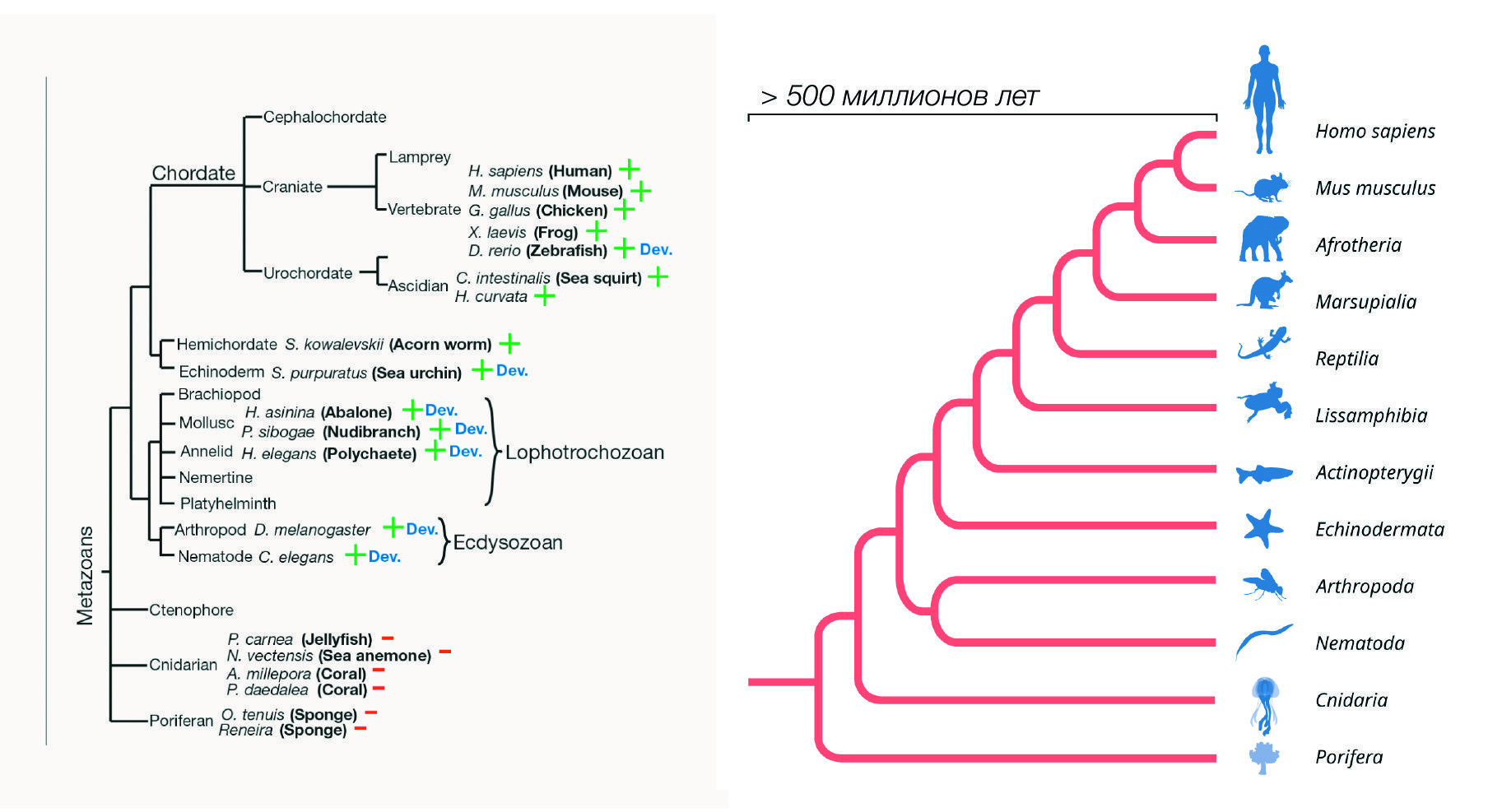
Рис. 5| Эволюционный консерватизм экспрессии РНК let-7 и микроРНК.
Слева: Эволюционное древо многоклеточных, на котором выделены ветви, в которых экспрессия микроРНК let-7 присутствует (+) или те, где экспрессия let-7 не обнаружена (–). Виды со схожим паттерном экспрессии РНК let-7 в ходе развития (let-7 отсутствует на ранних стадиях, однако ко взрослому возрасту начинает экспрессироваться) обозначены как «Dev.» (Pasquinelli et al., 2000).
Справа: Гены микроРНК эволюционировали в геномах различных многоклеточных организмов на протяжении более 500 миллионов лет.
После обнаружения let-7 несколько исследовательских лабораторий попытались выявить и другие микроРНК у человека и других животных с помощью клонирования малых РНК. Ученые лаборатории Томаса Тушла клонировали новые микроРНК из тканей человека и плодовой мушки (Lagos-Quintana et al., 2001), а в лабораториях Дэвида Бартеля и Амброса были выделены новые микроРНК у нематоды (Lau et al., 2001; Lee and Ambros, 2001). Теперь полученные свидетельства превращались в убедительные доказательства: у животных существует обширный класс регуляторных микроРНК, по всей видимости, играющих важную роль в регуляции экспрессии генов. С тех пор, благодаря достижениям в области молекулярной биологии и технологий секвенирования, в геноме человека были выявлены более тысячи генов микроРНК. В настоящее время база данных генов микроРНК miRBase содержит более 38 000 последовательностей предшественников (имеющих структуру шпилек) и 48 860 последовательностей генов зрелых микроРНК у 271 видов (Kozomara, Birgaoanu и Griffiths-Jones, 2019). Оказалось, что гены микроРНК есть даже в геноме вирусов (Pfeffer et al., 2004).
Клонирование дополнительных микроРНК и доступность полных геномных последовательностей предоставляет новые возможности для определения правил спаривания оснований между микроРНК и 3'-UTR-регионами. Основные исследования, проведенные в лабораториях Дэвида Бартеля, Кристофера Берджа и Стивена Коэна (Lewis et al., 2003; Stark et al., 2003; Brennecke et al., 2005; Lewis, Burge and Bartel, 2005) с применением комбинированных экспериментальных и сравнительных геномных подходов, прояснили общие правила распознавания мишеней микроРНК. Эти исследования показали, что микроРНК, как правило, частично комплементарны к мРНК-мишеням, а именно — в затравочной области микроРНК (т.н. “seed” region). В ходе этой работы было обнаружено, что каждая микроРНК, вероятно, регулирует несколько генов, кодирующих белки, поскольку многим мРНК c 3'UTR присуща крайняя консервативность последовательностей, комплементарных затравкам микроРНК (Brennecke et al., 2005; Lewis, Burge and Bartel, 2005). Интересно, что гены, экспрессирующиеся совместно с микроРНК, специфичными для определенных типов или линий клеток, лишены сайтов-мишеней для этой конкретной микроРНК. Напротив, такие сайты-мишени микроРНК присутствуют в генах, экспрессируемых в соседних клетках и тканях (Farh et al., 2005; Stark et al., 2005). Эти наблюдения подтверждают гипотезу о том, что микроРНК выполняют важные функции в формировании клеточных линий и стабильности типов клеток у многоклеточных организмов.
Биогенез и функция микроРНК
Наряду с клонированием других генов микроРНК интенсивные усилия нескольких групп исследователей были направлены на понимание биогенеза микроРНК и механизмов их действия (Bartel, 2004). Стратегии транскрипции генов микроРНК различаются. Многие гены микроРНК являются независимыми транскрипционными единицами, иногда они присутствуют в составе кластеров, в то время как другие находятся в интронах генов, кодирующих белки. Классические первичные микроРНК (pri-микроРНК) транскрибируются РНК-полимеразой II и являют собой последовательность со структурой шпильки. В ядре такая шпилька служит субстратом для обработки «микропроцессором», гетеротримерным комплексом, в составе которого присутствует эндонуклеаза Drosha. Этот комплекс служит для расщепления обеих цепей с получением предшественника микроРНК (pre-микроРНК) длиной, как правило, 60–70 нуклеотидов, который и был впервые обнаружен в лаборатории Амброса (рис. 2). Экспортин 5 и RAN-GTP облегчают транспорт pre-микроРНК в цитоплазму. Последующая обработка эндонуклеазой Dicer, изначально обнаруженной в лаборатории Грега Хэннона (Bernstein et al., 2001), приводит к образованию дуплекса микроРНК. Эффективная цепь микроРНК загружается в комплекс сайленсинга, содержащий белок Argonaute, тогда как другая «пассажирская» цепь вытесняется (Schwarz et al., 2003). Как только происходит загрузка цепи микроРНК, она может осуществлять специфическую для последовательности негативную регуляцию мРНК за счет снижения уровня трансляции и/или деградации мРНК. В регуляции участвуют адаптерный белок TNRC6 и полиА-связывающий белковый комплекс PABPC. Они вовлекают в процесс деаденилазные комплексы, которые укорачивают полиА-«хвост» мРНК, что приводит к деградации мРНК и ингибированию трансляции в зависимости от внутренних потребностей клетки (например, на определенной стадии онтогенеза или для реализации выполняемых клеткой функций).
Аппарат, который обрабатывает и реализует функцию микроРНК, также используется в других механизмах сайленсинга на основе РНК, обычно известных как РНК-интерференция (РНКи). К ним относятся короткие интерферирующие РНК (киРНК), эндогенные piwi-ассоциированные РНК (piRNA) и малые интерферирующие РНК, ассоциированные с повторами (rasiRNA). Открытие того, что двухцепочечная РНК может индуцировать зависимый от последовательности сайленсинг гена (Fire et al., 1998), принесло Эндрю З. Файру и Крейгу К. Мелло Нобелевскую премию по физиологии и медицине 2006 года. В то время как РНКи в первую очередь выполняет функцию защиты от вирусных инфекций (у растений и животных, стоящих на низких эволюционных ступенях) и от нежелательной активности мобильных элементов генома, микроРНК осуществляют посттранскрипционный контроль над мРНК на протяжении всего развития и во всех типах взрослых клеток. С этой целью у микроРНК развилась частичная комплементарность по отношению к последовательностям их мРНК-мишеней, чтобы «настроить» соответствующие эффекты для каждой мРНК-мишени. При этом, например, киРНК часто являются экзогенными и обладают полной комплементарностью к определенным последовательностям-мишеням РНК, которые подвергаются расщеплению. В 1999 году Дэвид Болкомб показал, что посттранскрипционный сайленсинг генов в растениях включает процессинг коротких РНК со специфичностью к последовательностям-мишеням (Гамильтон и Болкомб, 1999), благодаря чему формируется более целостная картина.
Эволюция микроРНК и их физиологические роли
Появление и распространение генов микроРНК тесно связано с эволюцией более сложных организмов (рис. 5). В ходе ранней эволюции билатерально-симметричных животных количество генов микроРНК заметно увеличилось (Grimson et al., 2008; Wheeler et al., 2009), а их функциональные роли уже существовали у последнего общего предка всех билатерально-симметричных животных до разделения на первичноротых и вторичноротых (Christodoulou et al., 2010). С тех пор, в ходе эволюции клеток и тканей, у сложных организмов появились сотни новых генов микроРНК. Гены микроРНК были обнаружены даже у ранних многоклеточных: губок, растений и даже у двух видов одноклеточных эукариот. Поэтому возможно, что в ходе эволюции микроРНК могли возникать несколько раз: например, у линии ранних многоклеточных животных порядка 600 миллионов лет назад, или у общего предка растений и животных, у которого микроРНК существовали уже около миллиарда лет назад (Moran et al., 2017). Примечательно, что многие эволюционно древние гены микроРНК сохраняются в организмах, развившихся намного позднее, и что эти гены редко исчезают в ходе эволюции. Это говорит об их критически важной роли в регуляции генной экспрессии.
Существенная роль микроРНК в развитии многоклеточных организмов и функционировании тканей была продемонстрирована методом устранения компонентов в пути биогенеза микроРНК. Исчезновение Dicer, который обрабатывает pre-микроРНК в цитоплазме, является эмбрионально летальным фактором для мышей и рыбки данио (Bernstein et al., 2003; Wienholds et al., 2003). Удаление отдельных генов или групп генов микроРНК у плодовых мушек и мышей также вызывает выраженные нарушения в ходе онтогенеза (Bartel, 2018). Однако роли отдельных генов микроРНК могут быть неявными — вероятно, из-за избыточных функций нескольких генов микроРНК, у которых имеются общие последовательности-мишени. Хотя избыточность в системе представляет собой препятствие для изучения функции отдельных генов микроРНК, она также демонстрирует надежность системы и объясняет, почему ею не так легко манипулировать, как, например, это могли бы делать вирусы.
Чтобы подчеркнуть фундаментальную роль микроРНК, важно отметить, что эволюционно наиболее консервативные гены микроРНК, общие для билатерально-симметричных организмов, функционируют на ранних стадиях эмбрионального развития, тогда как микроРНК, развившиеся специфично у млекопитающих, работают на более поздних стадиях эмбриогенеза (DeVeale, Swindlehurst-Chan и Blelloch, 2021). Напротив, видоспецифичные гены микроРНК обычно играют важные роли в клетках взрослого организма, а не в эмбриональном развитии. Эти закономерности становятся очевидны из систематических экспериментов по нокауту генов микроРНК с различной эволюционной консервативностью. Конкретные регуляторные роли микроРНК во время онтогенеза у животных включают временной ход развития, формирование разных типов клеток и определение того, когда клетки должны подвергаться апоптозу, поддержание общей физиологии и гомеостаза тканей (DeVeale, Swindlehurst-Chan и Blelloch, 2021).
Функции микроРНК во взрослых клетках и тканях были выяснены путем избирательного удаления Dicer у трансгенных мышей. Удаление Dicer1 на ранних эмбриональных стадиях во время созревания В-клеток привело к остановке дифференцировки на стадии про-В-клеток (Коралов с соавт., 2008). Абляция Dicer1 на 15,5-й день эмбрионального развития в нейронах привела к ранней постнатальной смерти, которой предшествовала микроцефалия, ухудшение развития ветвей дендритов и увеличение длины дендритных шипиков (Davis et al., 2008). В постмитотических клетках Пуркинье мозжечка исчезновение Dicer1 в двухнедельном возрасте вызвало дегенерацию мозжечка и начало атаксии (отсутствие координированных движений мышц) (Schaefer et al., 2007). Сходным образом, исчезновение Dicer1 в дофаминергических нейронах среднего мозга привело к прогрессирующей гибели нейронов и снижению локомоторной активности (Kim et al., 2007). Выраженные патологические фенотипы наблюдались и у нескольких других типов клеток и тканей, что демонстрирует критически важную роль микроРНК как в процессах развития, так и в функционировании взрослых клеток.
Важность микроРНК для развития и функционирования организма человека становится очевидной, если обратить внимание на синдромы, связанные с мутациями в определенных генах микроРНК или компонентах путей их биогенеза. Синдром DICER1 — редкое наследственное заболевание, вызванное мутацией в гене DICER1, характерным проявлением которого является предрасположенность к развитию опухолей в почках, щитовидной железе, яичниках, шейке матки, яичках, мозге, глазах и легких. Часто один аллель DICER1 характеризуется мутацией в зародышевой линии, что выражается в его дисфункциональности; это снижает количество работающего в клетках белка DICER1. В организме людей с этим синдромом наблюдается склонность к другим соматическим мутациям и, как следствие, частому развитию опухолей в детстве (Foulkes, Priest and Duchaine, 2014).
Участок спаривания оснований (т. е. затравочная область) отдельных генов микроРНК короткий, что делает их менее подверженными случайным мутациям. Однако известны мутации в затравочных последовательностях генов микроРНК, которые связаны с развитием болезней. К ним относятся мутации в miRNA-96, которые ассоциированы с прогрессирующей потерей слуха (Menc?a et al., 2009; Sold? et al.), мутации в miRNA-184, вызывающие синдром EDICT — редкое офтальмологическое заболевание с гипоплазией радужной оболочки, эндотелиальной дистрофией и врожденной катарактой (Hughes et al., 2011; Iliff, Riazuddin and Gottsch, 2012; Lechner et al., 2013), и мутации в miRNA-140-5p, приводящие к врожденной патологии скелета (Grigelioniene et al., 2019). Для таких патологий, как метаболический синдром, сердечно-сосудистые заболевания, нейродегенеративные состояния и злокачественные новообразования, достигнуты успехи в разработке диагностических методов и терапии на основе микроРНК.
Заключение
Благодаря фундаментальному открытию Амброса и Рувкуна, а также многих других ученых, было обнаружено новое измерение в сфере регуляции экспрессии генов. В то время как белки в ядре регулируют транскрипцию и сплайсинг РНК, микроРНК контролируют трансляцию и деградацию мРНК в цитоплазме. Этот неожиданный уровень посттранскрипционной регуляции генов имеет решающее значение на протяжении всего эмбриогенеза животных и в различные типах клеток взрослого организма, а также критически важен для существования многоклеточных форм жизни.
Рикард Сандберг, PhD, профессор Каролинского института (Rickard.Sandberg@ki.se), член Нобелевского комитета
Источник: medach.pro