Замена небольшого участка генома на синонимичный заставляет бактерию иначе решать ту же эволюционную задачу
МЕНЮ
Главная страница
Поиск
Регистрация на сайте
Помощь проекту
Архив новостей
ТЕМЫ
Новости ИИ
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Искусственный интеллект
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Психология ИИ
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Творчество ИИ
Техническое зрение
Чат-боты
Авторизация
2022-01-15 12:54

Рис. 1. Бактерия Pseudomonas fluorescens (трансмиссионная электронная микрофотография). Хорошо видны ее многочисленные жгутики (желтые). Ширина поля зрения — ~6,5 мкм. Фото с сайта sciencephoto.com
Биологическая эволюция базируется на двух основных процессах: мутационной изменчивости и естественном отборе. Мутационная изменчивость выступает в роли поставщика эволюционного материала, производя случайным образом разные мутации, из которых отбор сохраняет лишь полезные. Таким образом, согласно общепринятому представлению, именно отбор выполняет направляющую роль в эволюции и именно от него зависит, какими окажутся генотипы потомков, после того как в ряду поколений организмы адаптировались к какому-то новому неблагоприятному фактору среды. Однако ученые из Великобритании, работая с двумя близкими, но немного разными штаммами бактерии Pseudomonas fluorescens с искусственно поломанной системой формирования жгутиков, показали, что сам процесс мутагенеза может иметь весьма закономерный характер и оказывается порой не менее значимым в предопределении конечного генофонда эволюционирующей и адаптирующейся популяции, чем фактор отбора. Спектры новообретенных мутаций, позволивших бактериям заново получить рабочий жгутик, оказались для разных штаммов разными, но хорошо воспроизводились в повторных экспериментах. А перестановка небольшого фрагмента ДНК между штаммами заставляла их переключаться с одного эволюционного пути на другой.
В возглавляемой Тиффани Тейлор (Tiffany B. Taylor) лаборатории, относящейся к университету города Бат (графство Сомерсет, Англия), уже давно работают с простым, маленьким, неприхотливым и при этом очень интересным модельным объектом — бактерией Pseudomonas fluorescens.
Pseudomonas fluorescens — палочковидные грамотрицательные бактерии. Эти микроорганизмы обладают несколькими средствами для активного перемещения по поверхностям твердых субстратов. Во-первых, они могут небыстро передвигаться, «расползаясь» по поверхности твердого субстрата (таковым может быть почва в дикой природе, или агар в лабораторной чашке Петри), выделяя биосурфактант вискозин — небольшой биогенный пептид, который не следует путать с одноименным искусственным сурфактантом (см. M. V. Laycock et al., 1991. Viscosin, a potent peptidolipid biosurfactant and phytopathogenic mediator produced by a pectolytic strain of Pseudomonas fluorescens). Во-вторых, эти бактерии могут плавать при помощи жгутиков (при условии, что твердый субстрат покрыт хотя бы очень тонким слоем жидкости). Второй способ передвижения быстрее.
В лаборатории можно получить мутантные линии бактерий P. fluorescens, полностью лишенные возможности активного передвижения по субстрату. Эти мутанты прекрасно себя чувствуют, когда их выращивают в жидком питательном бульоне с активным перемешиванием, но вот на плотной среде с агаром они быстро выедают питательные вещества в зоне роста колонии, а потом начинают голодать и... думаете, вымирают? Как бы не так! Нет, они эволюционируют!
Фокус внимания Тейлор и ее коллег направлен на выяснение того, как именно осуществляется адаптация у бактерий, какова роль мутаций и отбора в этой адаптации, есть ли закономерности в процессе адаптивной эволюции и чем они обусловлены.
У бактерий имеются гены, которые кодируют структурные белки, непосредственно формирующие нить жгутика; еще ряд генов кодирует белки мотора, который, собственно, приводит жгутик в движение. Экспрессия всех этих генов, собранных в общий оперон, регулируется особым белком FleQ (S. K. Arora et al., 1997. A transcriptional activator, FleQ, regulates mucin adhesion and flagellar gene expression in Pseudomonas aeruginosa in a cascade manner). Этот белок, выполняющий функцию фактора транскрипции, взаимодействует, с одной стороны, с определенными последовательностями ДНК вблизи точки начала транскрипции, а с другой стороны — с одной из субъединиц РНК-полимеразы, которая, собственно, обеспечивает транскрипцию. Клетки, у которых ген fleQ не работает, не могут построить ни жгутик, ни мотор к нему, даже несмотря на то, что гены самих строительных белков для этих структур остаются в целости и сохранности.
В 2014 году при участии Тиффани Тейлор был выведен штамм P. fluorescens, получивший имя SBW25 (A. L. Alsohim et al., 2014. The biosurfactant viscosin produced by Pseudomonas fluorescens SBW25 aids spreading motility and plant growth promotion). Ученые выделили его из дикой природы, а потом модифицировали в лаборатории, внеся поломку (делецию) в ген fleQ. Так они получили бактерий, лишенных жгутиков. Этот штамм все же сохранял способность перемещаться по твердому субстрату посредством расползания. Дополнительная поломка в гене viscB (он кодирует фермент для синтеза вышеупомянутого биосурфактанта) лишила бактерий и этого способа перемещения. Полученный штамм-инвалид, полностью неспособный к активному перемещению, был обозначен AR2.
В 2015 году также при участии Тиффани Тейлор из природного изолята был получен еще один штамм этого же вида бактерий, обозначенный Pf0-1. Этот штамм оказался изначально лишенным способности выделять биосурфактант и «ползать» по поверхности из-за естественной мутации в регуляторном гене gacA. В геном этого штамма тоже внесли делецию в гене fleQ, обозначив новый штамм Pf0-2x. Так же, как и AR2, эти бактерии потеряли способность строить жгутики и распространяться «вплавь» по поверхности агара.
Экспериментируя со штаммами AR2 и Pf0-2x, ученые столкнулись с совершенно неожиданным феноменом: бактерии, лишенные рабочего гена fleQ и высеянные на чашку с агаром, очень скоро полностью восстанавливали жгутики и полноценную способность к быстрым перемещениям по поверхности среды: на это требовалось не более восьми суток (в среднем — около 4-х), причем результат воспроизводился снова и снова во множестве повторных экспериментов. Эти результаты описаны в статье T. B. Taylor et al., 2015. Evolutionary resurrection of flagellar motility via rewiring of the nitrogen regulation system.
В ходе дальнейшей работы исследователям удалось прояснить цепочку событий адаптивной эволюции, посредством которых бактерии «излечиваются» от своей инвалидности. Эта цепочка, состояла всего из двух поочередно приобретаемых мутаций, причем сама последовательность событий, обеспечивающих адаптацию, тоже воспроизводилась в экспериментах снова и снова (рис. 2).

Рис. 2. Эксперимент по индукции адаптивной эволюции и этапы адаптивной эволюции безжгутиковых бактерий в условиях голодания на чашках с агаром. Рисунок из статьи T. B. Taylor et al., 2015. Evolutionary rewiring of bacterial regulatory networks
На первом этапе адаптивной эволюции фиксировалось появление мутации в одном из трех генов (glnA, glnK или ntrB), после которой у бактерий появлялась ограниченная способность к перемещениям на плотной среде. На втором этапе добавлялась мутация в гене ntrC, и бактерии восстанавливали способность к быстрому эффективному перемещению, сопоставимую с исходными природными штаммами. Это плавание обеспечивалось благодаря реверсии полноценных рабочих жгутиков.
Здесь нужно сказать немного о функциях белков, кодируемых каждым из вышеупомянутых генов.
Белок NtrC (так же, как и FleQ) относится к группе активаторов транскрипции. Однако он узнает иные последовательности в ДНК и управляет другими наборами генов. В его подчинении находятся гены, участвующие в поглощении и метаболизме азота. Азот нужен живым клеткам для синтеза аминокислот, но вместе с тем избыток соединений азота во внутренней среде токсичен, так что все эти процессы должны быть хорошо сбалансированы.
Белок NtrB — фермент, который осуществляет фосфорилирование белка NtrC, необходимое для его активации (то есть именно в фосфорилированном состоянии он начинает работать как усилитель транскрипции генов). Активность NtrB в свою очередь зависит от других белков, чувствительных к внутриклеточной концентрации азота и его соединений, в том числе некоторых аминокислот (таких, как, к примеру, глутамин).
GlnA — это фермент синтеза глутамина, от его активности зависит количество образуемого в клетке глутамина. GlnK — это регуляторный белок, чувствительный к концентрации азота и регулирующий большую сеть белков регуляции азотистого обмена, в том числе, белки GlnA и NtrB. Повышение активности GlnK ведет к снижению активности NtrB, и наоборот.
Итак, выходит, что восстановление способности к передвижению у безжгутиковых штаммов P. fluorescens так или иначе обеспечивается кооптацией генов системы регуляции азотистого обмена. В конечном итоге синтез и работа жгутиков оказываются восстановленными за счет того, что гены, в норме активируемые белком FleQ, переходят под управление мутирующего в ходе адаптивной эволюции белка NtrC.
Любопытно, что среди множества белков этой бактерии NtrC не самый близкий по структуре белок-активатор к FleQ (идентичность аминокислотного состава этих двух белков около 30%, имеется четыре белка с более высоким уровнем сходства). Тем не менее, у всех исследованных мутантов (полученных в параллельных экспериментах) именно он брал на себя функцию заместителя во включении генов, ответственных за работу жгутика. Как предполагают авторы исследования, это может быть непосредственно связано с воздействием среды в условиях эксперимента. Не имея возможности перемещаться, клетки голодают, возникает недостаток азота, что стимулирует фосфорилирование и активацию белка NtrC. То есть именно этот белок физиологически оказывается в нужном состоянии, чтобы взять на себя роль заместителя недостающего активатора FleQ.
Мутации первого этапа эволюции прямо или опосредованно усиливают активность белка NtrB. Как следствие, благодаря повышению частоты фосфорилирования, усиливается и активность NtrC. Эта избыточная активность одновременно усиливает как синтез белков, отвечающих за поглощение азота, так и, хоть и слабо, но активирует работу генов, ответственных за синтез и работу жгутиков. Мутация в самом NtrC, возникающая на втором этапе адаптивной эволюции бактерий, меняет его специфичность: повышается его сродство к регуляторным последовательностям генов жгутикового аппарата, и вместе с тем, несколько снижается сродство к регуляторным последовательностям азотистого обмена. В итоге оба эффекта оказываются для бактерий положительными: возвращается способность быстро плавать, а клетки перестают чересчур активно поглощать из среды азот (чрезмерное поглощение азота возникает как побочное следствие мутаций первого этапа адаптивной эволюции).
В исследовании, результаты которого были опубликованы в журнале Nature Communications в октябре 2021 года, авторы, в сущности, еще раз воспроизвели эксперименты 2015 года все с теми же двумя штаммами AR2 и Pf0-2x, но теперь сосредоточились на том, насколько сходны пути адаптации, реализуемые в ходе эволюции у каждого из штаммов.
Первый этап адаптивной эволюции у двух штаммов проходил действительно по-разному. У штамма AR2 мутации фиксировались в гене ntrB, причем в 95% (в 23 независимо сформированных клонах из 24) это происходило в одной и той же нуклеотидной позиции: аденин под номером 289 (считая от первого нуклеотида в рамке считывания) заменялся на цитозин (такая замена обозначается A289C). Эта мутация приводит к замене в белке NtrB аминокислоты треонина в позиции 97 на пролин (T97P). В одном случае из 24 в гене ntrB образовалась не замена, а делеция участка длиной в 12 нуклеотидов (в позициях 406–417).
В противоположность AR2, у бактерий штамма Pf0-2x в тех же самых условиях возникали очень разные мутации. Это набор различных замен, инсерций или делеций как в самом гене ntrB, так и в генах glnK или glnA. Причем среди всех изученных мутантов Pf0-2x не оказалось ни одного (!) с мутацией A289C.
Эффекты всех выявленных у обоих штаммов мутаций оказались достаточно схожими по тому, какое влияние (в количественных показателях) они оказывали на подвижность бактерий и на азотистый обмен.
Можно выдвинуть два варианта объяснения такого высокого параллелизма в возникновении одной и той же мутации у штамма AR2: либо эта мутация оказывается по некоторым причинам особенно полезной именно для бактерий этого штамма (но не штамма Pf0-2x), либо в силу некоторых причин это наиболее часто возникающий вариант мутации у этого штамма (но, опять же, не у Pf0-2x). Так или иначе, причина лежит в каких-то особенностях устройства геномов двух штаммов.
Авторы придумали эксперимент, который бы позволил либо подтвердить, либо опровергнуть вторую гипотезу. Они предположили, что частому возникновению мутации A289C может содействовать структура цепочки ДНК в окрестностях 289 нуклеотида. В его непосредственной окрестности (не далее 14 нуклеотидов в обе стороны) имеется шесть нуклеотидов, различающихся между штаммами AR2 и Pf0-2 (C276G, C279T, C285G, C291G, T294G и G300C; здесь до номера позиции указан нуклеотид из последовательности AR2, а после номера — из Pf0-2x). Все они синонимичны, то есть кодируют одни и те же аминокислоты в белке. И вместе с тем, моделирование потенциальных вторичных структур, которые могут формироваться в участке ДНК с двумя разными вариантами последовательности, дает неодинаковый результат. Если дело действительно в этом, то можно проверить, как поменяется спектр мутаций, если устроить подмену последовательностей в геноме каждого штамма.
Итак, заменив шесть нуклеотидов в геноме штамма AR2 на шесть соответствующих по положению нуклеотидов из генома штамма Pf0-2x, авторы получили новый экспериментальный штамм AR2-sm. Аналогичная процедура по модификации генома Pf0-2x дала штамм Pf0-2x-sm6.
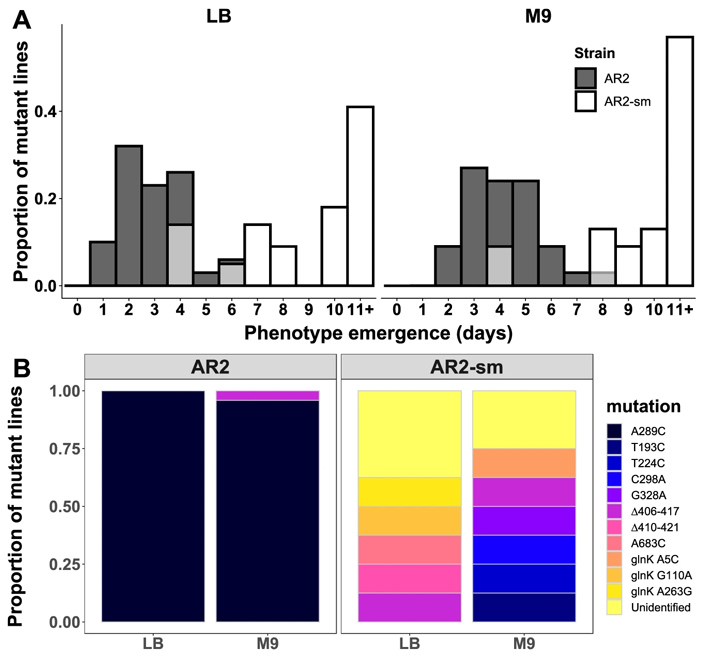
Рис. 3. Адаптация штаммов AR2 и AR2-sm к росту на агаризованной среде (эксперимент проводился с использованием двух вариантов питательной среды: богатой питательными веществами LB, и «диетической» M9). А — скорость адаптации, то есть число дней до появления подвижных клонов. По горизонтальной оси — количество дней до появления мутантных клонов с подвижным фенотипом. По вертикальной оси — их доля среди всех проанализированных клонов. Видно, что два штамма (strain) адаптируются с разной скоростью. B — спектры мутаций, обнаруженных у клонов с восстановленной подвижностью для штаммов AR2 и AR2-sm. Рисунок из обсуждаемой статьи в Nature Communications
Эти штаммы поместили в те же селективные условия, что и родительские штаммы. Посмотрев на рисунки 3 и 4, вы легко заметите, что ситуация резко поменялась на прямо противоположную. Теперь уже штамм, производный от Pf0-2x, давал преимущественно мутантов A289C по гену ntrB (она была у восьми клонов из десяти проанализированных), а у штамма AR2-sm такая мутация не появилась ни разу (на в одном из восьми проанализированных клонов), адаптация же формировалась за счет самых разных мутаций в трех разных генах.
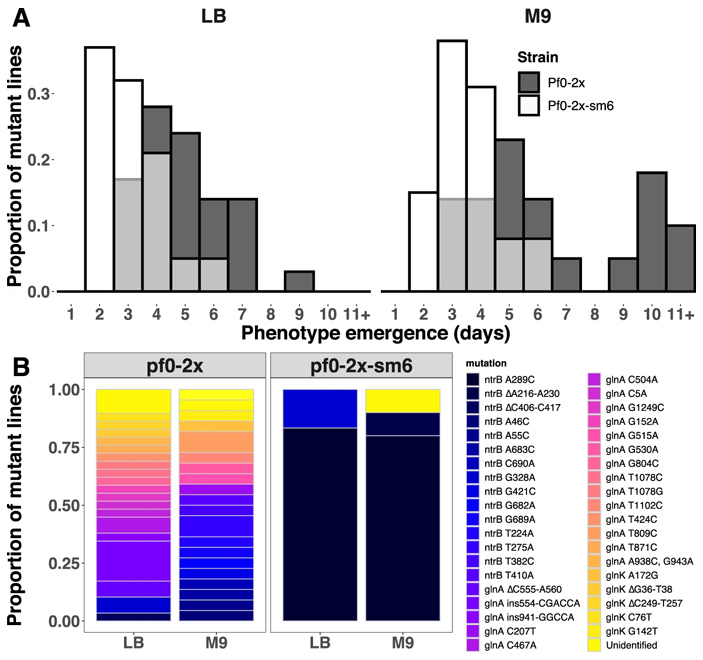
Рис. 4. Адаптация штаммов Pf0-2x и Pf0-2x-sm6 к росту на агаризованной среде. А — скорость адаптации (число дней до появления подвижных клонов). B — спектры мутаций, обнаруженных у клонов с восстановленной подвижностью для штаммов Pf0-2x и Pf0-2x-sm6. Рисунок из обсуждаемой статьи в Nature Communications
Была замечена, к тому же, разница в скорости приобретения адаптивных изменений: штамм AR2-sm немного медленнее восстанавливал подвижность, чем родительский штамм AR2. И наоборот, штамм Pf0-2x-sm6 восстанавливал подвижность немного быстрее по сравнению с родительским штаммом Pf0-2x. То есть структурные особенности небольшого фрагмента ДНК, позволяющие с высокой вероятностью произвести полезную мутацию A289C в гене ntrB, дают любому из двух штаммов преимущество в способности быстро ответить на давление среды адаптивными изменениями. Кстати, аналогичное влияние структуры ДНК на частоту параллелизмов в адаптивной эволюции было также продемонстрировано ранее у колюшек (Ломкие сайты хромосом предопределяют параллельную эволюцию у трехиглой колюшки, «Элементы», 23.01.2019).
В английском языке для описания способности организма быстрее или медленнее формировать новые адаптации используют специальный термин evolvability. В русском языке для этого понятия, к сожалению, пока нет удобного эквивалента. Изучение факторов, благодаря которым у разных видов живых существ разная evolvability, — одно из горячих направлений в современной эволюционной биологии, в котором пока много открытых очень интересных вопросов. В частности, было бы здорово понять, могут ли эволюция и необходимость адаптации к часто меняющимся факторам среды содействовать формированию таких структурных особенностей молекул ДНК, которые повышают эту самую способность быстро производить новые адаптации (evolution of evolvability).
Источник: James S. Horton, Louise M. Flanagan, Robert W. Jackson, Nicholas K. Priest & Tiffany B. Taylor. A mutational hotspot that determines highly repeatable evolution can be built and broken by silent genetic changes // Nature Communications. 2021. DOI: 10.1038/s41467-021-26286-9.
Татьяна Романовская
Источник: elementy.ru