Пневмококки-комменсалы воздействуют на ядра клеток человека
МЕНЮ
Главная страница
Поиск
Регистрация на сайте
Помощь проекту
Архив новостей
ТЕМЫ
Новости ИИ
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Искусственный интеллект
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Психология ИИ
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Творчество ИИ
Техническое зрение
Чат-боты
Авторизация
2021-01-16 05:02

Пневмококки-комменсалы превращают течение опасных инфекционных заболеваний в мирную колонизацию микробиома, управляя ядерной деметилазой KDM6B (фермент, участвующий в воспалительном ответе и альтернативном сплайсинге) клеток хозяина, помечают участки нуклеотидных последовательностей для транскрипционного фактора NF-?B (транскрипционный фактор, контролирующий экспрессию генов, участвующих в иммунном ответе, клеточном цикле, апоптозе) промотора цитокина ИЛ-11, повышая регенерацию эпителия.
С помощью факторов вирулентности, действующих во внеклеточном пространстве и в цитоплазме, бактериальные патогены управляют реактивностью макроорганизма и способствуют заражению инфекционными возбудителями. На что сегодня мало обращают внимание, так это на модуляцию внутриядерных процессов бактериями для контроля иммунологического ответа макроорганизма. В этой статье «Nature Microbiology» Connor с соавт. описывают, что бактерии изменяют эпигенетический ландшафт хозяина, превращая смертельную инфекцию в бессимптомный комменсализм [1].
Бактерии секретируют «нуклеомодулины», которые влияют на транскрипционную активность нуклеосом, воздействуя на эпигенетические модификаторы ядерных белков и ДНК [2]. Некоторые бактерии либо активируют, либо угнетают транскрипцию, изменяя доступность промоторов генов макроорганизма путем ацетилирования или метилирования гистонов, соответственно [3].
Если гены, вовлеченные во врожденный иммунный ответ организма, нацелены на эпигенетическую модификацию, можно предполагать, что течение инфекции будет изменено в пользу патогена, способствуя гипер- или гиповоспалению. Например, сигнализация посредством NF-?B является ключевым путем в процессе воспаления, а для формирования полноценного ответа NF-?B на инфекцию необходима хроматиновая перестройка. Таким образом, «атака на клеточное ядро», изменяющая ремоделирование хроматина, может оказаться очень эффективным способом превратить инфекцию в комменсализм. До сегодняшнего дня было сложно доказать эту гипотезу.
В ходе ранних работ над Helicobacter, Escherichia coli, Campylobacter и Mycobacterium leprae были получены первоначальные доказательства того, что во время бактериальных инфекций возникают эпигенетические изменения в клетках макроорганизма, такие как деацетилирование гистонов [4]. Позже в ходе полногеномного секвенирования обнаружилось, что многие бактерии кодируют белки с SET-доменами [белковые домены, обычно с метилтрансферазной активностью, аббревиатура представляет собой акроним от названий мух-дрозофил, бывших объектами исследований, — прим. перев.], характерными для эукариотических метилаз, которые могут вызывать посттранскрипционные модификации гистонов [5]. Сейчас известно, что бактерии могут эпигенетически модифицировать ДНК и гистоны макроорганизма с помощью нескольких посттрансляционных модификаций, таких как убиквитинирование, сумоилирование (SUMOylation, от англ. s(mall) u(biquitin-related) mo(difier) — разновидность посттрансляционной модификации белка), фосфорилирование, ацетилирование и метилирование [6]. Однако обнаружение эпигенетически-модифицирующих ферментов у бактерий не доказывает, что эти модификаторы функционируют во время болезни. Важным ранним признаком существования такой связи стало наблюдение потери Bacillus anthracis белка BaSET, вследствие чего смертельно опасная сибирская язва превращалась в нелетальную инфекцию [5]. В представленных Connor с соавт. данных показано, что модификация эпигенетического статуса макроорганизма в пользу бактерий лежит в основе запрограммированной модели течения болезни. Удивительно то, что в ходе исследования удалось показать, что эпигенетическая модификация изменяет баланс в организме не в сторону развития патологии, а в сторону колонизации.
Streptococcus pneumoniae, патогенная бактерия для человека, либо колонизирует носоглотку (что выражается в бессимптомном носительстве), либо поражает легкие, кровеносную систему и мозг, становясь причиной значительной смертности. Плохо изучено, что определяет развитие различных штамм-специфичных патологий. Действительно, в большей части опубликованных исследований внимание сосредоточено на развитии патогенеза вследствие инфицирования бактериями, а не на аспекте колонизации. Connor с соавт. изучили транскрипционный ответ макроорганизма в эпителиальных клетках дыхательных путей во время неинвазивного контакта с пневмококками и обнаружили повышенную экспрессию NF-?B, зависящую от эпигенетического модификатора KDM6B макроорганизма. KDM6B представляет собой стиратель посттрансляционных модификаций у эукариот, который деметилирует лизин (в 27-й позиции) гистона H3. Используя метод секвенирования иммунопреципитации хроматина, авторы показали, что KDM6B специфически ремоделирует промотор интерлейкина (ИЛ)-11 для обеспечения уникального паттерна связывания p65, что приводит к увеличению продукции этого цитокина (см. рис. 1).
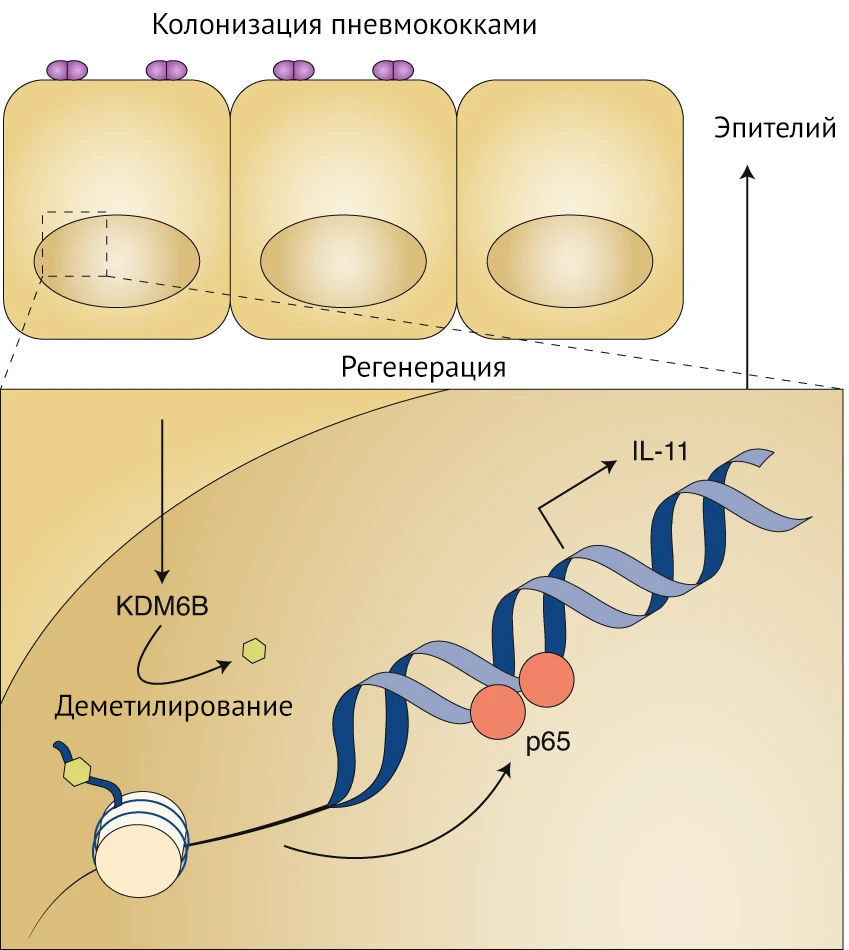
Рисунок 1 | Пневмококки-комменсалы изменяют эпигенетику макроорганизма для увеличения выработки ИЛ-11 и сохранения целостности эпителия
В противоположность инвазивным штаммам, пневмококки, бессимптомно колонизирующие носоглотку, активно вызывают эпителиальную регенерацию. Деметилаза KDM6B гистона Н3 удаляет метильную модификацию с лизина-27 в промоторе ИЛ-11. Это, в свою очередь, увеличивает связывание p65 для индукции ИЛ-11 и поддерживает целостность и восстановление эпителия.
В ходе исследования Connor с соавт. также выявили, что представители нормального микробиома носоглотки, такие как стрептококки группы D, Eikenella и Fusobacterium, используют один и тот же человеческий генетический стиратель, чтобы сформировать эпигенетический ландшафт мирного сосуществования, связанного с присутствием ИЛ-11. Обобщая, можно полагать, что бактерии, в течение длительного времени колонизирующие слизистую оболочку, активно и, возможно, оказывая стимулирующее воздействие, вызывают клеточную регенерацию и репарацию у макроорганизма. Эти процессы снижают степень повреждения слизистой оболочки путем уникальной посттрансляционной модификации для модулирования неканонической подгруппы мишеней активации NF-?B.
Как и во всех неожиданных поворотах науки, вопросы, возникающие в результате этих экспериментов, крайне любопытны. Какой бактериальный фактор взаимодействует с KDM6B? Полезны ли эти факторы также для метаболизма бактерий, как следует из их влияния на скорость роста [1]? Почему деметилирование гистона H3 с помощью KDM6B влияет только на часть общих генов-мишеней NF-?B? Требуется ли для поддержания мирной колонизации тонизирующая активность при восстановлении с помощью ИЛ-11? На перспективу использования новых методик терапевтического вмешательства указывает успех применения семейства ингибиторов гистондеацетилаз в лечении рака и других хронических заболеваний [7]. Может ли быть так, что активация другой модификации (например, деметилирование гистонов) представит новую возможность ослабить воздействие инфекции там, где ингибиторы гистондеацетилазы оказались бессильны [8]? Прямое деметилирование ДНК является основой рестрикционной модификации в битве между бактериями, и оно может оказаться еще одним уровнем атаки бактерий на ядро клеток макроорганизма.
Ясно, что бактерии научились проникать сквозь ядерную мембрану клеток человека; остается надеяться, что исход этого взаимодействия будет благоприятным для нас.
Источник: medach.pro