Как кишечные микробы взаимодействуют с кишечной (энтеральной) нервной системой (ЭНС)
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2020-11-22 19:28
Главная 3. Пробиотики Ось кишечник – мозг Кишечная нервная система и микробиом
Как кишечные микробы взаимодействуют с кишечной (энтеральной) нервной системой (ЭНС)
Кишечная (энтеральная) нервная система и кишечный микробиом
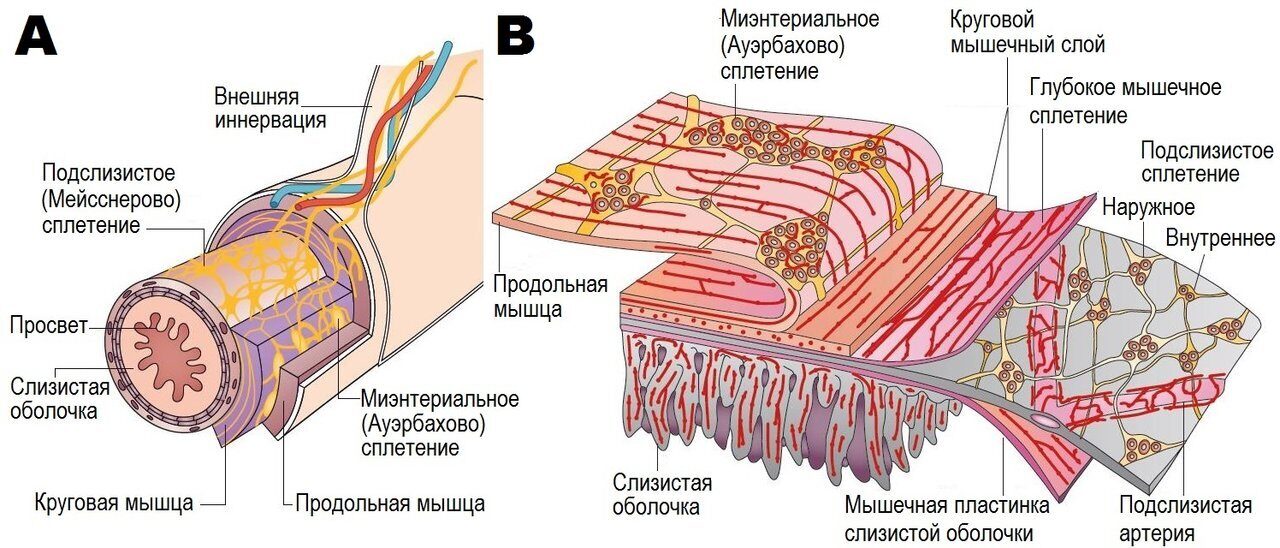
(A + B) Организация кишечной (энтеральной) нервной системы (ЭНС или англ. ENS). ЭНС имеет ганглиозные сплетения, мышечно-кишечное сплетение между продольным и круговым слоями внешней мускулатуры и подслизистое сплетение, которое имеет наружный и внутренний компоненты. Пучки нервных волокон соединяют ганглии, а также образуют сплетения, которые иннервируют продольную мышцу, круговую мышцу, мышечную слизистую оболочку, внутренние артерии и слизистую оболочку. По материалам: (A) Furness,The Enteric Nervous System (Blackwell, Oxford, 2006); (B) Rao and Gershon, The bowel and beyond: the enteric nervous system in neurological disorders (Nat. Rev. Gastroenterol. Hepatol., 2016).
Как кишечные микробы взаимодействуют с энтеральной (кишечной) нервной системой
Mauro Giuffr?, Lory Saveria Croc? et al.
You Talking to Me? Says the Enteric Nervous System (ENS) to the Microbe. How Intestinal Microbes Interact with the ENS
J. Clin. Med. 2020, 9(11), 3705
Примечание редактора. Разные авторы по-разнома трактуют термин "энтеральная нервная система" (ЭНС), и нередко это название заменяется "кишечной нервной системой". Однако это упрощенный вариант, т.к. речь идет не только о кишечнике (тонком и толстом), но также и о пищеводе с желудком (*нередко включают туда и полые органы мочевыделительной системы). Дадим краткое определение ЭНС:
Энтеральная нервная система (упрощенно, кишечная нервная система) - часть вегетативной нервной системы, регулирующая работу гладких мышц внутренних органов, обладающих сократительной активностью. Нервные сплетения: 2 слоя - подслизистое и мышечно-кишечное (или Мейсснерово и Ауэрбахово, соответственно), составляющие энтеральную нервную систему, располагаются в оболочках полых органов желудочно-кишечного тракта*. Энтеральная нервная система является уникальной системой, хотя считается, что она подобна симпатической и парасимпатической частям нервной системы. В отличие от симпатической и парасимпатической частей, которые непосредственно регулируются ЦНС, ЭНС функционирует независимо от ЦНС. Энтеральная нервная система является частью периферической нервной системы и выполняет управляющую функцию в отношении ритмической моторной активности тонкой и толстой кишки. Важную роль в ритмической моторной активности этих органов играют двигательные нейроны и клетки - водители ритма. За сплетениями ЭНС признаётся управление не только моторикой, но и секреторной деятельностью полых органов ЖКТ, а также сосудорасширяющее действие.
Резюме:
Организмы млекопитающих образуют тесные связи с комменсальными и патогенными кишечными микроорганизмами. Все больше данных свидетельствует о тесном взаимодействии между кишечными микроорганизмами и кишечной нервной системой (ЭНС или англ. ENS) в качестве первого интерфейса для центральной нервной системы. Каждый микроорганизм может оказывать различное влияние на ЭНС, включая фенотипические изменения нейронов или индукцию химических передатчиков, которые взаимодействуют с нейронами ЭНС. Некоторые патогенные бактерии используют ЭНС для создания более подходящей среды для своего роста или для усиления воздействия своих токсинов. Кроме того, некоторые комменсальные бактерии могут влиять на центральную нервную систему (ЦНС), локально взаимодействуя с ЭНС. Из текущих знаний возникает интересная область, которая может сформировать будущие концепции синергического взаимодействия патоген-хозяин. Цель этого повествовательного обзора - сообщить о текущих результатах, касающихся взаимосвязей между бактериями, вирусами и паразитами и ЭНС.
1. Кишечная (энтеральная) нервная система (ЭНС) и ось кишечник – мозг
Желудочно-кишечный тракт выполняет функцию переваривания пищи, поглощения питательных веществ и формирования барьера против вредных агентов, но это также иммунно-гормональная система. Функциональные аспекты этой системы, такие как перистальтические движения, транспорт веществ и местный кровоток, регулируются внутренней сетью нервных ганглиев, известной как кишечная нервная система (ЭНС) [1]. ЭНС обеспечивает двигательные возбуждающие нейроны, иннервирует слои мышц, секреторные железы и лимфатическую сосудистую систему. Это самая большая и сложная часть периферической нервной системы, организованная в отдельные нейронные сети в стенке кишечника, где отдельные маленькие ганглии соединены между собой плотными пучками волокон. Эти нервные сплетения организованы в два слоя нейрональных ганглиев и энтероглиальных клеток, которые связаны между собой: миэнтериальное или мышечно-кишечное сплетение (Ауэрбахово сплетение) и подслизистое сплетение (Мейсснерово сплетение). ЭНС формирует полный сенсомоторный рефлекс, состоящий из внутренних первичных афферентных нейронов (IPAN), интернейронов и мотонейронов [2].
Эти сплетения расположены между слоями желудочно-кишечного тракта и представляют около 20 подтипов нейронов, дифференцированных по экспрессии нейропептидов [1]. ЭНС также включает энтероглиальные клетки (EGCs). Они относительно небольшие, имеют форму звезды и могут быть идентифицированы иммунохимически по экспрессии специфических белков, таких как глиальный фибриллярный кислый белок (GFAP), виментин и S-100 [3]. Эти клетки могут экспрессировать рецепторы цитокинов, нейропептидов и нейротрофинов, выполняя функции как в ЭНС, так и в иммунной системе и участвуя в модуляции функций моторики и секреции желудочно-кишечного тракта. Кроме того, EGCs необходимы для структурной и функциональной целостности ЭНС, участвуют в барьере слизистой оболочки кишечника и вносят вклад в гомеостаз кишечника [4].


В желудочно-кишечном тракте большое количество нейромедиаторов, нейрорегуляторов и гормонов играют разные роли. Ацетилхолин (ACh) действует через мускариновые рецепторы, напрямую стимулируя сократимость гладких мышц кишечника [16]. Вещество P (SP), нейрокинин A и нейрокинин B являются нейромодуляторами тахикинина, а действие SP на нейротрансмиссию происходит в ненорадренергической / нехолинергической системе (NANC), которая непосредственно участвует в восприятии болезненных стимулов. Вазоактивный кишечный пептид (VIP) вызывает расширение сосудов и модулирует секрецию муцина и пролиферацию бокаловидных клеток в слизистой оболочке кишечника [17]. Кроме того, он участвует в расслаблении гладкой мускулатуры кишечника и модулирует функции лимфоцитарного компонента иммунной системы. Холецистокинин (CCK) является основным медиатором обратной связи желудочно-кишечного тракта с центральной нервной системой через афферентный компонент БН. Гистамин и серотонин (5-гидрокситриптамин или просто 5-HT) модулируют функцию множества кишечных клеток, включая нейроны, EGCs, мышечные клетки и иммунную систему. Соматостатин (SST), который лежит в основе регуляции роста кишечных клеток, ингибирует секрецию гастрина, инсулина, глюкагона и цитокинов [18,19].
Цель этого повествовательного обзора - сообщить о текущих результатах относительно взаимосвязей между бактериями, вирусами и паразитами и ЭНС.
1.1. Схема кишечной нервной системы
Нейроны ЭНС общаются друг с другом, используя тот же «язык», что и в центральной нервной системе. С функциональной точки зрения рефлексы в ЭНС можно разделить на две основные категории: (1) аксонные рефлексы, где тонкое афферентное нервное волокно связано с центральной нервной системой (часто активируемое вредными раздражителями слизистой оболочки), причем афферентные волокна контактируют с эффекторной клеткой (например, эпителием, кровеносными сосудами или другим нейроном), и (2) интрамуральные рефлексы, т. е. рефлексы, ограниченные нейронами, содержащимися в стенке желудочно-кишечного тракта [20]. В последнем случае вредный внутрипросветный стимул (например, бактериальные токсины) может активировать эндокринные клетки слизистой оболочки для выработки пептидов, которые достигают нервных окончаний подслизистого сплетения, в свою очередь стимулируя миэнтериальное (мышечно-кишечное) сплетение, которое оказывает свое действие на постганглионарные волокна и конечные эффекторы (например, эпителиальные клетки, сосуды и мышцы) [21].
2. Комменсальные бактерии и кишечная нервная система
Желудочно-кишечная система человека населена большой группой из 1000 различных видов бактерий, находящихся в симбиотических отношениях [22]. Эта разнообразная коллекция микробов называется «микробиотой», тогда как их генетический материал называется «микробиомом» [22]. Комменсальная микробиота колонизирует кишечник млекопитающих и другие поверхности тела вскоре после рождения и остается там на протяжении всей жизни человека. У здоровых взрослых людей микробиота в основном состоит из пяти типов бактерий: Firmicutes (79.4%); Bacteroidetes (16.9%); Actinobacteria (2.5%); Proteobacteria (1%); и Verrucomicrobia (0.1%) [23]. Хотя бактерии - наиболее представленные биологические объекты, грибы, археи и вирусы создают «редкую биосферу» микробиома кишечника. Здоровое и сбалансированное состояние, характеризующееся большим разнообразием и обилием микробных популяций в кишечнике, определяется как эубиоз [22]. Широкий спектр факторов, включая диеты с высоко обработанной пищей, недостаток регулярного сна и ряд заболеваний, может изменить разнообразие и обилие микробиоты (дисбактериоз) [22]. Дисбиотическое состояние было связано с рядом патологических состояний, таких как сердечно-сосудистые заболевания, ожирение, диабет, воспалительные заболевания кишечника и легочная гипертензия [22,24].
Долгое время считалось, что единственный контроль, осуществляемый микробиотой кишечника, происходит через БН и ЭНС [25,26]. Неожиданно было продемонстрировано, что, хотя БН и ЭНС являются фундаментальными для оси кишечник – мозг, микробиота играет критическую роль в иммунном, эндокринном и нейроэндокринном созревании при прорастании нервной системы [25]. Интересно отметить, что все акторы (БН, ЭНС и микробиота) являются со-первичными в их вкладе в афференты мозга. Например, способность бактерии Lactobacillus rhamnosus JB-1 модулировать тревожное поведение и нейротрансмиссию, опосредованную гамма-аминомасляной кислотой (ГАМК) у мышей, теряется после ваготомии, а анксиолитический эффект, производимый Bifidobacterium longum NCC3001, который отсутствует у мышей после ваготомии, предполагает фундаментальную роль БН и ЭНС в модуляции бактерий [27,28]. С другой стороны, легкая желудочно-кишечная инфекция после ваготомии вызывает беспокойство с предполагаемым прямым воздействием на мозг [29].
Микробиота кишечника синтезирует различные метаболиты, то есть сложные эфиры, серотонин, триптофан и различные жирные кислоты, которые могут влиять на мозг. Было продемонстрировано, что непрямой эффект, оказываемый микробиотой кишечника, влияет на серотонинергическую передачу, регулируя триптофан, концентрация которого выше у самцов стерильных (безмикробных) мышей по сравнению с контрольной группой с кишечной микробиотой [30], у которых также наблюдается более высокая концентрация серотонина в гиппокампе [14].
Было хорошо продемонстрировано, что микробиота продуцирует метаболиты короткоцепочечных жирных кислот (SCFAs), то есть бутират, пропионат и ацетат. Они оказывают прямое влияние на восстановление микроглии у мышей, свободных от микробов [31,32]. Более того, SCFAs воздействуют по крайней мере на две системы молекулярной передачи сигналов, которые имеют широко распространенные регуляторные эффекты по всему телу: деацетилирование гистонов (HDAC) и рецепторы, связанные с G-белками (GPCRs) [33]. SCFAs являются естественными ингибиторами HDAC и активаторами специфических рецепторов, связанных с G-белком (GPCRs). Дисбаланс в сторону чрезмерного деацетилирование гистонов был обнаружен при болезни Паркинсона [34]. GPCRs представляют собой трансмембранные белки, которые представляют собой важные ворота, через которые клетки преобразуют внешние сигналы во внутриклеточные сигналы (29). SCFAs активируют два специфических GPCR (GPR41 и GPR43) без каких-либо других известных лигандов [35,36]. GPR41 широко распространен в симпатических ганглиях человека, где его активация пропионовой кислотой увеличивает отток симпатической нервной системы и является одним из потенциальных механизмов, с помощью которого пищевые волокна (обогащенные SCFA) могут увеличивать базальную скорость метаболизма и помогать контролировать ожирение [36,37]. Также было доказано, что пропионат и бутират, вводимые в нейробласты крыс, увеличивают экспрессию тирозингидроксилазы, которая является ферментом, ограничивающим скорость в норадреналине, и синтез дофамина [14,38]. Основные данные о влиянии бактерий на ЭНС представлены в таблице 1 и графически представлены на рисунке 1.
Таблица 1. Бактерии и кишечная нервная система.
| Область интересов | Основные результаты |
| Микробиота Кишечника | |
| Социальное поведение | Социальные события допускают горизонтальную передачу микробов между особями одного и того же вида (как наблюдается у тараканов или бабуинов). Модели грызунов с диетой с высоким содержанием жиров и снижением количества Lactobacillus spp. рожают потомство с пониженной способностью различать знакомых и неизвестных особей одного и того же вида. Дисбиоз способствует резким изменениям в социальном поведении грызунов, а добавление бифидобактерий и лактобактерий приводит к улучшению в раннем и взрослом возрасте. |
| Цикл сна и расстройства настроения | Микробиота кишечника может изменять циклы сна за счет системной выработки воспалительных цитокинов, которые, как было доказано, влияют на медленный сон и на выработку кортизола и норэпинефрина. Эти явления связаны с проницаемостью кишечника и системной транслокацией кишечных бактерий. |
| Болезнь Альцгеймера (AD) | Некоторые бактерии способствуют нейровоспалительному ответу, типичному для AD. Повышенный уровень фосфорилированного тау-белка у пациентов с метаболитами микробиоты в спинномозговой жидкости. |
| Болезнь Паркинсона (PD) | Высокая микробная плотность в обонятельных луковицах пациентов с PD. Постуральная нестабильность и симптомы походки могут быть связаны с обилием определенных видов. |
| Патогенные бактерии | |
| Бактерии, продуцирующие токсины | Токсин-индуцированной диарее способствует продвижение серотонина (5-HT) из слизистой оболочки, что приводит к активации путей секретомоторного рефлекса через местные рецепторы 5-HT. В случае рвоты рецепторы 5-HT расположены в сенсорных терминалах блуждающего нерва (БН), которые выступают вверх к рвотному центру в стволе мозга. |
| Учитывая большое количество информации по теме взаимодействия между бактериями (являющимися патогенами или комменсальными бактериями), были представлены только основные результаты. | |
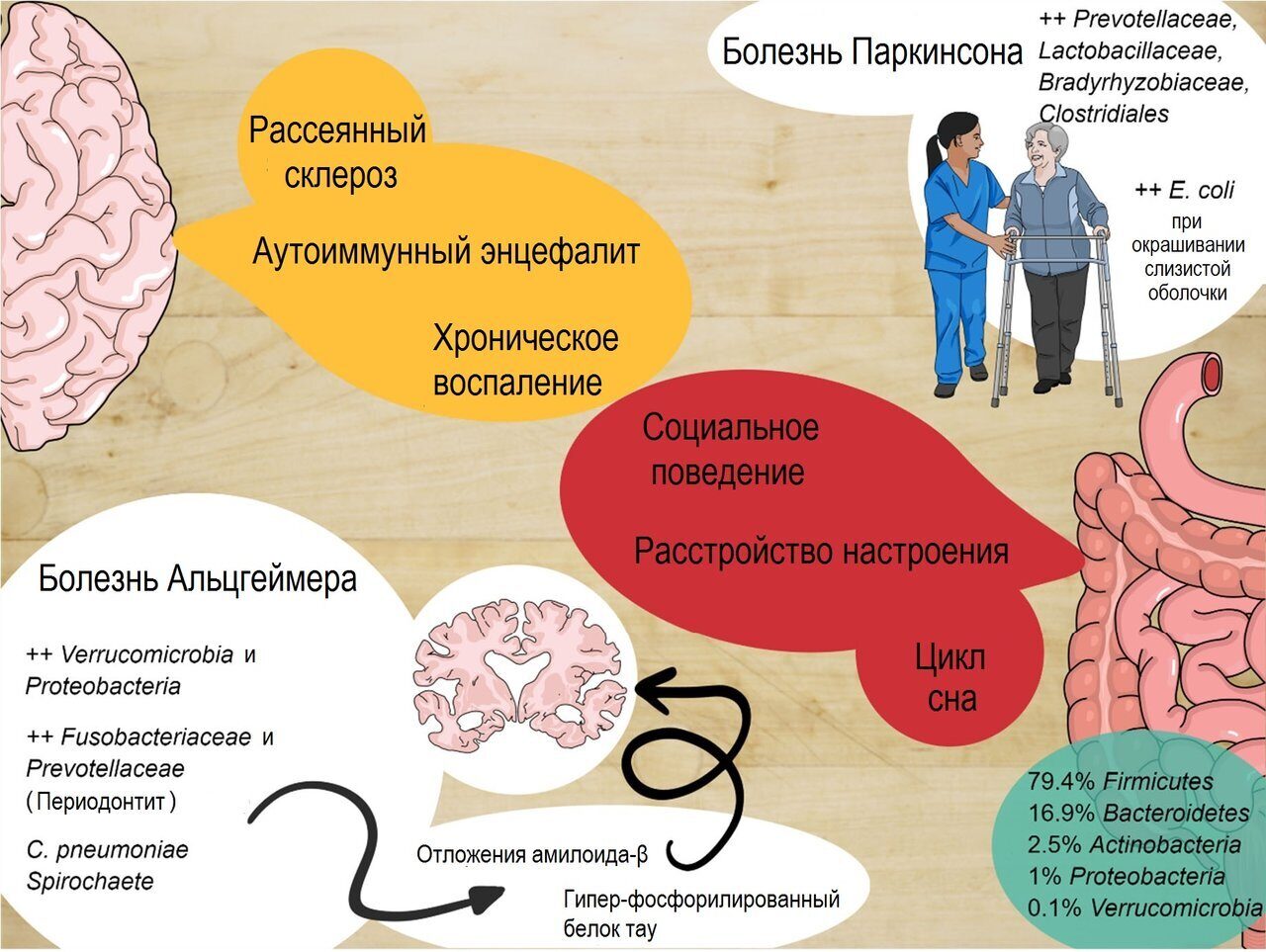
Рис. 1. Кишечная нервная система и центральная нервная система постоянно взаимодействуют друг с другом, и изменения микробиоты могут быть вовлечены в патогенез нескольких заболеваний.
2.1. Микробиота и социальное поведение
В различных исследованиях отмечается фундаментальная роль микробиоты кишечника в социальном поведении. Это, вероятно, связано с горизонтальной передачей микробов между сородичами [14], например, у конкретных тараканов, через социальные события, такие как копрофагия и проктодальный трофалаксис, или у социальных пчел [39]. Присутствие Bifidobacterium и Lactobacillus в кишечнике является основополагающим для производства SCFA, что становится важным для питания в периоды голодания [40,41]. Различное социальное поведение, такое как уход, у бабуинов определяется конвергенцией основных кишечных микробных таксонов [42]. Эти данные кажутся еще более впечатляющими, если учесть, что мыши, рожденные от матерей на диете с высоким содержанием жиров, имеют измененный состав микробиоты со значительным сокращением Lactobacillus spp. и сниженной способностью различать знакомых и неизвестных сородичей [43]. Этот дефект может быть замещен Lactobacillus reuteri с последующим увеличением окситоцина в паравентрикулярном ядре гипоталамуса [44], улучшая их социальное поведение [14].
Изменения микробиоты кишечника, связанные с отсутствием экспрессии Toll-подобных рецепторов (TLRs), способствуют измененному ответу различных патогенов в кишечнике, то есть мыши с нокаутом по TLR4 не проявляют никакого ответа на липополисахарид (ЛПС), который продуцируется грамотрицательными бактериями [45,46]. Модель мышей, получающих гризеофульвин, по сравнению с моделью на мышах, свободных от специфических патогенов, вырабатывала значительно повышенные уровни кортикостерона и адренокортикотропных гормонов при воздействии стрессовых условий. Это производство может быть частично обращено трансплантацией фекальных микробов и, в конечном итоге, полностью отменено с течением времени одним Bifidobacterium infantis [47]. Более того, экспериментальные условия показывают, что в этом случае время ответа моделирования микробиоты очень ограничено по времени, что является основополагающим для преждевременного созревания оси гипоталамус-гипофиз-надпочечники с ответом, специфичным для пола [31, 48]. Совсем недавно многие исследования документально подтвердили, что микробиота мышей в длительном стрессе значительно отличалась от микробиоты мышей, не подвергавшихся стрессу [49]. Одно исследование также показало, что длительный стресс снижает количество Bacteroides в слепой кишке и увеличивает количество Clostridium [49]. Конкретнее, были обнаружены три вида стресс-индуцированных бактерий Enterococcus faecalis, Pseudobutyrivibrio и аэрогенные бактерии штамма Dorea [5,49].
Экспериментальные модели животных, свободных от микробов, и животных, леченных антибиотиками, которые определяют полное отсутствие микробиоты, демонстрируют макроскопические изменения обмена нейромедиаторов, измененную морфологию нейронов и значительное нейровоспаление [49] в зависимости от времени появления микробиоты. Аналогичным образом, замена микробиоты приводит к резкому изменению поведения и социального поведения у экспериментальных животных, таких как грызуны. Напротив, добавление Bifidobacterium и Lactobacillus может привести к заметным улучшениям в социальном поведении в раннем и взрослом возрасте [14]. Как замечательно написано Шервином и др. [14]: «Новые исследования теперь рассматривают животных как «холобионтов»: динамические экосистемы, включающие хозяина и связанные с ним микроорганизмы, которые могут меняться со временем, локализацией и функциями. В совокупности геномы хозяина и микробов холобионта называются гологеномами, и вариации в гологеноме, вызванные изменениями в хозяине и / или микробах, могут влиять на фенотипы, которые могут быть предметом естественного отбора».
2.2. Микробиота, цикл сна и расстройства настроения
По данным Sherwin et al. [14] и многих других [44,50–60], кажется весьма важным, чтобы микробиота постоянно стимулировала иммунную систему, но этот эффект ремоделирования имеет последствия, даже если они очень отдаленные [37,59]. Было предложено возможное взаимодействие между микробиотой кишечника и регуляцией сна. Широко описано, что микробиом кишечника продуцирует и активирует макрофаги кишечника, вызывая выработку IL-1? и TNF-? [60]; внутри кишечной стенки многие ЛПС индуцируют синтез IL18 [61–63]. Была описана тесная взаимосвязь между TNF-?, IL-18 и NREM-сном [62,63]. Также общепризнано, что кортизол подавляет синтез этих цитокинов в кишечной микробиоте, а пиковые уровни IL-1? и TNF-? в крови человека достигаются около полуночи, когда кортизол находится на самом низком уровне [64,65]. Парентеральное введение людям ЛПС в количествах в нанограммах (0,4 нг / кг массы тела) увеличивает концентрацию в плазме IL-6 и TNF-?, а также кортизола в слюне и плазме, а также норэпинефрина в плазме. Эти изменения сопровождаются подавленным настроением, повышенной тревожностью и нарушением долговременной памяти на эмоциональные стимулы [66,67]. Мацуда и др. недавно разработали модель депрессии на крысах, используя парадигму 14-дневного стресса социального поражения (SDS) [68]. Эти экспериментальные грызуны демонстрируют длительное социальное избегание, серьезные депрессивные расстройства и нарушения сна с усилением фазы быстрого сна (REM), но уменьшенным временем NREM-сна и повышенной дефрагментацией непрерывности сна. Авторы исследовали фекальную микробиоту кишечника до, во время и после стрессовых исследований. Стресс социального поражения значительно увеличил фекальные классы бетапротеобактерий (Betaproteobacteria) и флавибактерий (Flavibacteria), уменьшив при этом классы клостридий (Clostridia). Бактероиды (Bacteroides) и бациллы (Bacilli) имели тенденцию к увеличению, а актинобактерии (Actinobacteria) - к снижению. По сравнению с периодом до стресса, Lactobacillus показала очевидное снижение, тогда как Blautia продемонстрировала значительное увеличение. Уровни Lactobacillus reuteri значительно повысились после стрессовых условий, причем дальнейшее повышение наблюдалось даже через месяц после окончания стрессовых условий [68]. Напротив, другие виды (Ruminococcus flavefaciens, Blautia producta и Clostridium perfringens) показали только временные изменения [67,68].
Было продемонстрировано, что измененный микробиом кишечника с повышенным уровнем ЛПС и пептидогликана обычно выше у алкоголика, чем у трезвенника; У алкоголиков до и во время детоксикации этанолом наблюдается повышенный уровень мРНК и плазменный уровень IL-8, IL-1? и IL-18. Используя Cr51-EDTA (этилендиаминтетрауксусную кислоту, меченную хромом-51) в качестве зонда кишечной проницаемости, была изучена популяция хронических алкоголиков, которые были разделены на две группы: с высокой и с нормальной проницаемостью (65). Группа с высокой проницаемостью имела более высокие баллы депрессии, беспокойства и тяги к алкоголю, чем группа с низкой проницаемостью, а также отчетливую картину изменений микробной популяции кишечника, характеризующуюся сниженной колонизацией бактерий, обладающих противовоспалительным действием, в частности, видов Bifidobacterium, Faecalibacterium и Faecalibacterium prausnitzii [37,69]. Алкоголики, у которых после трех недель отмены этанола сохранялась повышенная проницаемость кишечника, также демонстрировали стойкость депрессии, тревоги и тяги к алкоголю [69].
2.3. Микробиота и болезнь Альцгеймера
Болезнь Альцгеймера (AD) - хроническое и необратимое нейродегенеративное заболевание, характеризующееся потерей нейронов и прогрессирующими нарушениями синаптической функции, сопровождающимися отложением пептида амилоида-? (A?) вне или вокруг нейронов, вместе с накоплением гипер-фосфорилированного тау-белка внутри кортикальных нейронов [70–74]. Накопление амилоида, включающее отложение гиперфосфорилированных тау-белков, с последующей дестабилизацией микротрубочек, приводит к двум критическим процессам: существенному усилению общего нейровоспаления и значительной микроглиальной и астроцитарной активации и голоданию нейронов из-за прерывания аксонального транспорта. Наиболее важными последствиями являются измененные глутаматергические токи и критические токи притока кальция со значительной индукцией апоптоза [73,75–77]. Животные модели отложений амилоида и тау-белка связаны с инфекцией вируса простого герпеса 1 типа (HSV1) у мышей, которая активирует гены, кодирующие холестерин-25-гидроксилазу (CH25H), которая, по-видимому, участвует в катаболизме или гиперпродукции амилоида [78–80]. Тем не менее, многие другие бактерии, такие как спирохеты и Chlamydia pneumoniae, связаны с основным нейровоспалительным статусом, типичным для DA [78,81,82]. Положительная взаимосвязь с фосфорилированным тау-белком и фосфорилированным тау / A? 42 (амилоид-бета 42 - пептид из 42 аминокислотных остатков – ред.) в спинномозговой жидкости и метаболизме микробиоты была обнаружена с повышением уровня триметиламина N-оксида (ТМАО) в моделях DA [83]. Кроме того, трансгенные мыши дикого типа с белком-предшественником амилоида (APP) и мыши без микробов имеют пониженный уровень отложения амилоида по сравнению с APP-мышами со здоровой микробиотой [84], и это также было доказано при лечении антибиотиками долгосрочного действия, которое, по-видимому, уменьшает отложение амилоида [85]. Было описано, что у мышей AD наблюдается выраженное снижение уровня Verrucomicrobia и Proteobacteria с одновременным снижением содержания Ruminococcus и Butyricicoccus и короткоцепочечных жирных кислот [86,87]. Более того, плохая гигиена полости рта была связана с AD, при этом пародонтопатия и потеря зубов были факторами риска деменции в двух исследованиях [88,89], а также тяжелым периодонтитом, связанным со снижением когнитивных функций [90–97]. Даже если в исследованиях есть много разных предубеждений, было продемонстрировано, что заболевания пародонта могут быть связаны с повышенной амилоидной нагрузкой на мозг с помощью ПЭТ-исследований [93], и что наблюдается увеличение количества Fusobacteriaceae и более высокая численность Prevotellaceae у пациентов с AD [93, 98].
2.4. Микробиота и болезнь Паркинсона
Больше исследований было проведено по второй наиболее частой форме нейродегенеративного заболевания, которой является болезнь Паркинсона (PD). Сходящаяся линия этих исследований разделяет две общие точки: высокая плотность микробной популяции обонятельной луковицы и кишечника и высокая плотность отложения неправильно свернутого альфа-синуклеина на двух участках [12,99–101]. Было продемонстрировано, что отложения альфа-синуклеина имеют рострокаудальный градиент [102] с более высокой концентрацией в подчелюстной железе и более низкой концентрацией в пищеводе [102,103]. Было высказано предположение, что основными эффектами блуждающего нерва могут быть пути прорастания от периферических участков к стволу мозга [100], а ваготомия снизила скорректированный риск развития PD в популяции наблюдения через 20 лет [104,105]. Было продемонстрировано, что у пациентов с PD наблюдается более высокая проницаемость кишечника [106] (с более высоким присутствием Enterobacterales (E. coli)) при окрашивании слизистой оболочки, что связано с более высоким плазматическим белком, связывающим ЛПС у пациентов с PD [106,107]. У мышей дикого типа с избыточной экспрессией альфа-синуклеина условия, свободные от микробов, вызывают меньше двигательных симптомов и минимальные признаки общего воспаления мозга и альфа-синуклеина [108]. Те же аспекты наблюдаются у мышей, получавших антибиотики, в то время как колонизация фекалиями мышей дикого типа или здоровых субъектов или с высоким количеством SCFAs определяет ухудшение Паркинсонических двигательных симптомов [106]. В трех поперечных исследованиях сообщалось об относительном обилии Prevotellaceae при PD, но не в контроле [109]. В сочетании с тяжестью запора обилие Prevotellaceae, Lactobacillaceae, Bradyrhyizobiaceae и Clostridiales IV может быть использовано для выявления случаев PD с чувствительностью 66,7% и специфичностью 90,3%. Постуральная нестабильность и симптомы походки были связаны с относительным обилием Enterobacterales [102,109,110]. Также сообщалось, что синтез ЛПС увеличивается у пациентов с PD по сравнению с контролем [110]. Тот же аспект был подтвержден в другом исследовании, которое показало более низкие сывороточные уровни ЛПС-связывающего белка [107], а также снижение абсолютной концентрации фекальных SCFAs (ацетата, пропионата и бутирата) [111].
2.5. Микробиота и другие нейродегенеративные заболевания
Было проведено несколько исследований на животных и человеческих моделях демиелинизирующих заболеваний, таких как экспериментальный аутоиммунный энцефаломиелит (EAE), рассеянный склероз (MS) и оптиконевромиелит (NMO) [112-116].
Безмикробные мыши были очень устойчивы к развитию аутоиммунного энцефалита [113,114] или имели более низкие клинические оценки из-за их энцефалита [114]. Однако это состояние резко изменилось, когда эти стерильные мыши получили трансплантат фекалий от здоровых мышей [116]. Считалось, что условия окружающей среды, которые, по-видимому, влияют на прогрессирование рассеянного склероза, такие как ожирение, курение, низкий уровень витамина D и измененная реакция на человеческие вирусы [23,117–120], по-видимому, влияют на это через микробиоту [121,122]. «Дырявый кишечник» [123] широко присутствует при ремиттирующем рассеянном склерозе, и различные исследования показали различный состав микробиоты кишечника при MS, а не у контрольных субъектов [123–128]. Была замечена любая специфичность для данного состава микробиоты в случаях рассеянного склероза, но провоспалительная среда является постоянной находкой [102,123]. Документально подтверждено совпадение с другими воспалительными хроническими состояниями, такими как болезнь Крона, избыточный бактериальный рост в тонком кишечнике, ревматоидный артрит и недифференцированные патологии соединительной ткани [129–131]. Существует тенденция сообщать о некоторых конкретных группах микробов в MS-микробиоте, например, архей (род Methanobrevibacter) [125] или об истощении видов Firmicutes (роды Clostridium) [123] и типа Bacteroidetes [126–128]. Даже животные модели EAE (приматы) могут показывать низкие уровни липида 654 (функционирует как лиганд Толл-подобного рецептора 2 человека и мыши – ред.), который является липопептидом, предположительно полученным из кишечных Bacteroidetes [132]. Были проведены минимальные исследования для определения уровней рассеянного склероза и прогрессирования заболевания, и с помощью таких исследований можно было получить определенный результат. Тем не менее, в популяции детей с MS истощение фузобактерий (Fusobacteria) было связано с более высоким коэффициентом риска более раннего рецидива [123], и в настоящее время проводятся различные исследования по этой увлекательной теме [133].
Сценарий для NMO отличается, что часто связано с анти-аквапорином 4 и присутствием АТФ-связывающего кассетного транспортера Clostridium в микробиоте кишечника [134, 135], даже если все набранные пациенты с NMO проходят терапию ритуксимабом [135, 136].
3. Патогенные бактерии и кишечная нервная система
Помимо комменсальной микробиоты, патогенные бактерии в просвете также взаимодействуют с ЭНС косвенно, через ненейрональные промежуточные клетки, такие как эндокринные (в частности, энтерохромаффинные клетки (ECs)) или иммунные резидентные клетки кишечника. Некоторые энтеротоксины вызывают секрецию кишечника через нервные рефлексы, происходящие параллельно с токсинами и оказывающие прямое секретирующее действие на клетки кишечника.
Кроме того, локальная кишечная инфекция может привести к тонким изменениям в аффективном состоянии и эмоциональной отзывчивости, как в случае с моделями грызунов Campylobacter jejuni, у которых развилось тревожноподобное поведение в отсутствие системного иммунного ответа. В частности, инфекция Campylobacter jejuni была связана с повышенной экспрессией маркера активации нейронов c-Fos в нейронах, расположенных в сенсорных ганглиях блуждающего нерва и ядре солитарного тракта, а также в областях мозга, связанных с первичными висцеросенсорными путями и Центральной вегетативной сетью [137].
3.1. Токсины, способствующие секреции

Среди бактерий, продуцирующих токсины, Vibrio cholerae производит сильный экзотоксин, который вызывает гиперсекрецию в тонком кишечнике. Токсин холеры (CT) состоит из А (или ферментативной) субъединицы 28 кДа и пяти В (или связывающих) субъединиц по 11 кДа каждая, собранных в пентамерную молекулу. Участие ЭНС в патофизиологии холерной инфекции было первоначально предложено в 1980 г. [138]. Предыдущие данные предполагали, что СТ активировал стойкое цАМФ-зависимое высвобождение 5-HT из слизистой оболочки, что приводило к активации путей секретомоторного рефлекса (через рецептор 5-HT3) в ЭНС за счет активации дендритов нейронов подслизистого сплетения и, в конечном итоге, приводя к высвобождению вазоактивного кишечного пептида (VIP) и его связыванию с рецепторами энтероцитов, тем самым активируя дальнейшее производство цАМФ, способствуя секреции воды и электролитов [20, 139]. Однако недавние данные свидетельствуют о том, что СТ увеличивает возбудимость нейронов миэнтериального, но не подслизистого, сплетения, и что рецепторы нейрокинина 3, а не рецепторы 5-HT3, участвуют в нейросекреторном рефлексе [140]. Термолабильный энтеротоксин (HLT), продуцируемый E. coli, имеет структурную гомологию 88% с CT и вызывает гораздо менее тяжелую форму диареи [141]. Более того, инокуляция HLT не стимулирует высвобождение 5-HT из энтерохромаффинных клеток. Механизм HLT, по-видимому, неразрывно связан с ЭНС, учитывая, что введение ганглионарной блокады оказывало профилактическое воздействие на развитие диареи [141]. Кроме того, гораздо меньшие по размеру термостабильные энтеротоксины E. coli (STa) 2–5 кДа, по-видимому, активируют NO-зависимый секреторный рефлекс миэнтериального сплетения, опосредованный капсаицин-чувствительными С-волокнами [142, 143], в дополнение к подавлению ответа антагонистами вазоактивного кишечного пептида VIP. В этом случае VIP и NO, по-видимому, обладают синергетическим эффектом, поскольку NO способствует секреции VIP из нервных окончаний. Кроме того, энтеротоксин STa может активировать рецептор нейрокинина 2, который может дополнительно способствовать кишечной секреции [144].
Clostridioides difficile, еще одна токсигенная бактерия, является основной причиной диареи и колита, вызванной антибиотиками. Токсигенные штаммы выделяют два экзотоксина: токсин A (TX-A) и (TX-B). Они ответственны за диарею и острую воспалительную реакцию слизистой оболочки [145]. Введение токсинов C. difficile в просвет кишечника стимулировало приток нейтрофилов и способствовало активации кишечных нейронов для увеличения секреции просвета и перистальтики [146]. Кроме того, ответы на TX-A включают активацию вещества P как в поясничных ганглиях дорсального корня, так и в энтероцитах тонкой кишки [147]. Кроме того, модели in vivo показали, что низкие дозы ТХА вызывают возбуждающее действие на уровне подслизистого сплетения и участвуют в подавлении высвобождения норадреналина симпатическими постганглионарными аксонами [148]. В результате стимуляция секретомоторных нейронов подслизистой оболочки вызывает секрецию крипт слизистой оболочки. Инактивация симпатического торможения на секретомоторных нейронах дополнительно облегчает секрецию. Кроме того, недавние исследования показали, что энтероглиальные клетки (EGCs) восприимчивы к инфекции C. difficile из-за цитотоксического и стимулирующего старение действия TX-B [149,150].
3.2. Токсины, способствующие рвоте
Staphylococcus aureus (Золотистый стафилококк) продуцирует множество энтеротоксинов (SEs), которые обычно вызывают пищевое отравление. Похоже, что рвота вызвана секрецией 5-HT. В частности, это может быть связано с рецепторами 5-HT3, расположенными в сенсорных терминалах блуждающего нерва (БН), которые проецируются вверх к рвотному центру в стволе мозга [151]. Однако этот процесс был доказан только косвенно на животных моделях (мускусной землеройке), учитывая, что рвота предотвращается ингибитором 5-HT и антагонистами рецептора 5-HT3 [151]. Аналогичный механизм был предложен для церулида, который представляет собой циклический додекадепсипептид, продуцируемый Bacillus cereus. Рвотные эффекты токсина, по-видимому, зависят от рецепторов 5-HT3 на афферентных нейронах БН, поскольку ваготомия и антагонисты рецепторов 5-HT3 подавляют рвоту у землеройки [152]. Подобно SEs, неизвестно, взаимодействует ли цереулид непосредственно с сенсорными окончаниями БН или способствует высвобождению 5-НТ с помощью энтерохромаффинных клеток [152].
4. Влияние вирусов на кишечную нервную систему
Некоторые нарушения моторики желудочно-кишечного тракта (GIMDs) могут зависеть от функциональных или анатомических изменений ЭНС [153–155]. Молекулярная основа этих изменений неоднородна, включая дегенеративные и опосредованные воспалением аномалии [156]. В этом контексте инфекционные агенты, такие как нейротропные вирусы, могут быть идентифицированы как этиологические факторы, влияющие на целостность ЭНС либо напрямую, либо через иммуно-опосредованные механизмы [157]. Основные результаты с точки зрения вирусного влияния на ЭНС представлены в таблице 2 и графически представлены на рисунке 2.
Таблица 2. Вирусы и кишечная нервная система
| Вирусный агент(ы) | Патогенетический механизм(ы) | Заболевания |
| Инфекция | Необратимая кишечная непроходимость | |
| Репликация вируса в кишечных нейронах, вызывающая гибель клеток | Нарушение моторики кишечника | |
| Изменения вируса гриппа A в структурах ЭНС, за которыми следует пожизненная персистентность HSV-1 | Болезнь Паркинсона | |
| Герпес-вирусы (EBV, VZV) | Латентность VZV в ганглиях ЭНС; EBV-индукция воспалительных инфильтратов в мышечно-кишечных сплетениях | Синдром Огилви, Идиопатическая хроническая псевдообструкция кишечника (CIIPO), Мышечно-кишечный ганглионит |
| Инфекция энтероглиальных клеток (EGCs) мышечно-кишечного сплетения | CIIPO | |
| Активация белком вирусного трансактивирующего фактора ВИЧ-1 (Tat ВИЧ-1) энтероглиальных клеток (EGCs), вызывающая нейровоспалительный ответ и синергетическое действие с морфином | Диарея и нейротоксические эффекты | |
| Ротавирусная инфекция энтерохромаффинных клеток (ECs) и стимуляция секреции серотонина | Диарея, связанная с ротавирусом | |
| Высвобождение серотонина из энтерохромаффинных клеток (ECs), приводящее к активации энтероглиальных клеток (EGCs) | Диарея | |
| Разрушение энтеральных (кишечных) нейронов путем массивного рекрутирования нейтрофилов | Нарушение перистальтики и токсический мегаколон | |
| Активация энтероглиальных клеток (EGCs) с массовым высвобождением интерлейкина-6 (IL-6) и других медиаторов воспаления (цитокиновый шторм) | Диарея, связанная с SARS-CoV-2a |
В таблице представлены основные вирусные агенты, их патогенетические механизмы и болезнь. TBEV: клещевой энцефалит; WNV: вирус Западного Нила; ZIKV: вирус Зика; HSV-1: вирус простого герпеса-1; EBV: вирус Эпштейна – Барра; VZV: вирус ветряной оспы; JCV: вирус Джона Каннингема; EGCs: энтероглиальные клетки; CIIPO: хроническая кишечная идиопатическая псевдообструкция; ВИЧ: вирус иммунодефицита человека; Клетки EC: энтерохромаффинные клетки; HAdV-41: аденовирус-41.

Рисунок 2. Патогенные бактерии, вирусы и паразиты, поражающие в первую очередь желудочно-кишечную систему, взаимодействуют с кишечной нервной системой, устанавливая связь между кишечником и центральной нервной системой.
Доказательства, подтверждающие наличие вирусов как возможных этиологических факторов, участвующих в GIMDs, по-прежнему основаны на на спорадических случаях или небольших сериях случаев, сообщающих о возникновении вироза (например, полиомиелита, гриппа и опоясывающего герпеса) до начала ахалазии [158] и нейрогенной кишечной псевдобструкции [159, 160]. В основном нейротропные вирусы, ассоциированные с GIMDs, могут проникать в ЭНС через слизистую оболочку желудочно-кишечного тракта и, возможно, устанавливать латентный период с циклической реактивацией [161].
Вирусы могут поражать различные клеточные популяции ЭНС. Энтероглиальные клетки (EGCs) являются основным компонентом ЭНС, на который могут нацеливаться вирусы, и в 4-10 раз превышают число кишечных нейронов [162]. EGCs действуют как механическая опора для кишечных нейронов, отвечают за выживание и дифференцировку нейронов [163] и являются антигенпредставляющими клетками для клеток врожденного и адаптивного иммунитета [164,165]. Затем активация EGCs вирусами или их антигенами является ключевым этапом для периферического нейроглиального иммунного праймирования вирусами, что приводит к позднему началу неврологического нарушения [166]. Воспалительные стимулы активируют EGCs и превращают их в «фенотип реактивных глиальных клеток», который может высвобождать защитные факторы (нейротрофин-3, GDNF, GSNO и PEA / PPAR-?) или деструктивные факторы. Массивное высвобождение деструктивных факторов и нескольких провоспалительных медиаторов, таких как IL-1?, IL-6, TNF-? и MCP-1, изменяет моторику желудочно-кишечного тракта [167–169].
Некоторые случаи нарушений моторики кишечника, по-видимому, связаны с вирусной инфекцией [170–172]. В мышиных моделях инокуляция нейротропными флавивирусами приводит к повреждению и гибели энтеральных нейронов, воспалению, кишечной дилатации и замедленному кишечному транзиту. Точнее, прививка мышей флавивирусами вируса Западного Нила (WNV) и вируса Зика (ZIKV) приводит к репликации вируса по всему кишечному тракту и расширению кишечных сегментов. Вирусная репликация особенно наблюдалась в кишечных нейронах, вызывая гибель клеток, но не в глиальных клетках или эпителиальных клетках слизистой оболочки. Кроме того, у животных, переживших WNV-инфекцию, наблюдаются дефекты моторики желудочно-кишечного тракта от 4 до 7 недель после заражения. В целом эти наблюдения подтверждают гипотезу о том, что некоторые нарушения моторики желудочно-кишечного тракта могут быть эпизодическими после инфекции/воспаления или хроническими, которые могут периодически усугубляться дополнительными инфекциями или воспалением [173].
Отсроченный эффект вирусной инфекции можно предположить в начальном нейропатогенезе болезни Паркинсона в соответствии с гипотезой «виремического удара», основанной на теории двойного удара. В частности, вирус гриппа A может «ударить и убежать», инициируя патологические изменения в структурах ЭНС, тогда как HSV-1 может «поразить» и установить пожизненную персистенцию с повторяющимися реактивациями из латентности, в зависимости от уровня иммуносенсации [174]. Эти виремические удары могут вызывать образование фибрилл ?-синуклеина в периферических нервных тканях, что приводит к постепенному транснейрональному распространению ?-синуклеопатии в головном мозге [175–177].
Дополнительные нейротропные вирусы и вирусы, инфицирующие желудочно-кишечный тракт, следует рассматривать в качестве хороших кандидатов для возникновения нарушений моторики желудочно-кишечного тракта у человека. В связи с этим, некоторые случаи хронической кишечной идиопатической псевдообструкции (CIIPO) [178] были связаны с вирусными инфекциями как у детей [179,180], так и у взрослых пациентов [159,181,182]. Среди возможных инфекционных агентов были выявлены инфекции вируса семейства герпесов, вируса ветряной оспы (VZV), цитомегаловируса (CMV), вируса Эпштейна-Барра (EBV) и вируса JC. В основном считается, что вирусные инфекции могут поражать нервно-мышечный слой кишечника. В частности, VZV может инфицировать и устанавливать латентный период в ганглиях ЭНС [157], и он был связан с острой псевдообструкцией толстой кишки (синдром Огилви), сильной болью в животе, предшествующей фатальной ветряной оспе, вегетативной дисфункцией и симптомами псевдобструкции кишечника после железистой лихорадки, вторичный по отношению к EBV-инфекции [180]. Для сравнения, EBV был связан с миэнтерическим ганглионитом, характеризующимся воспалительными инфильтратами в миэнтериальных сплетениях [180]. Вирус JC был обнаружен в энтероглиальных клетках миэнтериального сплетения у некоторых пациентов с CIIPO [183].
EGCs также были определены как мишени для ВИЧ. Предполагается, что белок вирусного трансактивирующего фактора ВИЧ-1 (Tat ВИЧ-1) ответственен за диарею и нейротоксические эффекты. Один из предполагаемых механизмов заключается в том, что ВИЧ-1 активирует глиальные клетки, вызывая нейровоспалительный ответ, который может распространяться на центральную нервную систему. В частности, ВИЧ мешает функционированию нервной системы, заражая EGCs, которые высвобождают Tat ВИЧ-1, вызывая изменение потенциала действия кишечных нейронов за счет увеличения экспрессии Na+-каналов [166, 184]. Кроме того, Tat может взаимодействовать синергетически с морфином, будучи способным активировать EGCs и ухудшать дисфункцию желудочно-кишечного тракта у ВИЧ-инфицированных потребителей наркотиков и ВИЧ-инфицированных пациентов, использующих опиоидные препараты для лечения диареи [185, 186]. Были показаны другие пути взаимодействия между белком Tat ВИЧ-1 и ЛПС. В моделях мышей, экспрессирующих Tat, бактериальная кишечная транслокация значительно увеличивается. Следовательно, Tat и ЛПС взаимодействуют, вызывая высвобождение провоспалительных цитокинов IL-6, IL-1? и TNF-?. Более конкретно, Tat ВИЧ-1 способен взаимодействовать с рецептором TLR4 для усиления провоспалительных эффектов ЛПС [187].
EGCs могут быть активированы ECs, зараженными вирусами. ECs распределяются по слизистой оболочке кишечника для высвобождения медиаторов с базолатеральной поверхности и для активации окончаний афферентных нейронов, в основном внутри собственной пластинки [188]. Среди своих медиаторов ECs выделяют серотонин [189], который активирует ЭНС и внешние афференты блуждающего нерва к мозгу, а также может активировать EGCs [21]. Было продемонстрировано, что участие серотонина играет ключевую роль в регуляции кишечной секреции, моторики кишечника, некоторых желудочно-кишечных расстройств, тошноты, рвоты и острого гастроэнтерита [190, 191]. Ротавирусы (RV) могут инфицировать EC-клетки и стимулировать секрецию серотонина в зависимости от дозы и времени, что приводит к RV-связанной диарее [192]. Точно так же аденовирус-41 (HAdV-41) может стимулировать серотонин из вируса Коксаки и аденовирусные рецепторы (CAR), экспрессирующие EC-клетки человека, активируя EGCs. Эти наблюдения подчеркивают серотонин-зависимый перекрестный обмен между HAdV-41, EC-клетками и EGCs, что может иметь значение для понимания того, как HAdV-41 вызывает диарею [193].
Была выдвинута гипотеза об активации EGCs при связанной с SARS-CoV-2 диарее. Действительно, активированные EGCs массово высвобождают IL-6 и другие медиаторы воспаления, что приводит к так называемому «цитокиновому Шторму», наблюдаемому у пациентов с COVID-19. Поэтому в этих случаях дисфункцию ЖКТ можно рассматривать как возможный маркер вовлечения ЭНС/EGC, а не как вспомогательный симптом, подчеркивая патофизиологический механизм, лежащий в основе нейроинвазии SARS-CoV-2 [194-197].
Кишечные нейроны могут быть мишенью HSV-1. После заражения нейроны рекрутируют воспалительные макрофаги, которые, высвобождая АФК, вызывают изменения нейропластичности ЭНС и запускают разрушение кишечных ганглиев, вызывая нарушение моторики желудочно-кишечного тракта [198,199]. Инфекция HSV-1 приводит к разрушению кишечных нейронов за счет массивного рекрутирования нейтрофилов, что приводит к необратимой потере перистальтики и развитию токсичного мегаколона [172]. Следовательно, острое или хроническое воздействие нейронов кишечника на нейротропные вирусы, такие как HSV-1, постоянно нарушает взаимодействие между ЭНС и иммунными клетками.
Количество вирусов, физиологически обитающих в кишечнике человека, оценивается до 109 на грамм фекалий [15], в основном состоящих из бактериофагов (вирусов, инфицирующих прокариот) и в меньшей степени-вирусов, инфицирующих растения, амебы, человека и других животных [200]. Человеческий Виром в основном приобретается постнатально и находится под влиянием комбинации пищевых, материнских и экологических источников [201]. В течение своей жизни виром диверсифицируется и достигает своего пика к взрослой жизни [202]. Эукариотические вирусы, такие как Parvoviridae, Anelloviridae, Picobirnaviridae, Circoviridae и Reoviridae, часто являются частью кишечного вирома здоровых людей [200], несмотря на то, что они являются условно-патогенными микроорганизмами. Пока не ясно, какие вирусные сенсорные и сигнальные пути важны для регулирования иммунных ответов, чтобы контролировать количество и состав кишечного вирома человека.
5. Паразитарное влияние на кишечную нервную систему
Опосредованный нейронами ответ ЭНС и иммунной системы на паразитарную инфекцию еще полностью не выяснен [203]. Основные результаты, касающиеся паразитарного влияния на ЭНС, представлены в Таблице 3 и графически представлены на Рисунке 2. Кишечные паразитарные инфекции могут нарушить баланс гомеостаза кишечника, в основном за счет модификации компонентов ЭНС, участвующих в нейротрансмиссии, особенно продукции 5-HT.
Таблица 3. Паразиты и кишечная нервная система.
| Паразит | Патофизиологические модификации | Вовлеченные факторы |
| Cryptosporidium parvum | Измененный трансмембранный ионный транспорт / гиперсекреция | Холинергический и VIPергический ответ через простациклины; Повышенный уровень вещества P |
| Giardia duodenalis | Измененная сократительная способность кишечника; Стимулирование мальабсорбции и гиперсекреции | Истощение синтеза NO Снижение секреции 5-HT Повышение секреции CCK |
| Entamoeba histolytica | Истощение нейронов и аксонов | Процесс зависит от цистеин-протеаз |
| Nippostrongylus brasiliensis | Нарушение моторики | Производство VIP-подобного пептида |
| Trichinella spiralis | Повышенная сократительная способность кишечника | Измененные высвобождения нейромедиаторов при дисфункции 5-НТ рецепторов |
| Trypanosoma cruzi | Уменьшение кишечных глиальных клеток | Перекрестная реакция между паразитарными антигенами и человеческими хозяевами; Снижение сократительной способности из-за потери функции рецепторов Ach |
| Toxoplasma gondii | Фенотипические изменения кишечных нейронов | Повышенный ответ NO; Уменьшение VIPергических нейронов |
NO: оксид азота; 5-HT: 5-гидрокситриптамин; CCK: холецистокинин; Ach: ацетилхолин.
Кишечные паразиты способны секретировать вещества с низким молекулярным весом, такие как аммиак, мочевина и аминокислоты, а также молекулы белка с высоким молекулярным весом. Некоторые вещества, выделяемые паразитами, очень похожи на нейромедиаторы хозяина [204]. Эти вещества указывают на попытку паразита избежать иммунного ответа хозяина и создать благоприятную среду [205]. Считается, что некоторые кишечные паразиты (например, Anisakis simplex (сельдяной червь) и Schistosoma (шистосома)) способны продуцировать и секретировать ацетилхолинэстеразу, которая является ферментом, ответственным за разложение ацетилхолина, вызывая изменения в контроле перистальтики кишечника [206, 207]. Присутствие ацетилхолинэстеразы в кишечнике даже в очень низких концентрациях способно стимулировать рост и пролиферацию эпителиальных клеток слизистой оболочки кишечника [206, 207]. Кроме того, было показано, что другие нейротрансмиттеры, такие как ГАМК, серотонин, дофамин и VIP, присутствуют в кишечных паразитах как на личиночной, так и на взрослой стадии, готовые к секретированию в месте инфекции. Например, Nippostrongylus brasiliensis (желудочно-кишечный круглый червь) способен продуцировать и секретировать белок 30 кДа, который имеет большое структурное сходство с VIP. В экспериментальных моделях, когда белок паразитарного происхождения 30 кДа вводили в просвет кишечника, возникала кишечная реакция, аналогичная реакции, вызванной VIP [208]. Этот белок был способен, как и VIP, уменьшать амплитуду и частоту сокращений мышечных слоев кишечника.
Другие паразиты, как в случае Cryptosporidium (криптоспоридии), способствуют VIPергическому и холинергическому ответу за счет повышенной экспрессии простациклина, высвобождаемого местными нейтрофилами в ответ на инфекцию Cryptosporidium [209, 210]. Другие, такие как Giardia duodenalis (лямблии двенадцатиперстные), снижая количество 5-HT-секретирующих ECs, способствуют отбору CCK-содержащих энтероцитов двенадцатиперстной кишки посредством механизма, который остается неизвестным [211–213]. CCK участвует в сокращении гладких мышц и оказывает большое влияние на сокращение желчного пузыря и доставку желчи в кишечник, что имеет решающее значение для роста трофозоитов лямблий. Кроме того, из того, что появилось из мышечно-кишечного сплетения инфицированных Trichinella spiralis крыс, наблюдается повышенная экспрессия вещества Р примерно на 500% по сравнению с уровнями, обнаруженными в желудочно?кишечном тракте, не инфицированном паразитами [214]. Этот нейротрансмиттер выполняет важную функцию в иммунной системе, проявляя провоспалительные функции за счет улучшения функции лимфоцитов и макрофагов. Взаимодействие вещества P с его рецепторами напрямую вызывает вазодилатацию, что увеличивает проницаемость сосудов и делает возможным экстравазацию (излияние, утечку) плазмы и дегрануляцию тучных клеток. Дегрануляция тучных клеток высвобождает гистамин, который дополнительно усиливает сосудистые процессы и активирует ноцицепторы. Лимфоциты, гранулоциты и макрофаги имеют рецепторы к веществу P, и эти клетки можно стимулировать для выработки цитокинов. Макрофаги, стимулированные веществом P, продуцируют медиаторы воспаления, простагландин E2 и тромбоксан, а также провоспалительные цитокины, IL-1, IL-6 и TNF. Все эти молекулярные события поддерживают синтез и высвобождение новых молекул вещества P, таким образом поддерживая этот порочный круг [215, 216].
Исследования на экспериментальных моделях показали, что перед лицом инфекции кишечными паразитами инфузия антител к веществу P вызывает картину иммунной нейтрализации в желудочно-кишечном тракте. Эти данные указывают на то, что биодоступность вещества P представляет собой важный компонент нейрохимического ответа на воспаление кишечника, вызванное паразитами [217]. Другой компонент кишечной системы NANC, который представляет собой важную модификацию перед лицом паразитарной инфекции, - это внутренний оксид азота (iNO), который идентифицируется в кишечной нервной системе с помощью фермента, ответственного за его синтез - синтазы оксида азота (iNOS). Этот газ обладает мощной функцией расслабления мышц и представляет собой важный провоспалительный фактор в желудочно-кишечном тракте. Было показано, что перед лицом кишечной инфекции паразитами уровни iNOS резко снижаются в нервных сплетениях, слизистой оболочке кишечника и мышечных слоях [218].
В то же время заметная группа паразитов может влиять на ЭНС, способствуя разрушению нейронов или фенотипическим изменениям. Три примера представлены Entamoeba histolytica, Toxoplasma gondii и Trypanosoma cruzi.

Было обнаружено, что E. histolytica (дизентерийная амёба), широко распространенный простейший паразит, эндемичный в развивающихся странах и передающийся через попадание инфекционных цист через загрязненную пищу или воду, разлагает нейроны ЭНС с участием цистеиновых протеаз [219]. Более того, когда продукты или растворимые компоненты E. histolytica были добавлены к клеточным культурам, они уменьшали количество нейронов на 30% и количество аксонов на 50%, при этом прямая цитотоксичность была специфичной для популяции нейронов [219].

Toxoplasma gondii - это облигатное внутриклеточное паразитарное простейшее, обнаруживаемое во всем мире, чья инфекция обычно не вызывает видимых симптомов у здоровых людей. T. gondii вызывает количественные фенотипические изменения в нитрергических нейронах. Эти нейроны, которые сначала не выделяют NO, начинают секрецию в ответ на INF-? [220]. Кроме того, T. gondii индуцирует редукцию подслизистых VIP-реактивных нейронов и способствует цитокин-индуцированной гибели энтероглиальных клеток [221].

T. cruzi (Трипаносома крузи) - одноклеточное простейшее, вызывающееболезнь Шагаса. В своей хронической форме болезнь Шагаса развивается спустя десятилетия после первоначального инфицирования и изменяет нейрорегуляцию сердца и всего желудочно-кишечного тракта, особенно пищевода и толстой кишки. В завершающей стадии кишечного заболевания моторика пищеварительной системы нарушается, что приводит к расширению кишечных сегментов (шагасового мегаколона и мегаэзофагуса). Эта форма заболевания сопровождается резким похуданием из-за вторичной ахалазии нижнего пищеводного сфинктера. Хроническая вегетативная нервная патология, наблюдаемая при болезни Шагаса, имеет аутоиммунную основу [222], при этом антитела против нейронов образуются благодаря перекрестной реактивности между жгутиковым поверхностным антигеном T. cruzi и интрааксональными филаментами [223]. Кроме того, амастиготы трипаносомы крузи могут выделять нейротоксиноподобное вещество, обладающее нейролитическими свойствами [223].
Кишечная инфекция паразитами вызывает анатомо-функциональные изменения в мышечных слоях кишечной стенки и в ЭНС. Можно наблюдать утолщение наружного мышечного слоя тонкой кишки крыс и морских свинок и толстой кишки больных с пищеварительной формой болезни Шагаса [224], вероятно, за счет медиаторов, непосредственно происходящих от паразитов или воспалительного каскада. Увеличение толщины мышечных слоев происходит главным образом за счет гипертрофии гладкого продольного мышечного слоя (наружного слоя). Индукция гипертрофических изменений в гладкой мускулатуре кишечника в экспериментальных моделях посредством хирургической индукции стеноза кишечного сегмента указывает на то, что «гипертрофия» мускулатуры кишечника может фактически представлять собой адаптивные изменения, и исследования показывают, что она, по-видимому, непосредственно связана с увеличением нейронального и мышечного ответа на экспрессию серотонина [225].
Нарушение перистальтики кишечника из-за измененной сократительной способности мышечных слоев и связанное с этим нарушение транспорта жидкости - два постоянных доказательства паразитарных инфекций [226]. Однако задействованные механизмы различаются у разных видов. Некоторые паразиты будут иметь прямое влияние на ЭНС, изменяя либо количество нейронов, либо даже фенотип экспрессии нейропептидов. Другие паразиты, с другой стороны, будут влиять на высвобождение нейротрансмиттеров, которые, в свою очередь, изменяют кишечную активность и функции [227]. В настоящее время проводятся различные исследования с применением кишечных паразитов с использованием строго контролируемых клинических протоколов в качестве иммунотерапевтических средств для улучшения или восстановления баланса ЭНС перед лицом воспалительного заболевания кишечника человека [228]. Кроме того, исследования кишечных гельминтов предлагают модели для изучения долгосрочных последствий кишечных инфекций, вызывающих функциональные расстройства кишечника, такие как синдром раздраженного кишечника человека (СРК), который возникает при отсутствии воспалительных процессов и без серьезных гистопатологических изменений [229]. Взаимодействие между паразитом и хозяином в желудочно-кишечном тракте будет и впредь обеспечивать эффективные экспериментальные модели, позволяющие решать жизненно важные вопросы по определению интегративных механизмов, участвующих в нейроиммунной модуляции функции желудочно-кишечного тракта при инфекционных, аллергических и идиопатических состояниях кишечных заболеваний у млекопитающих-хозяев. Кроме того, корреляция между иммунным ответом хозяина, медиаторами воспаления и кишечной активностью, проявляемой при различных паразитарных инфекциях, имеет такое же значение, как и корреляция между иммунной системой, центральной нервной системой и осью желудочно-кишечного тракта. Дальнейшие исследования будут посвящены изучению роли паразит-индуцированной микробиоты в нейрорегуляторном ответе кишечника во время и после инфекции.
6. Выводы
Накапливающиеся данные свидетельствуют о том, что развитие и гомеостаз ЭНС опосредуются люминальными (в просвете) микробными факторами. В частности, патогены могут использовать нейротрансмиттеры ЭНС для усиления своего действия или даже для создания кишечной микросреды, подходящей для их воспроизводства. Кроме того, ЭНС может представлять собой первый интерфейс между содержимым кишечника и ЦНС, таким образом объясняя сложные взаимоотношения кишечных микробов и их влияние на воспаление ЦНС, поведение и даже действия. При этом существующие знания все еще находятся в зачаточном состоянии, и требуются дальнейшие исследования. Однако из текущих знаний возникает интересная область, которая может сформировать будущие концепции синергических взаимодействий патоген-хозяин. В нашем обзоре мы представили убедительные доказательства для концептуализации будущих исследований.
Источник: propionix.ru

