Пролить свет на память
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2020-08-04 05:09

По оценке журнала Science несомненные успехи получены в расшифровке нейрональных основ памяти – одной из фундаментальных задач нейронауки. Как известно, наша память меняется со временем: воспоминания могут тускнеть, а иногда мы можем «помнить» события, которые вообще не происходили. Одна из возможных причин этого феномена – изменение эмоционального контекста воспоминаний. Подтвердить это предположение удалось путем манипуляции активностью нейронов с использованием оптогенетического подхода, предложенного в 1999 г. одним из первооткрывателей структуры ДНК Ф. Криком. У генно-инженерных лабораторных мышей, в мозг которых был внедрен оптический световод, а в нейроны пространственной и эмоциональной памяти – ген светочувствительного белка, удалось не только поменять «плохие» воспоминания на «хорошие», но даже сформировать «ложную память»
Одним из наиболее выдающихся научных результатов 2014 г. журнал Science признал результаты работ по чрезвычайно точной манипуляции мозговыми нейрональными процессами путем облучения светом отдельных нейронов у генно-инженерных лабораторных животных. С помощью такого оптогенетического метода группе ученых из Массачусетского технологического института (США) удалось воздействовать на память, превратив плохие воспоминания в хорошие
Классические подходы к изучению функций мозга основаны на разрушении определенного отдела мозга либо на его химической или электрической стимуляции/угнетении и последующем анализе произошедших изменений. Но эти довольно грубые манипуляции не позволяют, к примеру, точно определить тип нейронов, в которых произошли нарушения (а нейроны отличаются по функции, морфологическим и биохимическим особенностям, профилю экспрессии (активации) генов), что затрудняет понимание полученных эффектов. Современные молекулярно-генетические технологии дают возможность выполнять более тонкие процедуры вплоть до манипулирования экспрессией отдельных генов в тканях мозга, что дает более точные результаты.
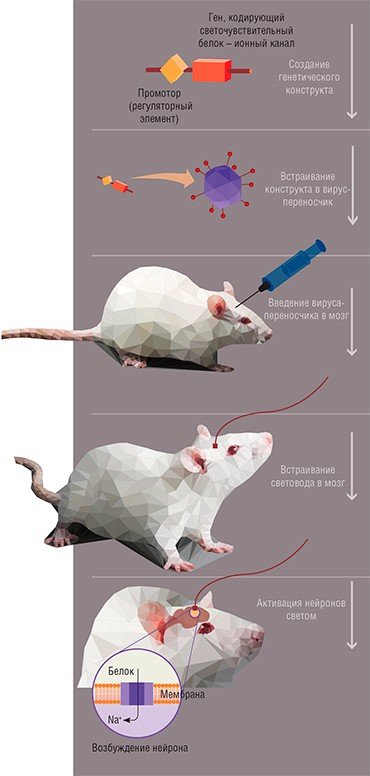
Одним из относительно новых и, как уже очевидно, перспективных методологических подходов к изучению функций мозга является оптогенетика. Оптогенетический метод позволяет извне регулировать активность нейронов и, соответственно, работу мозга с помощью света. Для этого нужно предварительно с помощью генно-инженерных методов внести в клетки мозга ген, кодирующий особый светочувствительный белок, который при активации под действием света вызывает возбуждение или ингибирование нейрона. Так, появляется возможность регулировать активность нейрона, «включая» и «выключая» экспрессию этого гена. Свет при этом подается с помощью лазера прямо в мозг экспериментального животного – мыши или крысы – через вживленный в него оптоволоконный световод.
Светочувствительные рецепторные белки опсины, реагирующие на свет, присутствуют во многих организмах (например, зрительный пигмент родопсин, содержащийся в сетчатке глаза у многих животных, от морских беспозвоночных до человека). Под действием света родопсин с помощью белков-посредников вызывает возбуждение нейрона, происходит открытие ионных каналов, и возбуждение передается дальше по нервным путям. Для задач оптогенетики наиболее удобным оказался светочувствительный белок ChR2 (канальный родопсин-2), выделенный из водорослей, который сам по себе служит каналом для прохода катионов сквозь клеточную мембрану.
Предположение о возможности манипулировать нейрональными процессами с использованием оптогенетического подхода была высказана еще в 1999 г. Нобелевским лауреатом Ф. Криком, одним из первооткрывателей структуры ДНК (Crick, 1999). Затем этот метод был успешно применен в экспериментах на плодовых мушках (Zemelman et al., 2002, 2003). Немного позже оптогенетический подход был применен и к млекопитающим – лабораторным крысам и мышам – группой исследователей под руководством К. Дейсерота и Э. Бойдена, которые начали использовать ChR2, а также ряд других опсинов (Boyden et al., 2005; Adamantidis et al., 2007). Оказалось, что оптогенетические манипуляции позволяют, например, корректировать некоторые поведенческие отклонения у экспериментальных животных, такие как ангедонию – отказ от удовольствия, последствия тревожности, а также дефицит эпизодической памяти, связанный с посттравматическими расстройствами (Convington et al., 2010; Tye et al., 2011; Goshen et al., 2011).
Одной из фундаментальных задач нейронауки является расшифровка нейрональных основ памяти. Ведь наша память меняется со временем: воспоминания могут тускнеть, а иногда мы можем даже «помнить» события, которые вообще не происходили. Одна из причин, по которым могут происходить изменения в нашей памяти, – это изменение эмоционального контекста воспоминаний. Например, приятные воспоминания о романтическом ужине могут перестать быть таковыми после размолвки, и хотя пространственная память в этом случае сохраняется, позитивные ассоциации теряются.
Наша пространственная память (память «где?») закодирована в особой структуре мозга – гиппокампе, а эмоциональность воспоминаний, их сопряжение с позитивными или негативными эмоциями (память «что?») кодируется в миндалевидном теле (амигдале). Считается, что эмоциональная память тесно связана с процессами запоминания и обучения. Нейроны амигдалы передают сигналы двигательной и гормональной системам мозга, непосредственно вовлеченными в реакции «предпочтения» и «избегания» (LeDoux, 2014).
В 2014 г. группа исследователей из Массачусетского технологического института под руководством Нобелевского лауреата С. Тонегавы опубликовала в журнале Nature свою очередную работу по изучению нейрональных основ памяти, в которой изложены результаты исследований взаимосвязи между представительствами пространственной и эмоциональной памяти и возможность управления такими ассоциациями (Redondo et al., 2014). Ученые применили оптогенетический подход, а свои эксперименты они проводили на самцах лабораторных мышей, в мозг которых был вживлен световод.
Мыши, на которых проводился эксперимент, принадлежали к генетической линии c-fos tTA: у этих животных можно регулировать экспрессию гена c-fos, экспрессирующегося при обучении и формировании памяти. Этот ген «выключают» добавлением в корм антибиотика доксициклина. Экспериментальных животных дополнительно «усовершенствовали», встроив им в нейроны гиппокампа и амигдалы ген, кодирующий светочувствительный белок ChR2, который мог экспрессироваться только одновременно с активацией маркера нейрональной активности c-fos.
В эксперименте одну группу мышей сначала подвергали слабому воздействию электрического тока («наказание»), а к другой группе запускали самок («поощрение»). Поскольку перед этим доксициклин удалялся из мышиного рациона, в активировавших нейронах гиппокампа и амигдалы происходила экспрессия гена c-fos и, соответственно, наработка белка ChR2. В результате нейроны, которые участвовали в формировании конкретной пространственной и эмоциональной памяти, оказались «помечены» этим светочувствительным белком. После этого в диету вновь был добавлен антибиотик, чтобы «выключить» экспрессию генов и таким образом сохранить нейрональный след негативной или позитивной памяти.
Затем мышей вновь помещали в ту же экспериментальную установку и, подавая свет, активировали у них нейроны, содержащие белок ChR2. У мышей, на которых накануне воздействовали электрошоком, воздействие светом активировало «память страха», поэтому они начинали активно избегать места своего наказания. И, напротив, животные, у которых накануне было «свидание» с самкой, после активации «памяти счастья» надолго оставались в экспериментальном отсеке, вспоминая «приятные» моменты.
На следующем этапе эксперимента было решено проверить возможность изменения памяти в зависимости от эмоционального контекста. Выяснилось, что если мышей с «памятью страха», у которых оптогенетически были активированы соответствующие нейроны гиппокампа, помеcтить к самкам, то ассоциации с этим местом «переключатся» с изначально негативных на положительные! Кстати сказать, «обратное» переключение ассоциаций с вознаграждения на страх при активации нейронов амигдалы оказалось затруднительным.
Более того, в еще одной своей работе исследователям удалось даже сформировать у экспериментальных животных ложную память! Мышей сначала помещали в нейтральную одну камеру (условно, «камера А»), светочувствительным белком «пометив» у них нейроны гиппокампа, связанные с нахождением в этом месте. Затем животных помещали в другую камеру (условно, «камера B»), где их подвергали воздействию электрошока и одновременно оптогенетически активировали у них нейроны гиппокампа, несущие пространственную информацию о «камере A». После этого мыши начали избегать «камеру А», хотя в ней их никогда не подвергали «наказанию» (Ramirez et al., 2013).
То, что память может меняться с плохой на хорошую и наоборот, было известно давно, но только сейчас стали приоткрываться механизмы такого переключения сознания. Применение метода оптогенетики и использование генетически-модифицированных животных позволит в будущем подробно откартировать нейрональные пути головного мозга. Это приблизит нас не только к более глубокому пониманию нейробиологических процессов мозга, но и, в конечном счете, созданию кардинально новых подходов для лечения ментальных заболеваний, которым сегодня подвержено около четверти человечества.
И если считать, что основная функция головного мозга – это централизованный контроль над всем организмом, то расшифровка секретов его работы может дать огромный толчок эволюции самого современного общества.
Литература
Adamantidis A. R. et al. Neural substrates of awakening probed with optogenetic control of hypocretin neurons // Nature. 2007. V. 450. P. 420–424.
Boyden E. S. et al. Millisecond-timescale, genetically targeted optical control of neural activity // Nat. Neurosci. 2005. V. 8. P. 1263–1268.
Crick F. The impact of molecular biology on neuroscience // Philos. Trans. R. Soc. Lond. B. 1999. V. 354. P. 2021–2025.
Goshen I. et al. Dynamics of retrieval strategies for remote memories // Cell. 2011. V. 147. P. 678–689.
LeDoux J. E. Coming to terms with fear // Proc. Natl. Acad.Sci. USA. 2014. V. 111. P. 2871—287.
Lima S. Q., Miesenb?ck G. Remote control of behavior through genetically targeted photostimulation of neurons // Cell. 2005. V. 121. P. 141–152.
Ramirez S. et al. Creating a false memory in the hippocampus // Science. 2013. V. 341(6144). P. 387—391.
Redondo L., Kim J., Arons A. L. et al. Bidirectional switch of the valence associated with a hippocampal contextual memory engram. // Nature. 2014. V. 513(7518). P. 426—30.
Robinson M. J. F. et al. Optogenetic excitation of central amydala amplifies and narrows incentive motivation to pursue one reward over another // J. of Nsci. 2014. N. 34(50), P. 16567—16580.
Tye K. M. et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety // Nature. 2011. V. 471. P. 358–362.
Zemelman B. V. et al. Amygdala Selective photostimulation of genetically chARGed neurons // Neuron. 2002. V. 33. P. 15–22.
Zemelman B. V. et al. Photochemical gating of heterologous ion channels: remote control over genetically designated populations of neurons // Proc. Natl. Acad. Sci. U. A. 2003. V. 100, P. 1352–1357.
Источник: scfh.ru