«Пластик, сэр!», или Бактериальная диета в стиле хай-тек
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2020-07-11 16:05
Статья Андрея Панова для «Биомолекулы» расскажет о бактериях, способных разрушать и усваивать один из самых популярных видов пластика — ПЭТ (полиэтилентерефталат). Многократно выросшее с годами количество ПЭТ-мусора сейчас напрямую влияет на стабильность естественных экосистем. Не дожидаясь помощи от людей, природа решила бороться с таким загрязнением сама — с помощью микроорганизмов.
Ежегодно в мире производится 311 млн тонн пластмасс. Более 50 млн тонн из них — это продукция из полиэтилентерефталата (ПЭТ): упаковка для продуктов питания, строительная пленка, волокна для изготовления одежды и т.д. Но лишь около 14% пластиковых изделий собирают для вторичной переработки. Основная масса остается в окружающей среде и представляет большую опасность для экосистем, особенно океанических . ПЭТ, получаемый из нефтепродуктов и содержащий высокий процент ароматических компонентов, — химически инертное, а потому чрезвычайно устойчивое в природных условиях соединение: у микробов либо нет ферментов, которые могли бы его разрушить , либо их активность низка [1].
Подробно о загрязнении мирового океана пластиковым мусором «Биомолекула» писала ранее — «А ты такой холодный, как... пластик в океане» [2].
Чем именно ограничена биодоступность нефтепродуктов в природных системах, рассказано в статье «Пределы биодоступности углеводородов в грунтах» [3].
До недавнего времени не было известно ни одного микроорганизма, который мог бы деградировать ПЭТ или использовать его для поддержания своего роста. Ситуация изменилась в 2007 году: немецкие ученые опубликовали статью о нитчатых грибах Fusarium oxysporum и F. solani, которые могли расти на минеральной среде, содержащей нити полиэтилентерефталата [4]. В 2011 году в Саргассовом море, где циркулирует более 1100 тонн пластикового мусора, обнаружили консорциум бактерий, питающихся пластиком, но отдельных форм так и не выделили [5]. В феврале 2016 года та же группа немецких биологов сообщила о гидролазе актиномицета Thermobifida fusca, способной расщеплять эфирные связи в ПЭТ [6]. На этом всё и закончилось. А вот если бы удалось изолировать отдельный бактериальный штамм, полностью разлагающий полиэтилентерефталат, изучить его катаболические ферменты и, что не менее важно, гены этих ферментов, то такой организм вполне можно было бы использовать для биологической переработки ПЭТ-мусора.
О впечатляющем спектре особенностей и способностей актиномицетов читайте в конкурсной работе 2015 года «„Зеленые“ революционеры» [7].
О вкусовых извращениях микробов биодеградации в двух словах
В биологическом разрушении любой сложной молекулы обычно участвует несколько микробных ферментов, гены которых часто находятся в составе не хромосомной, а плазмидной ДНК [8]. Плазмиды биодеградации, или D-плазмиды, — это самореплицирующиеся мобильные молекулы ДНК (рис. 1), которые придают клеткам новые «пищеварительные» функции и, соответственно, определенные микроэволюционные преимущества. Плазмиды размером более 20 т.п.н., как правило, имеют генетические системы, ответственные за собственный перенос в другие клетки (не обязательно того же бактериального вида) путем конъюгации. Такой горизонтальный генетический перенос — мощный фактор распространения катаболических генов внутри и между микробными популяциями.
О плазмидах, транспозонах и других странствующих нуклеиновых кислотах бактерий подробно рассказано в статье «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [9].
Из-за относительно небольшого размера плазмиды удобно изучать, перенося из клетки в клетку, вырезая из них определенные участки или, наоборот, встраивая новые. Используя плазмиды с целенаправленно объединенными специфическими генами, можно получать микроорганизмы с новыми функциями или совершенствовать уже имеющиеся микробные таланты, полезные для людей. Среди них особое место занимают уникальные способности бактерий и грибов к очистке среды от токсичных и устойчивых отходов промышленности. Микроорганизмам волей-неволей приходится адаптировать свои ферментные системы к усвоению веществ, с которыми в предшествующие промышленной революции миллионы лет эволюции они не сталкивались. Биотехнологи же стараются помочь микробам трудиться эффективнее — ради здоровья человеческого, конечно же, а не микробного.
Гены биодеградации множества нефтепродуктов (бензола, толуола, нафталина и др.) и некоторых пестицидов уже изучены [10], [11], но остаются еще трудноразлагаемые компоненты нефти, продукты ее переработки и иные ксенобиотики [12], генетика разрушения которых до конца не выяснена. В частности, на начальном этапе находится изучение биодеградации того же полиэтилентерефталата, давно и крепко полюбившегося промышленности капролактама (из него получают капрон, идущий на производство полиамидных пластмасс, упаковочных пленок и нитей, используемых в хирургии, рыбной ловле и автопроме) [13] и уже запрещенного антипирена — тетрабромдифенилового эфира [14].
Ideonella sakaiensis, микроб-гурманофутурист
Не секрет, что население Японского архипелага давно обитает в мире высоких технологий. Так почему же тамошние микробы должны отставать? Сосуке Ёсида и его коллеги в марте 2016 года сообщили об обнаружении бактерии, которая полностью деградирует и усваивает полиэтилентерефталат в качестве единственного источника углерода [15]. Авторы работы взяли на заводе по переработке пластиковых бутылок 250 проб почвы, сточных вод и активного ила, загрязненных ПЭТ, и провели отбор микроорганизмов, растущих на ПЭТ-пленке. Лишь в одной пробе оказался микробный консорциум (рис. 2а), который индуцировал морфологические изменения пленки (рис. 2б). Сообщество бактерий, дрожжеподобных клеток и простейших успешно деградировало поверхность пленки со скоростью 0,13 мг ? см?2 ? сут?1 при 30°C (рис. 2в).
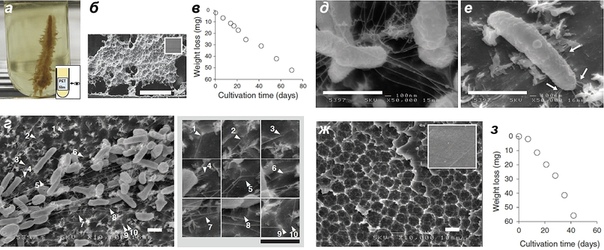
Последующие эксперименты показали, что единственным микроорганизмом, ответственным за биодеградацию ПЭТ, является Ideonella sakaiensis — грамотрицательная аэробная бета-протеобактерия (рис. 2г) [16]. Клетки идеонеллы оказались связанными друг с другом длинными отростками (рис. 2д), а с ПЭТ-пленкой — короткими (рис. 2г и 2е). Возможно, эти отростки задействованы в доставке секретируемых бактерией ферментов к пленке. При росте I. sakaiensis полиэтилентерефталатная пленка сильно повреждалась (рис. 2ж) и через шесть недель при 30 °С практически исчезала (рис. 2з).
Шесть недель — это, конечно, очень большой срок при таких размерах ПЭТ-пленки, однако эксперимент дает толчок для развития этого направления и, возможно, получения более эффективного штамма, который уже можно будет использовать для вторичной переработки ПЭТ-отходов.
«Нож» и «вилка» для нового блюда
Ёсида с сотрудниками полностью секвенировали геном I. sakaiensis и идентифицировали два ключевых фермента, участвующих в деградации ПЭТ [16]:
- ПЭТазу, секретируемую из клетки и «нарезающую» полиэтилентерефталат на гетеродимеры, представляющие собой моно-(2-гидроксиэтил)-терефталевую кислоту (МГЭТ);
- МГЭТазу — внутриклеточный фермент, который гидролизует поглощенную клеткой МГЭТ до двух мономеров: этиленгликоля и терефталата (рис. 3).
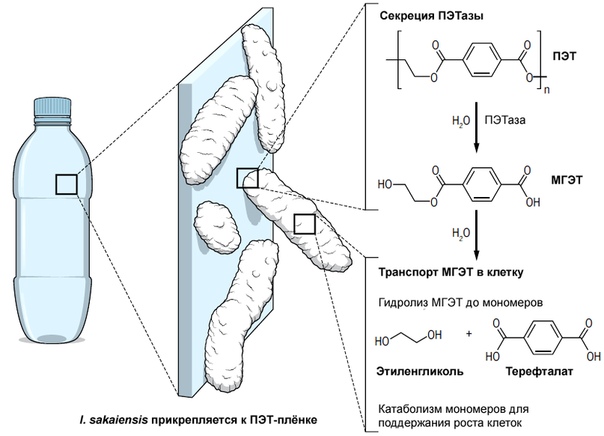
ПЭТаза показала лишь 51% гомологии аминокислотной последовательности с гидролазой T. fusca и предпочитала иной спектр субстратов. МГЭТазу отнесли к семейству ферментов танназ, однако она не проявляла активности в отношении ароматических эфиров, обычно преобразуемых танназами. Кроме того, оказалось, что экспрессия генов ПЭТазы и МГЭТазы позитивно регулируется самим полиэтилентерефталатом. На основании этого Ёсида сделал вывод, что оба фермента уникальны и необходимы именно для деградации ПЭТ [16]. К сожалению, авторы пока не установили, где конкретно находятся гены ферментов — на хромосоме или на внехромосомных элементах, — то есть могут ли они передаваться горизонтально между бактериями, что дало бы возможность без лишних усилий подобрать для экспрессии этих генов более эффективный штамм.
Нет пока ответа и на другой важный вопрос: что идеонеллы используют в качестве вилки — как получают доступ к волокнам ПЭТ на гладкой поверхности пластика? Например, при деградации целлюлозы решающее значение имеют специфические белки с углевод-связывающими модулями (УСМ), которые поднимают с поверхности отдельные волокна целлюлозы, что делает их доступными для гликозидаз и других гидролитических ферментов [17]. Японским ученым придется проверить, производят ли идеонеллы подобные УСМ-содержащие ферменты или же приноровились подбираться к волокнам полиэтилентерефталата иначе.
Заключение: а приборчики-то откуда?
Человечество производит изделия из полиэтилентерефталата и загрязняет ими окружающую среду почти 70 лет. Могли ли описанные японцами гидролитические ферменты появиться за столь короткий период, позволить бактериям питаться новым для них соединением и обеспечить преимущество в борьбе за существование?
Как ни странно, существует пример такой быстрой естественной эволюции — атразинхлоргидролаза. Гербицид атразин широко используется всего лишь с 1950-х годов и содержит в своей молекуле атом хлора. Атразинхлоргидролаза, разрушающая связь C-Cl, развилась из меламиндезаминазы, которая «неравнодушна» к связи C-N меламина. В результате мутаций всего девяти аминокислот меламиндезаминаза потеряла интерес к C-N-связи и стала атразинхлоргидролазой [18].
О быстрой эволюции бактериальных белков-регуляторов «биомолекула» рассказывала в статье «Бактерии способны заменить утраченный белок всего за 96 часов» [19].
Возможно, ПЭТаза посредством нескольких мутаций образовалась из кутиназы, деградирующей алифатический полимер кутин, но проявляющей небольшую активность и в отношении ПЭТ [20].
В этом контексте очень интересен вопрос: как происходит эволюция ферментов, как развиваются их новые активности? Есть предположение, что новые функции фермента (гена) возникают, когда селекция идет по его минорной побочной активности (как в случае с кутиназой). В подходящих условиях эта активность повышается чаще всего путем дупликации гена. Поскольку в результате копирования не страдает исходная функция, а предпочтительная в новых условиях активность возрастает, возникает платформа для отбора различных вариантов путем рекомбинации и точечных мутаций. Так происходит дивергенция с родительским геном, и модифицированные копии постепенно распространяются по популяции [21]. Группе Ёсиды, чтобы выяснить родословную ферментов идеонеллы, придется изучить не только полиморфизм генов ПЭТазы и МГЭТазы, но и их трехмерные структуры в сравнении с филогенетически близкими ферментами.
Литература
- M?ller R.J., Kleeberg I., Deckwer W.D. (2001). Biodegradation of polyesters containing aromatic constituents. J. Biotechnol. 86, 87–95;
- А ты такой холодный, как... пластик в океане;
- Пределы биодоступности углеводородов в грунтах;
- Nimchua T., Punnapayak H., Zimmermann W. (2007). Comparison of the hydrolysis of polyethylene terephthalate fibers by a hydrolase from Fusarium oxysporum LCH I and Fusarium solani f. sp. pisi. Biotechnol. J. 2, 361–364;
- Пластик на завтрак;
- Wei R., Oeser T., Schmidt J., Meier R., Barth M., Then J., Zimmermann W. (2016). Engineered bacterial polyester hydrolases efficiently degrade polyethylene terephthalate due to relieved product inhibition. Biotechnol. Bioeng. 113, 1658–1665;
- «Зеленые» революционеры;
- Top E.M., Springael D., Boon N. (2002). Catabolic mobile genetic elements and their potential use in bioaugmentation of polluted soils and waters. FEMS Microbiol. Ecol. 42, 199–208;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Lu X.Y., Zhang T., Fang H.H. (2011). Bacteria-mediated PAH degradation in soil and sediment. Appl. Microbiol. Biotechnol. 89, 1357–1371;
- Chakraborty J. and Das S. (2016). Molecular perspectives and recent advances in microbial remediation of persistent organic pollutants. Environ. Sci. Pollut. Res. Int. 23, 16883–16903;
- Биодеградация белого фосфора: как яд стал удобрением;
- Есикова Т.З., Волкова О.В., Таран С.А., Боронин А.М. (2015). Ключевая роль dca-генов в катаболизме epsilon-капролактама у бактерий рода Pseudomonas. Микробиология. 84, 616–619;
- Zhang S., Xia X., Xia N., Wu S., Gao F., Zhou W. (2013). Identification and biodegradation efficiency of a newly isolated 2, 2’, 4, 4’-tetrabromodiphenyl ether (BDE-47) aerobic degrading bacterial strain. Int. Biodeter. Biodegr. 76, 24–31;
- Yoshida S., Hiraga K., Takehana T., Taniguchi I., Yamaji H., Maeda Y. et al. (2016). A bacterium that degrades and assimilates poly(ethylene terephthalate). Science. 351, 1196–1199;
- Bornscheuer U.T. (2016). Feeding on plastic. Science. 351, 1154–1155;
- Bornscheuer U., Buchholz K., Seibel J. (2014). Enzymatic degradation of (ligno)cellulose. Angew. Chem. Int. Ed. Engl. 53, 10876–10893;
- Seffernick J.L., de Souza M.L., Sadowsky M.J., Wackett L.P. (2001). Melamine deaminase and atrazine chlorohydrolase: 98 percent identical but functionally different. J. Bacteriol. 183, 2405–2410;
- Бактерии способны заменить утраченный белок всего за 96 часов;
- Espino-Rammer L., Ribitsch D., Przylucka A., Marold A., Greimel K.J., Herrero Acero E. et al. (2013). Two novel class II hydrophobins from Trichoderma spp. stimulate enzymatic hydrolysis of poly(ethylene terephthalate) when expressed as fusion proteins. Appl. Environ. Microbiol. 79, 4230–4238;
- Bergthorsson U., Andersson D.I., Roth J.R. (2007). Ohno’s dilemma: evolution of new genes under continuous selection. Proc. Natl. Acad. Sci. USA. 104, 17004–17009;
- Тейлор Д., Грин Н., Стаут У. Биология. Том 1 (3-е изд.). М.: «МИР», 2004. — 454 с.
Источник: m.vk.com