CRISPR — самые маленькие ножницы в мире
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2020-07-30 15:05
Те из вас, кто старается следить за достижениями в области современной биологии, хотя бы раз наверняка сталкивались с упоминанием загадочной технологии CRISPR, которая вроде как революционировала «поле боя» молекулярных генетиков. Предполагаю, что даже многие биологи плохо себе представляют, как эта штука работает и какие возможности даёт, так что решил посвятить этому свою статью.
Сразу скажу, что для понимания содержания статьи потребуется как минимум знать, что такое ДНК. Если надо освежить знания – добро пожаловать в мой прошлый пост.
Итак, встречайте:
CRISPR - Clustered Regularly Interspaced Short Palindromic Repeats (регулярно расположенные группами короткие палиндромные повторы) – это вообще такие участки генома бактерий и архей, которые отвечают у них за любопытную систему защиты от вирусов. Ещё в далеком 2013м учёные смогли заставить эту систему работать в искусственно созданных условиях, заставляя её резать ДНК не в бактериях, а вполне себе в эукариотических клетках. С тех пор много воды утекло, элементы этой системы доработали до совершенства и коммерциализировали все, кому не лень. Но как же оно всё работает в лаборатории и помогает учёным? Давайте разбираться.
Зачем всё это?
Одна из задач, которую решают современные молекулярные генетики – узнать, зачем нужен тот или иной ген. Прочтение генома в наше время – довольно простой процесс, но он даст нам только последовательность «букв», а не понимание того, какой ген за что отвечает. Классический способ узнать, зачем нужен определённый ген – выключить его и посмотреть, что будет. Научным языком это называется «нокаутировать» ген, а полученный организм – «нокаут» по такому-то гену. Далее можно исследовать, что же не так с несчастным животным/растением, и делать выводы о функциях выключенного гена.

И было бы очень классно иметь такой способ, который позволит легко и просто резать ДНК, но при этом очень точно и в нужном исследователю месте, выключая именно тот ген, который надо... Вообще-то, и до появления CRISPR подобные методы уже существовали (см. TALEN, например), но все они были довольно трудоёмкими в исполнении. CRISPR же - сравнительно простая технология, применение которой легко поставить на поток. Что же именно происходит при ее применении? Чтобы разобраться, давайте сначала узнаем несколько важных терминов, без которых нам не обойтись.
Важные термины
Сas9 – бактериальный белок, способный вносить двунитевые разрывы в молекулу ДНК (вы же помните, что там две нити, да?).
Guide RNA, или gRNA – специальная молекула РНК, которая служит как система наведения – она заставляет белок Cas9 резать там, где надо. Напомню, что РНК химически очень похожа на ДНК, но так исторически сложилось, что РНК выполняет в клетке иные функции, чем ДНК.
CRISPR RNA, или crRNA – часть gRNA, отвечающая непосредственно за наведение Cas9 на цель.
Tracer RNA, или tracrRNA – вторая часть gRNA, она отвечает за связывание с белком Cas9. В природе эта и другая, предыдущая штуковина – две отдельные молекулы. Но в лабораторных опытах, как правило, используют химерную молекулу, в которой они обе просто сшиты друг с другом, как половинки.
Экспериментальная часть
Вот теперь можно переходить к практике. Допустим, учёным надо выключить ген А в культуре клеток. Культура клеток, кстати – это такая каша из клеток, обычно одного типа, которая просто растёт в специальной ёмкости в лаборатории. Учёные часто с ними работают, чтобы не иметь дела с настоящими животными и не мучить людей. Так вот, учёным уже известна последовательность нуклеотидов в ДНК того самого гена А в этих клетках, и они решают использовать метод CRISPR для достижения цели. Для этого берётся (заказывается у поставщика или синтезируется самостоятельно) молекула gRNA, причём молекула эта подбирается таким образом, чтобы её отрезок – crRNA – был комплементарен тому участку гена А, который надо разрезать. К ней подмешивается белок Cas9 – эдакие «безумные ножницы», которые очень любят резать ДНК. Однако сами они резать как попало не могут – им надо показать, где резать – именно это и делает gRNA. Потом эту смесь из gRNA и Сas9 доставляют внутрь клеток (тут есть разные способы, это отдельная история), где она и приступает к работе. Вторая половина gRNA называется, как вы помните, tracrRNA, и ею белок Cas9 прицепляется к gRNA. Благодаря наведению crRNA, дружная парочка gRNA+Cas9 садится на нужный участок ДНК клетки и режет обе её цепи. Причём не где-нибудь, а в строго определенном месте – между шестым и седьмым нуклеотидами того участка генома, который был комплементарен crRNA. Единственное условие тут – первые три нуклеотида этого участка должны быть NGG, где N – это вообще любой нуклеотид. Не хочу излишне усложнять мой рассказ, но этот волшебный важный триплет называется PAM site (Protospacer Adjacent Motif).
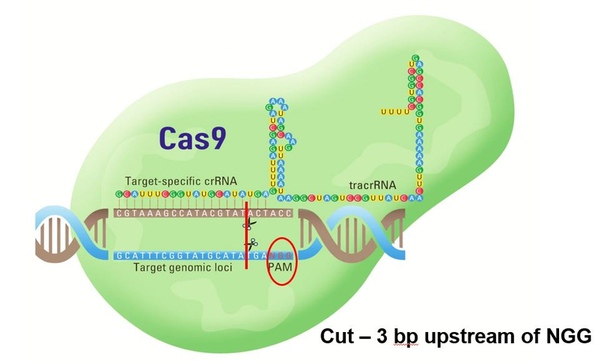
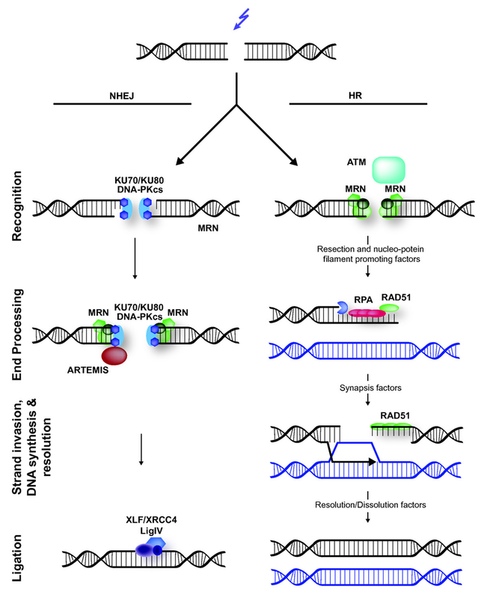
И вот тут начинается самое интересное. Заметьте, система CRISPR просто вносит разрез, она больше ничего не умеет! Достаточно ли этого, чтобы выключить ген в клетке? Никак нет. За миллионы лет эволюции живые системы научились беречь ценную ДНК и исправлять в ней всякого рода разрывы, химические поражения и прочие гадости. Занимается этим специальная клеточная контора под названием система репарации ДНК. Как только она замечает, что имеет место двунитевой разрыв ДНК, то сразу направляет к месту разрыва разные белковые комплексы, которые пытаются исправить ситуацию, причём каждый по-своему. Доходит до того, что они натурально конкурируют друг с другом за право починить ДНК, отчего существуют сразу несколько вариантов дальнейшего развития событий.
Как репарация ДНК служит нам
Вариант 1. Процесс идёт по пути негомологичного слияния концов – Non-Homology End Joining (NHEJ). Большое количество белков прилетает на место разрыва, и начинают работать – одни отрезают чуть-чуть оборванные концы (не всегда, правда), другие достраивают концы как надо, третьи сшивают место обрыва. Удобно, быстро – но не всегда точно! После достраивания концов иногда в последовательности оказываются нуклеотиды, которых там прежде не было, причём их количество тоже может варьировать. Если же «рембригада» всё восстановила правильно, как было – наш комплекс CRISPR-Cas9 никуда не делся, и он опять порежет это место! И так до тех пор, пока рьяные белки-помощники не изменят место разрыва до такой степени, что Cas9 больше не сможет на него сесть. Или пока Cas9 не деградирует, «устав» резать ДНК.
Вариант 2. Процесс идёт по пути гомологичной репарации – Homology Directed Repair (HDR). Тут всё ещё сложнее: вместо того, чтобы просто сшить два куска ДНК, попутно вставив пару сомнительных букв, белки-помощники решают «заглянуть в инструкцию» - в данном случае, во вторую копию этого гена в сестринской хромосоме! Вы ведь помните, что у большинства организмов (включая нас с вами) в каждой клетке содержится две (а то и больше) копии ДНК? У всякого гена есть его гомологичная «сестричка», которая более или менее на него похожа. В случае HDR, путём хитрых манипуляций белки используют сестринскую копию гена, чтобы правильно восстановить место разрыва. Этот метод более надёжный, чем NHEJ, и даёт учёным одно важное преимущество, о котором мы поговорим чуть позже. Напомню, что если системе репарации удалось восстановить исходную последовательность порванной цепи, то её, беднягу, опять режет Cas9, и всё начинается сначала.

Итак, если мне нужно просто нокаутировать ген в объекте моего исследования, то достаточно надеяться, что клетка после обработки CRISPR-Cas9 запустит первый вариант репарации (NHEJ), и в итоге часть клеток получит мутации, «вырубающие» нужный мне ген. Профит, дело сделано! Но зачем я тогда упоминал про второй вариант репарации, спросите вы? Давайте ещё раз на него посмотрим. Ремонтные белки используют гомологичную копию гена, чтобы исправить повреждение. А что если... (с этого начинаются все безумные идеи ученых) ...если этим белкам под видом гомологичной копии подсунуть кусок ДНК, который мы сами создали и который содержит нужные нам изменения в гене? Тогда они вставят информацию с этого куска в геном в твёрдой уверенности, что сделали всё как надо... Образно говоря, мы слегка подправили им инструкции. И действительно, так всё и происходит! Такая технология позволяет нам не просто вносить случайные изменения в ДНК, но и абсолютно точно изменять нужные нам её участки. Обратите внимание, что CRISPR в этом случае просто ломает ДНК там, где надо, чтобы тем самым вызвать белки «ремонтной бригады», а всю нужную нам работу делают уже они. С точки зрения лабораторного эксперимента все просто: в этом случае вместе с gRNA и белком Cas9 мы также вводим в клетку отрезок ДНК, несущий нужный нам код – он называется донором. В идеальном варианте информация донора в неизменённом виде будет встроена в целевой геном, добавляя клеткам или организму нужные нам генетические особенности.
Заключение
Итак, суммируем: для простого нокаута нам достаточно обработать клетки/организмы смесью из gRNA и Cas9, чтобы сами клетки при попытке исправить устроенные Cas9 разрушения, с помощью механизма NHEJ внесли в ДНК случайные мутации, выключающие ген. Для точной же модификации ДНК мы также добавим в нашу «взрывную смесь» донорную последовательность, которую клетки благополучно используют в процессе HDR, чтобы «поправить» свою ДНК (а на деле внести в неё необходимые нам изменения).
Разумеется, такие эксперименты требуют немалых умственных и временных затрат: надо заранее продумать последовательность gRNA, чтобы она вела Cas9 к нужному месту в геноме, а не куда-нибудь ещё. Если мы идём по пути HDR, то также надо продумать последовательность донора. Кроме того, следует спланировать, как и в каком виде мы будем доставлять всё это в клетки – тут есть разные варианты в зависимости от множества факторов (тип клеток, размер вставки и т.п.). Наконец, последняя часть эксперимента, самая нудная – нам надо отсортировать клетки, в которых ничего не поменялось (клетки дикого типа), от тех, где модификация прошла успешно. Тут у учёных тоже имеется целый арсенал методов, от простых на основе ПЦР, типа GCD (Genomic Cleavage Detection), до полногеномного секвенирования на монстроподобных агрегатах.
Надеюсь, мне удалось простым языком рассказать о том, что же такое CRISPR, и как его применяют. В качестве бонуса фотка — фотка довольного меня пару лет назад. Именно тогда мне удалось лично познакомиться с применением технологии CRISPR.

Спасибо, что прочитали! До встречи в новых постах!
Литература по теме
- Редактирование генома с CrISPR/Cas9 — ПостНаука
- Просто о сложном: CRISPR/Cas — БиоМолекула
Источник: www.jax.org