Эпигенетические механизмы наркозависимости
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-11-11 15:10

В настоящее время существует мало фармакологических методов лечения наркомании, а те, что есть, имеют низкую эффективность у многих людей. Это может быть связано с постоянными функциональными изменениями в головном мозге, индуцированными приемом наркотиков и лекарств, индивидуальным фенотипом зависимости. Постоянный прием наркотиков, связанный с зависимостью, вызывает изменения в структуре и функции клеток и путей головного мозга, которые лежат в основе аддиктивного поведения, например, поиск наркотиков и склонность к рецидивам. Поэтому определение целевых механизмов, которые управляют функциональными изменениями работы мозга, это важный шаг в изучении этиологии зависимости и разработки новых методов лечения. Это потребует всестороннего понимания нейробиологических процессов зависимости, включая роль экспрессии генов и регуляцию экспрессии, изменения в структуре и функции нейронов, индуцированные приемом наркотиков [1].
Термин «эпигенетика» используется для описания динамических молекулярных модификаций, отражающихся на хроматине в ядре клетки, что регулирует функции таких процессов, как репарация ДНК, организация хроматина, транскрипция и сплайсинг РНК и другие. Ученые, исследующие явление наркомании, заинтересовались изучением эпигенетики из-за того факта, что индивидуальный опыт, в частности волевое, многократное употребление наркотиков, изменяет конфигурацию хроматина в мозге, что вариативно в зависимости от области мозга и типа клетки [2, 6].
Эпигенетические механизмы действуют на протяжении всей жизни. Такие механизмы, вероятно, важны на ранних этапах развития, так как вносят свой вклад в различия между индивидуумами, которые возникают случайно даже при одинаковых условиях среды. Когда определенные типы эпигенетических модификаций после их возникновения являются постоянными, возможно, что определенные эпигенетические изменения, возникающие в результате поведенческого опыта или случайных событий развития, лежат в основе постоянных изменений в функции мозга [3].
Нейроэпигенетический ландшафт
Считается, что путем регулирования процессов, связанных с ДНК, эпигенетические изменения, индуцированные веществами, способствуют нарушению клеточных функций, чем и объясняется патогенез наркомании. Есть многообещающий терапевтический потенциал в отношении нацеливания на ключевые эпигенетические модификации для борьбы с привыканием [2].
Посттрансляционные модификации (ПТМ) гистонов меняют пространственную структуру хроматина, контролируя процессы, связанные с ДНК. Гистоновые субъединицы могут быть модифицированы путем ацетилирования, метилирования, фосфорилирования, рибозилирования АДФ, убиквитилирования и сумоилирования и др. Гистоновые ПТМ обратимы: они динамически осуществляются записывающими белками, которые распознаются считывающими белками, которые опосредуют клеточный ответ, и удаляются стирающими белками. Экспрессия и функция многочисленных записывающих белков, стирающих и считывающих изменяются как у людей с зависимостью, так и в животных моделях зависимости. Восстановление нормальной функции этих белков с помощью фармакотерапии — новая ниша для разработки лекарств против наркомании [2]..
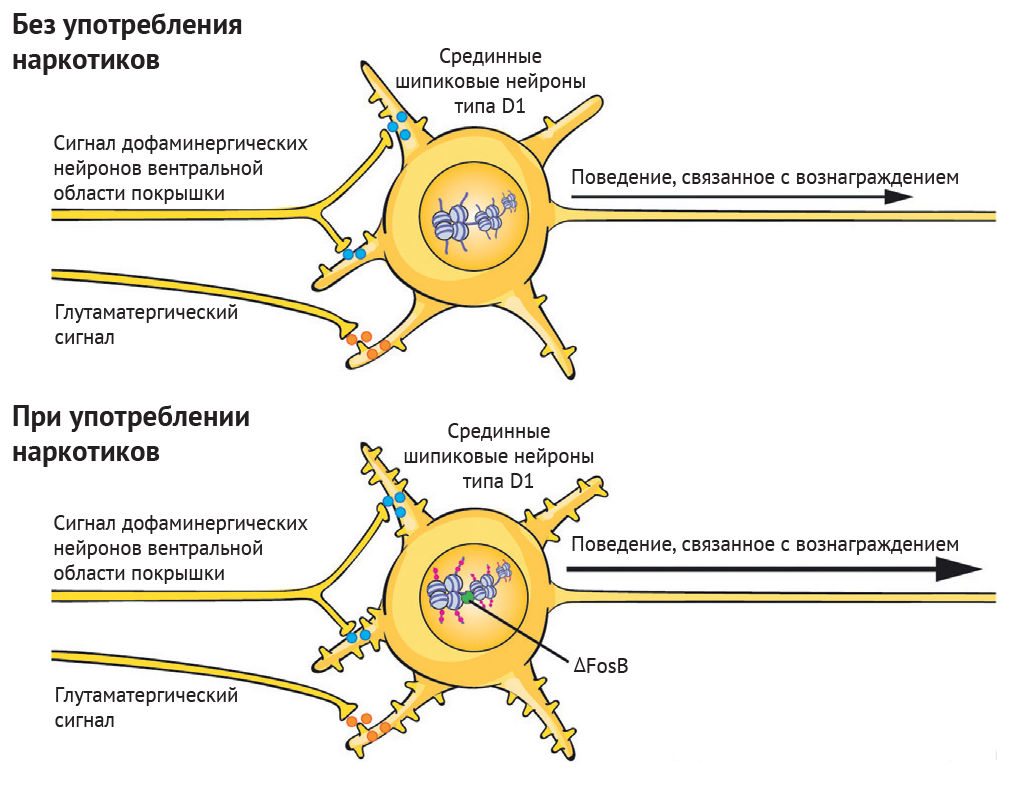
Рисунок 1 | Хроническое употребление наркотиков изменяет эпигеном в нейронах системы вознаграждения [2].
Вверху: при отсутствии приема наркотиков срединные шипиковые нейроны в прилежащем ядре получают дофаминергические сигналы из вентральной области покрышки и глутаматергические сигналы из нескольких корковых и таламических областей головного мозга. Эти срединные шипиковые нейроны получают и интегрируют сигналы системы вознаграждения, а баланс ферментов, записывающих и стирающих в ядрах нейронов, обеспечивает нормальную обработку сигналов вознаграждения, что необходимо для выживания организма. В прилежащем ядре два типа срединных шипиковых нейронов: D1-тип и D2-тип, названные в честь рецептора дофамина, который они преимущественно экспрессируют. На изображении только нейроны типа D1. Внизу: хроническое употребление наркотиков нарушает баланс регулирующих белков, записывающих и стирающих, что приводит к эпигенетическим адаптациям в определенных локусах в ядре срединных шипиковых нейронов.
Адаптации и лекарственная индукция факторов транскрипции (например, DFosB) опосредуют изменения транскрипции многих генов, включая гены, кодирующие нейротрансмиттерные рецепторы, белки цитоскелета и ионные каналы. Вследствие этих транскрипционных адаптаций меняется морфология срединных шипиковых нейронов (например, показана повышенная плотность дендритных шипиков) и физиологическая функция в отношении процессов вознаграждения. Это лежит в основе поведенческих дезадаптаций, определяющих зависимость.
Синаптическая пластичность в контексте наркозависимости
Синаптическая пластичность — это возможность изменения силы синапса (величины изменения трансмембранного потенциала) в ответ на активацию постсинаптических рецепторов [4].
Начальная доза наркотического препарата потенцирует возбуждающие афферентные волокна на дофаминовые нейроны вентральной области покрышки. Потенцирование возбуждающих глутаматергических афферентов из медиальной префронтальной коры и вентрального гиппокампа на срединные шипиковые нейроны прилежащего ядра, экспрессирующие рецептор D1, ассоциировано с поиском наркотиков. Для индукции такой пластичности обычно требуется дофамин, механизмы экспрессии варьируются, и метаботропные рецепторы глутамата могут ограничивать потенцирование. Для возбуждающей передачи характерной особенностью является инсерция глутаматных рецепторов AMPA — и в некоторых случаях инсерция проницаемых для кальция AMPA-рецепторов без GluA2 в постсинаптическую плазматическую мембрану. Вызванная лекарственным средством пластичность передачи ГАМК выражается пресинаптическим механизмом, изменяющим высвобождение ГАМК. Нейроны прилежащего ядра также экспрессируют проницаемые для кальция AMPA-рецепторы после воздействия лекарственного средства, особенно при употреблении кокаина [3,5]..
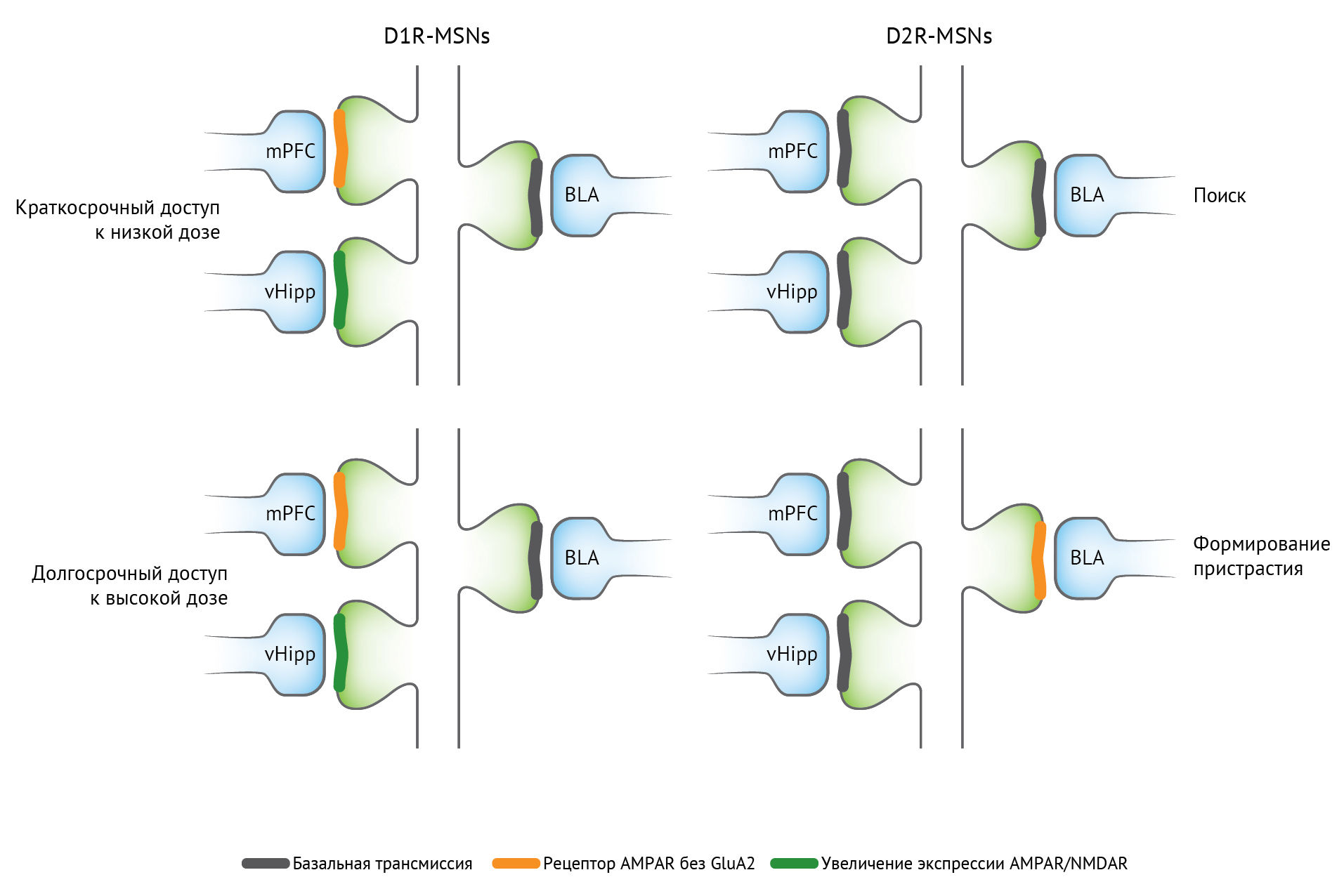
Рисунок 2 | Специфическая синаптическая пластичность в прилежащем ядре [5]
Изображены разные механизмы экспрессии синаптической пластичности, обусловленной воздействием наркотиков. Обратите внимание, что воздействие высоких концентраций кокаина приводит к инсерции AMPAR, не содержащих GluA2, в оба D1R и D2R-MSN, хотя и при разных исходных данных.
Сокращения: AMPAR — рецептор ?-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты; БЛА — базолатеральная миндалина; D1R — дофаминовый рецептор — D1 рецептор; D2R — дофаминовый рецептор D2; mPFC — медиальная префронтальная кора; MSN — срединный шипиковый нейрон; NMDAR — N-метил-D-аспартатный рецептор; vHipp — вентральный гиппокамп.
Воздействие кокаина и опиатов регулирует общее количество функциональных глутаматергических синапсов на прилежащем ядре срединных шипиковых нейронов, так как молчащие синапсы экспрессируют NMDA-рецептор и не экспрессируют AMPA-рецептор [3].
АМРА-рецептор (рецептор ?-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты, AMPAR), релокализованные после первого воздействия наркотических средств, заменяются на GluA2-содержащие рецепторы, которые синтезируются de novo. В прилежащем ядре сопутствующая активация рецепторов D1R и N-метил-D-аспартата (NMDAR) запускает путь MAP-киназы-ERK, который влияет на транскрипцию. Ремоделирование путей прилежащего ядра, лежащее в основе привычек и зависимостей, и нескольких областей выше, иннервирующих прилежащее ядро через глутаматергические нейроны — префронтальная кора, вентральный гиппокамп, базолатеральная миндалина и таламус, каждый из которых получает дофамин из дофаминовых нейронов вентральной области покрышки — появляются в качестве основных локусов ремоделирования путей дофамина. Область, которой уделяется наибольшее внимание — медиальная префронтальная кора, с нисходящими глутаматергическими путями от медиальной префронтальной коры до прилежащего ядра и нескольких других подкорковых областей, связанных с неадаптивным поведением и индивидуальной уязвимостью (рисунок 3) [3]..
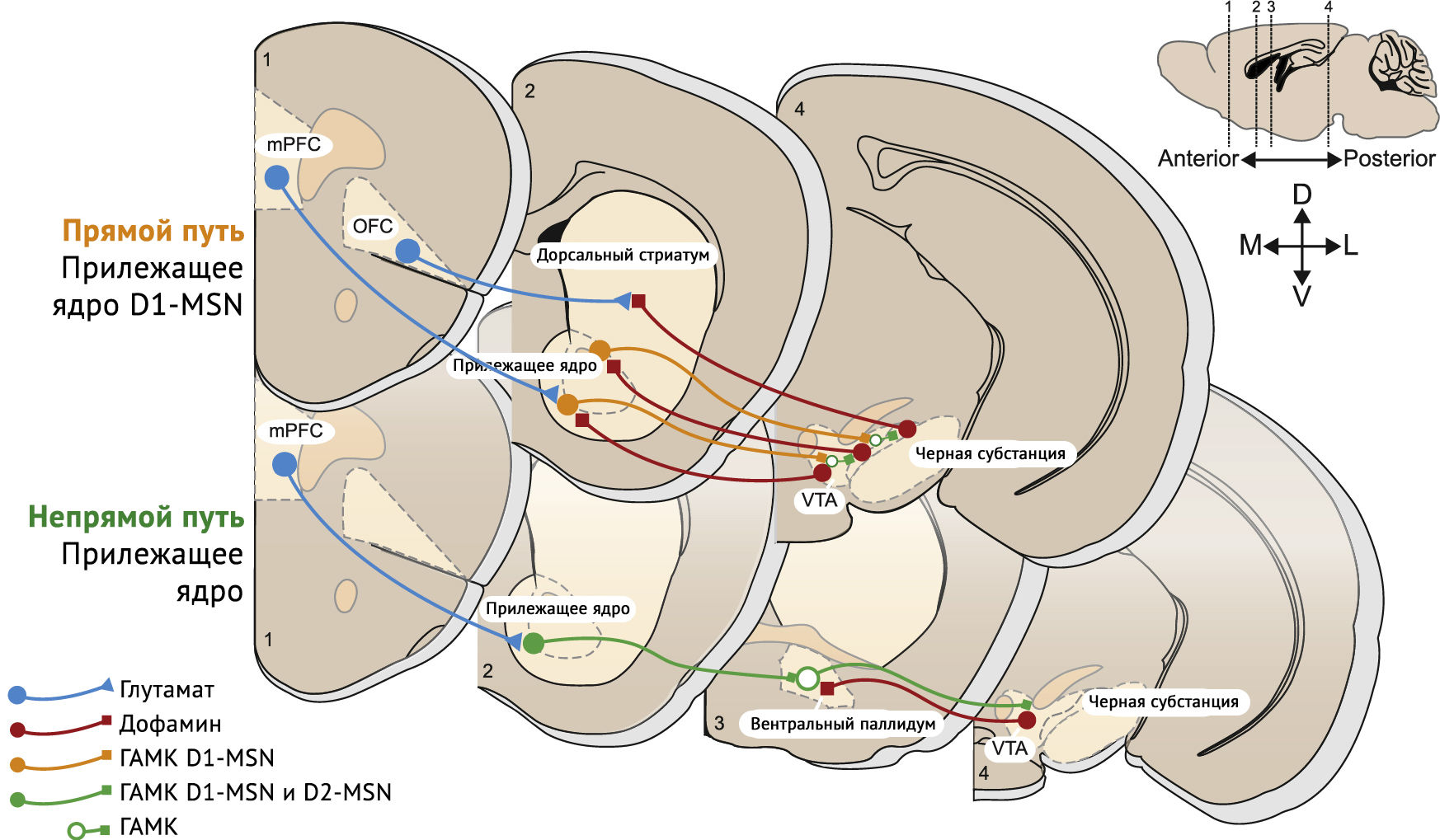
Рисунок 3 | Пути головного мозга, участвующие в неадаптивном поведении, которое может подвергаться эпигенетическому ремоделированию [3]
Основные пути, на которые нацелены наркотики, включают глутаматергический корковый нисходящий путь, идущий от среднего мозга до стриатных петель. Можно выделить два основных потока: прямой путь, состоящий исключительно из шипиковых нейронов со средней экспрессией D1R, и косвенный путь, который содержит как D1, так и D2R нейроны и достигает среднего мозга через реле в паллидуме. С увеличением продолжительности воздействия наркотиков и переходом к неконтролируемому употреблению наркотиков может быть задействовано все больше и больше нервных ганглиев.
Синаптическое потенцирование наблюдалось в афферентных волокнах проекционных срединных шипиковых нейронов D1 и D2 и опосредовано постсинаптическим механизмом экспрессии. Механизмы индукции этих синаптических изменений недостаточно изучены. При хроническом воздействии наркотиков может быть задействовано все больше и больше нервных узлов и путей. Фактически анатомические знания и эксперименты подтверждают эту ??концепцию [3].
Стимуляция более дорсальной предлимбической области способствует употреблению наркотиков, тогда как стимуляция более вентральной инфралимбической области сдерживает рецидив после вымирания. Обе области могут вести и сдерживать поиск наркотиков в зависимости от текущей ситуации и исходных данных пациента. Усовершенствованная модель учитывает проекции путей отдельных нейронов медиальной префронтальной коры/прилежащего ядра, которые объединяются в прелимбической области и инфралимбической, чтобы достичь ядра и оболочки прилежащего ядра. При повторении приема нракотиков активность инфралимбической превалирует над активностью прелимбической области, а инактивация инфралимбической области восстанавливает целенаправленное поведение. Эта модель предполагает, что привычные показатели достигнуты при переключении с прелимбической области на инфралимбическую. Были вовлечены и другие области префронтальной коры — дисфункция орбитофронтальной коры, которая может способствовать неконтролируемому потреблению наркотических веществ. Если медиальная префронтальная кора и орбитофронтальная кора играют роль в обновлении аффективной ценности стимулов и результата действия во время целенаправленного поведения, они могут дисфункции в патологических состояниях, где зависимость является ключевым симптомом [3].
Развитие наркозависимости начинается с первого приема и постепенно консолидируется во время повторного, но все еще контролируемого употребления наркотиков. По мере того как потребление растет, прием наркотиков становится необходимым, что приводит к потере контроля над употреблением наркотиков. Это развитие может зависеть от формирования привычки, которое постепенно становится все более и более выраженным, что в конечном итоге квалифицируется как зависимость [3].
Источники:
1. Eagle A., Al Masraf B., Robison A. J. Transcriptional and Epigenetic Regulation of Reward Circuitry in Drug Addiction //Neural Mechanisms of Addiction. – Academic Press, 2019. – С. 23-34.
2. Hamilton P. J., Nestler E. J. Epigenetics and addiction //Current opinion in neurobiology. – 2019. – Т. 59. – С. 128-136
3. Nestler E. J., L?scher C. The molecular basis of drug addiction: linking epigenetic to synaptic and circuit mechanisms //Neuron. – 2019. – Т. 102. – №. 1. – С. 48-59.
4. Citri A., Malenka R. C. Synaptic plasticity: multiple forms, functions, and mechanisms //Neuropsychopharmacology. – 2008. – Т. 33. – №. 1. – С. 18.
5. L?scher C. The emergence of a circuit model for addiction //Annual review of neuroscience. – 2016. – Т. 39. – С. 257-276.
6. Bastle R. M., Neisewander J. L. Epigenetics and Drug Abuse //Recent Advances in Drug Addiction Research and Clinical Applications. – 2016. – С. 21
Источник: medach.pro