Что такое оптогенетика?
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-11-12 15:10
Оптогенетика — метод исследования работы нервных клеток путем внедрения в мембрану специальных каналов — опсинов, реагирующих на свет. Для экспрессии каналов используются методы генной инженерии, а для последующей активации или ингибирования нейронов и нейросетей используются лазеры, оптоволокно и другая оптическая аппаратура. Оптогенетика появилась в 2005 году, а первым использованным опсином стал канальный родопсин 2 (channelrhodopsin-2, ChR2) [1].
За последние 10 лет метод оптогенетики стал часто использоваться в нейробиологии для изучения того, как конкретные типы клеток влияют на функционирование и состояние головного мозга в целом. Последние методы быстро совершенствуются, отчасти потому что оптогенетика индуцировала интерес к развитию нейротехнологий [2]. Экзогенные гены, кодирующие светочувствительные белки, экспрессируются в клетках, а свет используется для модуляции клеточных реакций. Светочувствительные белки встречаются в природе или могут быть получены путем химической модификации [3]..

Рисунок 1 | Мышь с оптродом, вставленным для стимуляции прилежащего ядра [4]
Синий свет попадает на оптрод через оптическое волокно, связывающее лазерный диод и свободно движущуюся мышь. Изображение предоставлено K. Deisseroth.
Методы модуляции мембранного потенциала
Одно из наиболее распространенных применений оптогенетики — изменение мембранного потенциала возбудимых клеток. В нейронах деполяризация мембраны приводит к возникновению электрических сигналов, а гиперполяризация — к их прекращению. Управление этими процессами позволяет нейробиологам изучить, как нейроны функционально связаны друг с другом и каким образом нейронные сети контролируют поведение. Вследствие экзогенной экспрессии активированных светом белков, которые изменяют мембранный потенциал в нейронах, свет может быть использован в качестве «переключателя». Один из подходов заключается в использовании химически модифицированных лигандов, которые активируются светом и связью с экзогенными рецепторами, которые в свою очередь генетически вводятся в конкретные нейроны. Лиганды также могут быть связаны с самими рецепторами через светочувствительное соединение, которое действует как оптический переключатель. В обоих случаях светочувствительный свободный или связанный лиганд должен быть введен в клетки или ткани, чтобы сделать их светочувствительными [3].
Также можно использовать встречающиеся в природе гены, кодирующие светочувствительные белки, такие как опсины. Опсины ковалентно связаны с хромофором, который при поглощении света изомеризуется (например, из транс- в цис-конфигурацию), активируя белок. Примечательно, что эти соединения присутствуют в большинстве клеток позвоночных в достаточном количестве, таким образом исключая необходимость введения экзогенной молекулы. Первая генетически закодированная система для оптического контроля в нейронах млекопитающих с использованием опсинов была создана путем экзогенной экспрессии системы с тремя генами из Drosophila melanogaster. Нейроны, экспрессирующие эти белки, реагировали на свет волнами деполяризации и резким скачком напряжения в течение нескольких секунд. Первый из этих нейронных переключателей — каналородопсин-2 (ChR2). Экспрессируясь в нейроне и подвергаясь воздействию синего света, этот неселективный катионный канал немедленно деполяризует нейрон и вызывает пик напряжения. Было разработано несколько вариантов ChR2. Последние варианты (названные eNpHR2.0 и eNpHR3.0) демонстрируют большее сродство к мембране клеток млекопитающих. Оптогенетика быстро развивается одновременно с развитием технологий, которые направлены на выявление новых светочувствительных белков в разных нишах. Следует отметить, что некоторые из этих инструментов могут использоваться в комбинации, чтобы сделать возможным мультимодальный контроль нейронной активности [3]..
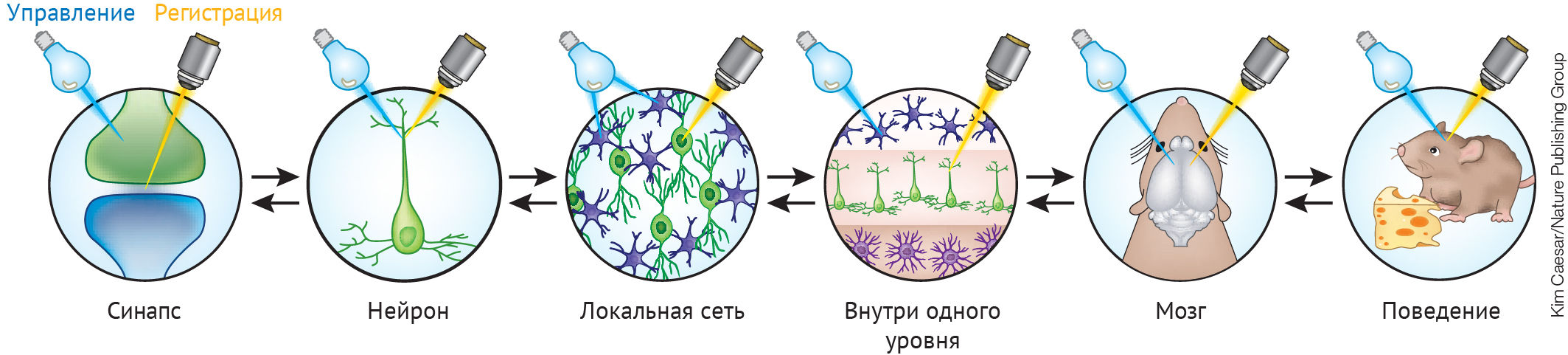
Рисунок 2 | Оптогенетика может применяться на всех уровнях функционирования мозга [6]
В различных технологиях используются оптогенетические датчики для считывания активности клеток и управления их активностью. Специфичность может быть достигнута либо путем нацеливания датчика на соответствующие клеточные компартменты или элементы нейронной сети, либо путем направления света на эти элементы. Возможность применять оптогенетику на разных уровнях функционирования нервной системы позволяет делать выводы о взаимодействии различных отделов мозга между собой. Рисунок адаптирован из Hegemann, P. & Sigrist, S. (ред.), Optogenetics. Де Грюйтер, 2013, с. 109, рис. 10.1.
Преимущества использования света очевидны: свет неинвазивен, может быть нацелен с высокой пространственной и временной точностью, можно одновременно использовать несколько длин волн и воздействовать сразу на несколько участков головного мозга, что позволяет установить присутствие и/или активность конкретных молекул. Методы работы с оптическим считыванием и манипуляции с конкретными нейронами стали доступны недавно. Они основаны на работе с белками, которые могут быть нацелены на определенные типы нейронов. Термин «оптогенетика» сочетает комбинацию генетического и оптического нацеливания. Оптогенетика помогла связать типы клеток и механизмы их работы с возникающими явлениями на разных уровнях нейронных сетей. Но ученые все еще не могут объяснить каждое ощущение, паттерн поведения, эмоцию, движение или познавательный процесс. По мере того, как развиваются технологии, продолжается работа по изучению новых путей взаимодействия клеток. [5].
Последующие эксперименты в области оптогенетики, особенно проводимые с использованием новых технологий, могут реализовать мечту о полном понимании нейронных связей с точностью до одной клетки. Например, во многих оптогенетических исследованиях активировали или ингибировали как нейроны по отдельности, так и целые сети. Конечно, в мозге даже смежные нейроны одного и того же типа могут иметь очень разные модели активности. В последнее время такие инструменты, как пространственные модуляторы света, стали все более широко использоваться в нейронауке, что открывает возможности высокоточного нацеливания. Такое усовершенствование технологии дает надежду на возможность индивидуального контроля отдельных клеток в нейронных сетях [2].
Источники:
- Boyden E. S. et al. Millisecond-timescale, genetically targeted optical control of neural activity //Nature neuroscience. – 2005. – Т. 8. – №. 9. – С. 1263.
- Boyden E. S. Optogenetics and the future of neuroscience //Nature neuroscience. – 2015. – Т. 18. – №. 9. – С. 1200.
- Pastrana E. Optogenetics: controlling cell function with light //Nature Methods. – 2010. – Т. 8. – №. 1. – С. 24.
- Peng W. Dawn on the mice //Nature Methods. – 2009. – Т. 6. – №. 5. – С. 319.
- H?usser M. Optogenetics: the age of light //Nature methods. – 2014. – Т. 11. – №. 10. – С. 1012
- Hegemann P., Sigrist S. (ed.). Optogenetics. – Walter de Gruyter, 2013.
Источник: medach.pro