R-петли: новый штрих нестабильности генома
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-10-27 04:31

R-петли представляют собой особые структурные конформации нуклеиновых кислот, которые образуются при гибридизации РНК с комплементарной цепью двухцепочечной ДНК. В результате вытесняется одна из исходных цепей ДНК в области гибридизации по типу петли.
Впервые этот феномен был описан у прокариот более 20 лет назад [1]. Долгое время R-петли рассматривались как побочный продукт транскрипции, не имеющий значительных эффектов и, соответственно, не представляющий особого интереса. Однако развитие геномики и транскриптомики с совершенствованием технических возможностей позволили по-новому взглянуть на забытые области науки. В течение последнего десятилетия все большее число исследований выявили новые особенности строения и функций R-петель в ходе транскрипции (рис. 1) [2]. Будучи ранее «теневыми» структурами со смутным и неясным значением, R-петли все больше обнаруживают свою биологическую и клиническую ценность..
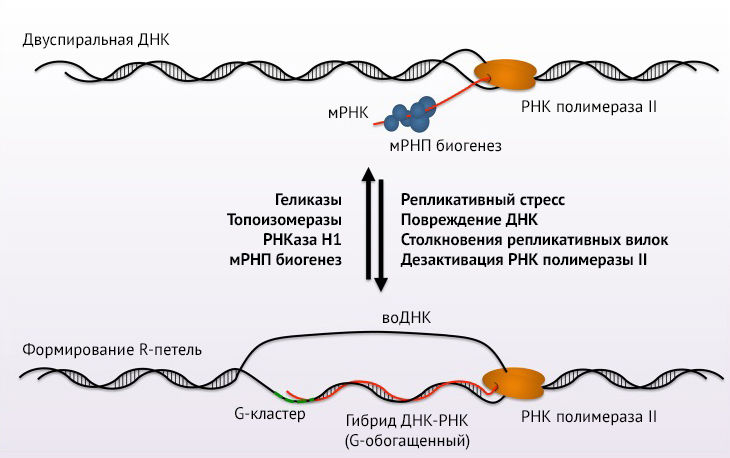
Рисунок 1 | Модель R-петли
Геномное картирование R-петель в клеточных линиях человека, мыши и дрожжей с помощью иммунопреципитации ДНК/РНК с последующим высокопроизводительным секвенированием (DRIP-seq) помогло понять, как и где они образуются. Обнаружено, что R-петли — весьма крупные комплексы, которые занимают до 5 % генома млекопитающих и 8 % генома почкующихся дрожжей [3]. «Территориально» петли предпочитают GC-богатые регионы, такие как типичные промоторы и 3'-концевые области, чтобы защитить эти области от метилирования ДНК. В участках терминации генов они способствуют более эффективной терминации транскрипции.
Многочисленные связи между формированием R-петель и состоянием геномной стабильности стали фундаментом для их роли в развитии патологических состояний. Когда при гибридизация РНК с ДНК-матрицей образуется петля, одинокая вытесненная одноцепочечная ДНК становится крайне уязвимой и нестабильной, повышается ее чувствительность к различным нуклеазам (например, индуцированная активацией цитидин-деаминаза). Это служит фундаментом для формирования двухцепочечных разрывов молекулы ДНК и гипермутаций таких регионов.
Клетки используют разнообразные механизмы для регулирования образования R-петель. К «противопетлевой» системе относится РНКаза Н, которая специфически расщепляет РНК-фрагмент у гибридов РНК-ДНК. Также геликазы, такие как сенатаксин, «разматывают» гибриды РНК-ДНК. Топоизомеры регулируют суперспирализацию (суперскручивание) ДНК: суперспиральная структура способствует компактной упаковке огромной молекулы. Потеря активности топоизомеразы I и ее релаксирующего действия на молекулу приводит к усилению отрицательной (против часовой стрелки) суперспирализации, что способствует раскручиванию двойной спирали. Это может привести к остановке как РНК-полимеразы, так и репликационных вилок, что приведет к разрывам цепей. Заблокированные репликационные вилки являются нестабильными структурами, склонными к рекомбинации. Все эти факторы усиливают нестабильность генома.
Увеличение числа нуклеотидных повторов (экспансия) в нестабильных участках генома способна приводить к различным нарушениям, таким как ингибирование транскрипции и экспрессия токсичных РНК, токсичных полиглутаминовых белков. Значительное количество геноспецифических нуклеотидных экспансий было ассоциировано с возникновением R-петель. Также репликационный стресс и нестабильность генома — фундамент для канцерогенеза. Наиболее вероятно, что этот механизм реализуется при аберрациях в генах репарации ДНК, например, генах-супрессорах BRCA 1 и 2, ответственных за гомологичную репарацию двунитевых разрывов ДНК. Наличие стабильной структуры R-петли позволяет поддерживать открытую локальную конформацию хроматина и усиливает связывание транскрипционного фактора со смещенной одноцепочечной цепью ДНК, что повышает экспрессию виментина (табл.1) [5-7]..
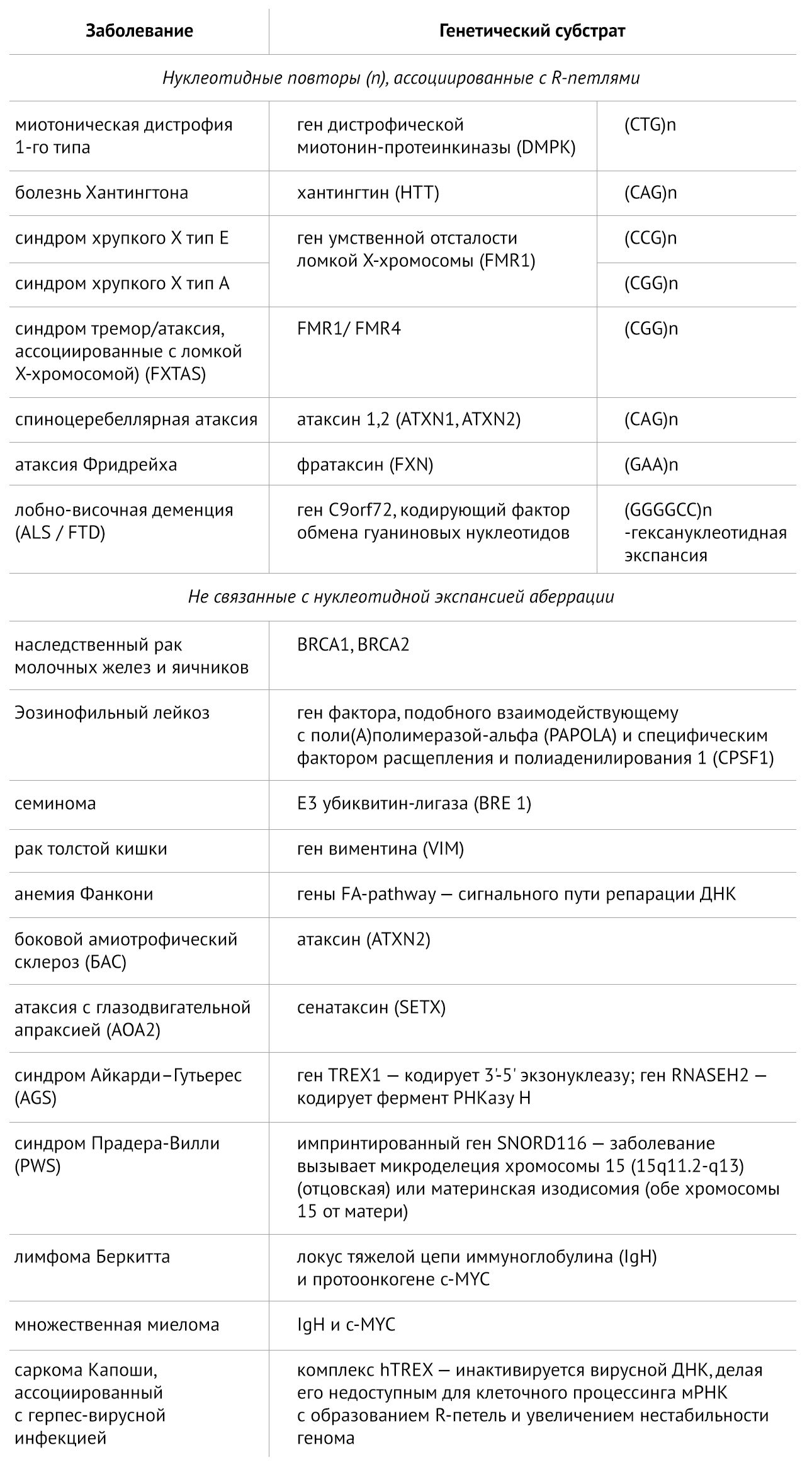
Таблица 1 | Заболевания, ассоциированные с нарушением баланса R-петель [5-7]
*Импринтированный ген — уровень экспрессии генетического материала зависит от материнского или отцовского происхождения аллели (например, материнская аллель экспрессируется, отцовская — нет, так как импринтирована) [7].
Молекулярная биология превращается в мощный инструмент медицинской науки. Помимо генома, все более доступны исследования транскриптома и их взаимосвязи. R-петли стали одним из пересмотренных факторов в геномной нестабильности. Множество тайн еще неразгаданы, а каждая новая степень в понимании порождает более глубокие вопросы. На сегодняшний момент все описанные R-петли являются котранскрипционными и, следовательно, образуются в цис-положении. R-петли, образующиеся в транс-положении, вдали от места их транскрипции, были описаны у дрожжей [8]. Возможность транс-положения R-петель и в геноме человека позволит расширить представление об их регуляторных функциях. Также увеличится спектр заболеваний, в патогенез которых вовлечены эти структуры. Кроме того, идентификация молекул-модуляторов R-петель может найти применение в диагностике и терапии таких нозологий.
Источники:
- Drolet M., Bi X., Liu L.F. Hypernegative supercoiling of the DNA template during transcription elongation in vitro. J Biol Chem. 1994; 269(3):2068-7.
- Sanz L.A.et al. Prevalent, Dynamic, and Conserved R-Loop Structures Associate with Specific Epigenomic Signatures in Mammals.Mol Cell. 2016; 63(1):167-78.
- Allison D.F., Wang G.G. R-loops: formation, function, and relevance to cell stress. Cell Stress. 2019;3(2):38–46.
- Chakraborty P., Huang J.T.J., Hiom K. DHX9 helicase promotes R-loop formation in cells with impaired RNA splicing. Nat Commun. 2018;9(1):4346.
- Richard Р., Manley J.L. R Loops and Links to Human Disease. J Mol Biol. 2017;429(21):3168–3180.
- Toubiana S., Selig S. DNA:RNA hybrids at telomeres — when it is better to be out of the (R) loop. FEBS J. 2018;285(14):2552-2566.
- Garc?a-Muse Т.Aguilera А.R Loops: From Physiological to Pathological Roles.Cell.2019; ISSN 0092-8674.
- Wahba L., Gore S.K., Koshland D. The homologous recombination machinery modulates the formation of RNA–DNA hybrids and associated chromosome instability. eLife. 2013;2:e00505.
Источник: medach.pro