Молекулярно-генетические корреляты утомления
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-09-14 03:19

Утомление является сложным процессом, отражающимся на многих функциональных системах организма, соответственно развитие утомления сопровождается изменением целого комплекса показателей, включающих в себя как субъективные, так и поведенческие, физиологические и психофизиологические [37; 44; 18].
Изменение субъективных показателей обычно определяется с помощью тестов и опросников, в которых испытуемые отмечают свое субъективное состояние до утомления и после. Множество исследований показало, что утомление значимо отражается на субъективном состоянии человека: снижается активность, ухудшается самочувствие [68]; уменьшаются энергичность, спокойствие и возрастает усталость [44; 28; 20].
При исследовании поведенческих характеристик утомления достаточно часто используются показатели времени реакции. Во многих исследованиях доказано, что после длительной когнитивной нагрузки, например решения арифметических задач, наблюдается значимое увеличение простой зрительно-моторной реакции, которое, в свою очередь, сопровождается снижением точности выполнения задания [44; 18; 28]. При этом некоторые авторы обнаружили, что при выполнении реакции выбора после длительной когнитивной нагрузки наблюдается не увеличение времени реакции, а ее снижение и вместе с этим возрастает количество ошибок. Этот эффект был назван «Компромиссом скорости и точности» [69; 67]. Разные исследователи предлагали различные теории объяснения этого феномена. Одной из основных является теория о том, что с увеличением времени выполнения задания, т. е. с возрастанием утомления, происходит смещение отношения между контролируемым ответом на стимул и случайным ответом на него, который по латенции гораздо короче контролируемого [это т.н. ауторитмия — эволюционно самый древний тип адаптивных ответов. Прим.публикатора]. И по мере увеличения утомления это соотношение смещается в сторону случайных ответов [50; 70]. Таким образом, при увеличении утомления происходит уменьшение скорости ответа и возрастание количества ошибок.
Еще одной теорией, объясняющей уменьшение времени реакции выбора после длительной когнитивной нагрузки, является гипотеза о том, что во время выполнения задания у испытуемого постоянно копится информация об уже выполненных заданиях, что позволяет ему быстрее отвечать на стимул, но из-за влияния утомления на когнитивную сферу происходит увеличение количества ошибок [39].
Электроэнцефалографические индикаторы утомления
В психофизиологии в настоящее время активно используются различные методы, такие, например, как многоканальная электроэнцефалография (ЭЭГ), позволяющая не только четко прослеживать динамику биоритмов мозга в разных функциональных состояниях и при выполнении различных задач, но также и локализовать данную активность в различных структурах мозга.
Столь же широко используемый метод вызванных потенциалов (ВП) позволяет прослеживать динамические характеристики ответных реакций мозга на различные задания, например, исследование особенностей внимания или утомления.
Функциональная магнитно-резонансная томография (фМРТ) позволяет определять активность в структурах мозга, задействованных в выполнении той или иной когнитивной деятельности, а также активацию в различных областях мозга при различных функциональных состояниях. Комплексный и интегративный подход к использованию данных методов позволяет получать объективное представление о различных процессах, происходящих в мозге, в том числе и о процессе утомления [28; 3; 42; 45; 31; 29; 59; 65; 63].
Многочисленные исследования, проведенные в области психофизиологии утомления, показали, что различные показатели ЭЭГ коррелируют с параметрами утомления. К таким показателям ЭЭГ можно отнести увеличение мощностей медленных ритмов (тета и альфа), индивидуальный альфа ритм, индекс утомления.
В различных исследованиях было показано, что утомление отражается в увеличении мощности альфа-ритма в теменных и затылочных областях, а также в увеличении мощности тета-ритма в лобных областях [18; 28, 20, 65, 40]. М.А.С. Буксем (M.A.S. Boksem) показал, что мощность тета-ритма после длительной когнитивной нагрузки значимо повышается во фронтальных медиальных отведениях, мощность же нижнего альфа-ритма после утомления была выше в теменных областях, а мощность верхнего альфа-ритма была выше в затылочных регионах [18].
Л.Дж. Трейо (L.J. Trejo) показал, что после трех часов непрерывного решения арифметических задач наблюдается значимое увеличение мощности фронтального тета-ритма и теменного альфа-ритма [28]. C. Лэл (S. Lal) и А. Крейг (A. Craig) обнаружили в своем исследовании на примере имитации ситуации вождения у профессиональных водителей и непрофессионалов в двух независимых сериях, что тета-ритм обладает тенденцией к увеличению при длительной когнитивной нагрузке, а также характеризуется высокой степенью воспроизвдимости [40].
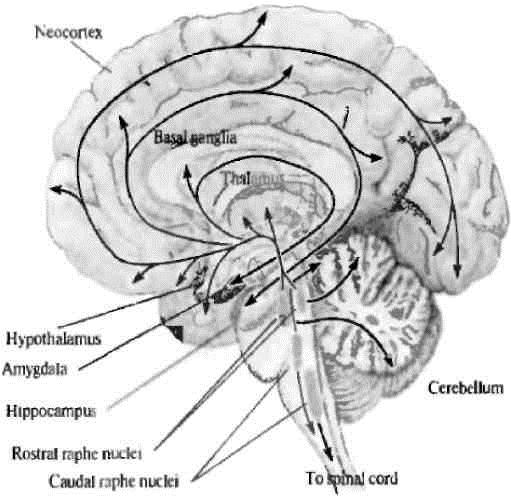
Рис. 1. Серотонинергические пути в мозге человека (Дж.Г. Николлс и др., 2008) [2]
В другом исследовании C. Лэл (S. Lal) и Е. Бекиарис (E. Bekiaris) показали на примере имитации ситуации вождения у опытных водителей, что ситуация, требующая усиленного внимания в течение длительного времени, отражается на ЭЭГ увеличением мощности тета-ритма и уменьшением мощности альфа-ритма. При проведении повторного эксперимента была доказана достоверность этих данных [40]. С. Ченг (S. Cheng) с соавторами показали, что после трех часов непрерывного решения зрительных арифметических задач наблюдается увеличение мощности тета-ритма и уменьшение мощности альфа [20]. Снижение мощности альфа-ритма после решения арифметических задач некоторые ученые объясняют тем, что подобная когнитивная нагрузка требует задействования рабочей памяти, что в свою очередь приводит к подавлению альфа-ритма на ЭЭГ [38].
Некоторые исследователи отмечают уменьшение бета-ритма во фронтальных областях после длительной когнитивной нагрузки [40], хотя некоторые ученые, наоборот, отмечают увеличение мощности бета-ритма во время длительного выполнения когнитивных задач. М.А.С. Буксем (M.A.S. Boksem) отмечает увеличение бета-ритма после длительной когнитивной нагрузки во фронтальных отведениях (F3, F4). [18]. В. Климеш (W. Klimesch) предполагает, что увеличение мощности в нижнем бета-диапазоне связан с увеличением усилий, которые необходимо приложить испытуемому для поддержания высокой концентрации внимания во время выполнения заданий [37].
С. Ченг (S. Cheng) с соавторами исследовали также эффективность использования различных алгоритмов, отражающих соотношение мощностей ритмов ЭЭГ, для определения состояния утомления. В своем исследовании они использовали три индекса: тета/альфа, бета/альфа, (альфа+тета)/бета. В ходе эксперимента было показано, что лучшие результаты по детекции утомления были получены с помощью индекса (альфа+тета)/бета [20].
Б.Т. Джап (B.T. Jap) с соавторами также исследовали различные алгоритмы вычисления индекса утомления: ((тета+альфа)/бета, альфа/бета, (альфа+тета)/ (альфа+бета), тета/бета) [65]. Они, также как и С. Ченг (S. Cheng), показали, что алгоритм (тета+альфа)/бета имеет наибольшее увеличение после длительной когнитивной нагрузки и является наиболее чувствительным к изменениям функционального состояния по сравнению с остальными. Б.Т. Джап (B.T. Jap) отметил, что данный индекс наиболее сильно увеличивается в центральных, теменных и височных областях при закрытых глазах и в теменных и височных областях при открытых глазах. Также Б.Т. Джап (B.T. Jap) показал увеличение дельта и тета-активности во фронтальных, центральных и теменных регионах [65].
Альфа-ритм хорошо видно в состоянии физического и умственного расслабления [7]. На ЭЭГ в спокойном состоянии обычно хорошо видно отдельный пик на частоте альфа-ритма (8–14 Hz). Данный параметр имеет высокую интраиндивидуальную стабильность [62; 21], а также достаточно сильную вариацию между отдельными людьми и изменчивость с возрастом [37]. В исследовании Питерсона было показано, что у взрослого человека среднее значение индивидуального альфа-пика составляет 10.2+/-0.9 Гц [53]. В ряде исследований было показано, что альфа-пик характеризуется увеличением в течение периода жизни с детства до пубертата [30]. У взрослых людей, наоборот, альфа-пик характеризуется уменьшением с возрастом – с 20 до 70 лет его частота уменьшается в среднем с 10,89 Гц до 8,24 Гц [38]. Существуют различные способы вычисления индивидуального альфа-пика. Одним из основных способов является определение частоты, на которой возникает альфа-пик (индивидуальный альфа-пик).
Другим, также часто используемым, способом является нахождение средневзвешенного центра альфа-ритма (индивидуальная частота альфа-ритма) [37; 52]. Для этого способа для каждого шага частоты в диапазоне альфа-ритма (8–14 Гц) подсчитывается максимальное значение мощности, после чего высчитывается средневзвешенное значение мощности в альфа-диапазоне и определяется частота альфа-ритма, на которой наблюдается эта мощность [37]. Первый способ определения пика альфа-ритма является исторически более ранним и состоит в определении частоты, на которой наблюдается максимальная мощность альфа-ритма [7]. Но данный метод плохо работает в тех случаях, когда на ЭЭГ наблюдается не один, а несколько пиков альфа-ритма. В таких случаях обычно используется метод определения средневзвешенного пика.
Различные исследования показывают, что пик альфа-ритма положительно коррелирует с успешностью выполнения когнитивных функций, таких как внимание, память, скоростью протекания информационных процессов [37; 52]. Частота индивидуального альфа-ритма возрастает больше в правом полушарии при выполнении зрительных заданий и больше в левом полушарии при выполнении арифметических заданий [52]. В. Климеш (W. Klimesch) показал, что испытуемые со сниженными мнестическими способностями характеризуются снижением пика альфа-ритма во время выполнения заданий на память, а испытуемые с высокими мнестическими способностями характеризуются стабильностью пика альфа-ритма в различных условиях [38]. Также В. Климеш (W. Klimesch) показал, что испытуемые с высокими мнестическими способностями и высокой скоростью обработки информации характеризуются частотой альфа-пика в среднем на 1 Гц большей по сравнению с контрольной группой [37, 38]. Различные исследования показали, что ряд психических заболеваний также связан со снижением частоты индивидуального альфа-пика – болезнь Альцгеймера, шизофрения, синдром хронического усталости, полушарный инсульт [52].
Молекулярно-генетические корреляты утомления
Многочисленные исследования [43; 44; 46; 47–64] показывают также связь между утомлением и уровнем концентрации некоторых нейромедиаторов. Как правило, к таким нейромедиаторам относятся дофамин и серотонин. Базовый уровень их концентрации зависит от наличия определенных полиморфизмов, определяющих плотность рецепторов к нейромедиатору, скорость его транспортировки или удаления. Р. Меузен (R. Meeusen) показал, что высокая концентрация серотонина ведет к увеличению скорости развития утомления в связи с тем, что серотонин играет важную роль в процессе сна [43]. Повышение же концентрации дофамина и норадреналина ведет к увеличению мотивации и возбуждения [57; 58; 49].
Связь серотонина с утомлением. Серотонин (5-НТ или 5-hydroxytryptamine) играет важную роль в регуляции эмоционального поведения [41; 8] и эмоционального статуса человека [60; 16]. Серотонинeргическая система является одной из важнейших мишеней в лечении таких психических расстройств, как депрессия, тревожность, панические атаки, обсессивно-компульсивный синдром [61].
Серотонинергические нейроны широко распространены в центральной нервной системе, преимущественно они локализованы в ядрах ствола мозга – в ядрах шва [2]. Ядра шва, расположенные в области среднего мозга и моста, иннервируют почти весь мозг и вместе с проекциями из голубого пятна образуют часть восходящей активирующей ретикулярной системы. Серотонинергические нейроны иннервируют обширные области мозга, включающие кору больших полушарий, гиппокамп, бледный шар, миндалину, область гипоталамуса (рис. 1).
Отличительной чертой распределения серотонина в ЦНС является то, что его высвобождает лишь небольшое количество нейронов. Однако они настолько сильно разветвляются, что каждый нейрон посылает тысячи отростков по всей ЦНС. Такая морфология сочетается с физиологической ролью серотонинсодержащих нейронов в модулировании синаптической активности в различных областях ЦНС, в результате чего они регулируют такие глобальные функции, как внимание, пробуждение, цикл «сон–бодрствование» и настроение [4; 2].
Транспортер серотонина (5-HTT) и его связь с утомлением. В настоящее время много работ посвящено исследованию гена серотонинового транспортера (5-НТТ). Переносчик серотонина (5-HT transporter gene, 5-НТТ) состоит из 630 аминокислот и играет важную роль в трансмиссии серотонина в головном мозге, а также во многих периферических тканях. Он удаляет серотонин из синаптической щели и определяет величину и продолжительность сигнала на постсинаптической мембране. После выброса серотонина в синапс транспортер перемещает его в пресинаптический нейрон, где он возвращается в нейромедиаторный пул.
Одним из наиболее изученных полиморфизмов является 5HTTLPR (5-HTT gene-linked polymorphic region). Под генетическим полиморфизмом понимается участок гена, для которого в популяции существует более одного варианта нуклеотидной последовательности. Наиболее часто встречаются однонуклеотидные полиморфизмы (SNP от single nucleotide polymorphism) – замена одного нуклеотида на другой в конкретной точке генома.
В полиморфизме 5HTTLPR обычно выделяют два аллеля – короткий «S» и длинный «L». Короткие и длинные аллели 5-HTTLPR по-разному влияют на транспортер серотонина, они приводят к различиям в мРНК, плотности белка и активности серотонина в головном мозге. При коротком аллеле (S) транспортер серотонина в меньшей степени представлен на пресинаптической мембране, чем при длинном (L). При наличии одной или двух S аллелей транскрипция 5-HTT снижается на 60–80% в головном мозге и на 30–40% в лимфобластах по сравнению с гомозиготой по L аллели [4].
Ряд авторов в свою очередь связывают скорость развития утомления с наличием определенных полиморфизмов гена 5НТТ. В частности, было показано, что наличие полиморфизма S в гене 5НТТ ведет к более быстрому развитию утомления, по сравнению с LL полиморфизмом [43; 24; 66].
Так, Х. Викер (H. Weicker) исследовал, как пароксетин (селективный ингибитор обратного захвата серотонина) влияет на выносливость атлетов, выполняющих тест на велоэргометре до отказа на средней интенсивности. Х. Викер (H. Weicker) показал, что при приеме пароксетина время до наступления истощения на велоэргометре сокращается и ухудшаются показатели эффективности когнитивной деятельности после теста по сравнению с плацебо или без приема пароксетина [66]. В отличие от результатов Х. Викера (H. Weicker), Дж. Барнетт (J.Н. Barnett) показал, что 5НТТ не имеет значимого влияния на префронтальные когнитивные функции [22].
Также показано, что у пациентов с синдромом хронической усталости, по сравнению с нормой, значимо чаще встречаются длинный аллель L в гене 5НТТ [14]. LL полиморфизм сопряжен с более активным транспортом серотонина из синаптической щели, по сравнению с SS- и SL-носителями [4].
Связь дофамина с утомлением. Многие ученые сходятся в том, что дофаминергическая система играет важную роль в формировании когнитивной сферы человека. На рис. 2 представлены основные дофаминергические пути в мозге.
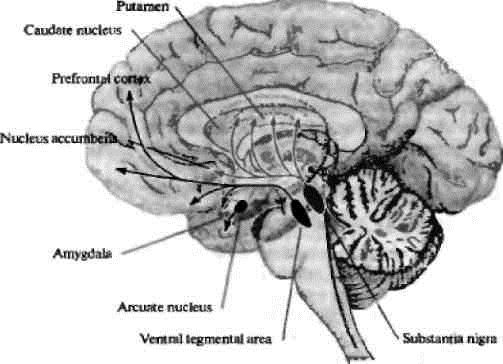
Рис. 2. Дофаминергические пути в мозге человека (Николлс Дж.Г. и др., 2008) [2]
В настоящее время появляется все больше работ, посвященных исследованию генетических основ поведения, важную роль в котором играет дофаминергическая система мозга. Перспективными кандидатами для изучения генетической природы поведения являются гены, кодирующие ключевые белки, участвующие в передаче дофаминергического сигнала, синтезе дофамина, его высвобождения в синаптическую щель. Прекращение воздействия дофамина на постсинаптический нейрон осуществляется путем обратного захвата медиатора белками-переносчиками (DAT) или путем разрушения в межклеточном пространстве ферментами (СОМТ [катехоламинметилтрансфераза], МАО [моноаминоксидаза]).
Исследования последних лет показали, что в мозге млекопитающих обнаружено несколько типов дофаминергических рецепторов. Основными типами дофаминовых рецепторов являются Д1- и Д2-рецепторы. Недавно были открыты также рецепторы ДЗ, Д4 и Д5. Рецепторы дофамина локализованы как на пре-, так и на постсинаптической мембране. Предполагается, что пресинаптические ауторецепторы, принадлежащие к Д2 и Д3 подтипу, могут находиться на соме, дендритах и нервных терминалях. Они принимают участие в регуляции процессов синтеза и высвобождения дофамина во внеклеточное пространство. Для постсинаптических (Д1, Д4, Д5) рецепторов характерна локализация не только в области синаптического контакта, но и в значительном удалении от нее, что говорит о возможном действии медиатора вне синаптических терминалий.
Как уже было отмечено, дофаминовый рецептор второго типа относится к ауторецепторам, принимающим участие в регуляции процессов синтеза и высвобождения дофамина во внеклеточное пространство.
Стимуляция Д2-рецепторов приводит к торможению передачи нервного импульса в симпатических ганглиях, снижению выделения дофамина и норадреналина из симпатических окончаний. Д2-рецептор ингибирует аденилатциклазу и Ca-канал, но активирует K-канал. Д2-подобные рецепторы преобладают в стриатуме — хвостатом ядре и скорлупе, но имеются также в поясной извилине и коре островка [34].
Одним из наиболее хорошо изученных полиморфизмов гена DRD2 является полиморфизм TaqIA. Он определяет плотность рецепторов дофамина второго типа в синаптической щели. У носителей аллеля А1 наблюдается 30–40% уменьшения плотности этих рецепторов, по сравнению с плотностью рецепторов у носителей генотипа А2А2. Аллель А1 встречается в популяции россиян с частотой 0.172, а аллель А2 – 0.828 [6].
В ряде работ было показано, что аллель A1 ассоциирован со снижением уровня дофамина в ЦНС. Также известно, что наличие аллеля A1 ведет к снижению сродства рецепторов к дофамину [56] и к уменьшению плотности дофаминовых рецепторов второго типа в стриатуме [23]. Считается, что стриатум является структурой принятия решения на уровне поведенческих реакций и одним из отделов головного мозга, отвечающих за регуляцию адаптивного поведения.
Рецептор Д2 был исследован на предмет ассоциации с чертами характера. Цай и соавторы обнаружили ассоциацию аллеля А1 с высоким уровнем интеллекта у женщин [27].
Исследования зависимости полиморфизма TaqIA от такой черты поведения, как креативность, показали, что носители аллеля А1 обладают повышенным уровнем индекса вербальной и общей креативности [35]. K. Блум (K. Blum) и соавторы обнаружили ассоциацию аллеля А1 полиморфизма Taq1 с шизоидным или избегающим поведением [15]. Посредством TPQ опросника было показано, что у носителей аллеля А1 наблюдаются повышенные показатели по шкале «поиска новизны» [36].
Катехол-О-метилтрансфераза (СОМТ) и утомление. Два фермента отвечают за катаболизм катехоламинов в мозге: катехол-О-метилтрансфераза (СОМТ) и моноаминоксидаза (МАО). Фермент катехол-О-метилтрансфераза отвечает за разрушение в организме таких нейромедиаторов, как дофамин и норадреналин. Чем активнее работает данный фермент, тем быстрее разлагаются эти нейромедиаторы и тем меньше их количество в мозге и организме в целом.
СОМТ является ключевым ферментом в деградации дофамина в префронтальной коре головного мозга человека. СОМТ деградирует около 15% дофамина в стриатуме и прилежащих ядрах и более 60% во фронтальной коре.
В последние годы было опубликовано несколько исследований, в которых показана связь СОМТ и таких психологических характеристик, как тревожность, экстраверсия, беспокойство, избегание ущерба, поиск новизны, агрессивность.
Учеными было обнаружено, что оптимальное количество дофамина положительно сказывается на рабочей памяти, а слишком малое или избыточное количество дофамина нарушает когнитивные способности.
Было установлено, что для регулировки такого оптимального баланса дофамина задействована внутриклеточная сигнальная молекула – циклический аденозин-монофосфат (сАМР). Также известно, что один из основных дофаминовых путей находится в префронтальной коре, таким образом, наблюдается зависимость когнитивных способностей от содержания дофамина в данной области мозга. Базовое количество дофамина в префронтальной коре связано с вариациями гена СОМТ, кодирующего фермент катехол-О-метилтрансферазу.
Одним из наиболее хорошо изученных полиморфизмов гена СОМТ является Val158Met. У носителей аллеля М наблюдается снижение активности фермента на 40% (Chen, 2004). Гетерозигота имеет средний уровень активности. Частота встречаемости аллеля M варьирует в различных популяциях от 0.01 до 0.62, а для популяции русских приблизительно равна 0.5 [51].
Полиморфизм Val158Met COMT широко изучен на предмет ассоциации с агрессивным поведением. Было проведено небольшое исследование социально опасного поведения пациентов, страдающих шизофренией. Результаты свидетельствуют о проявлении повышенной агрессивности у носителей мутантного М-аллеля [11]. Ассоциация M-аллеля с агрессивностью была подтверждена другим исследованием пациентов с диагнозом шизофрения или шизоидные расстройства, в котором больных, совершивших множественные нападения, сравнивали с мирными пациентами [12].
Вышеописанные исследования проведены на пациентах, страдающих шизоидными расстройствами, что осложняет проекцию выводов на здоровых людей. Так, в исследовании Куликовой и соавторов [1] были подтверждены данные Г. Джонса (G. Jones) и соавторов [10], обнаруживших, что повышенная физическая агрессия, направленная на окружающих, ассоциирована с генотипом VV. Также ранее в исследовании М. Рейтера (M. Reuter) и Дж. Хеннига (J. Hennig) [35] было обнаружено, что носители VV обладают более высоким уровнем экстраверсии, чем носители M-аллеля.
Дж.Д. Соломон (J.D. Salamone) показал, что дофамин в прилежащем ядре участвует в энергетических затратах поведенческой активации и поддержании высоких темпов работы, таким образом отвечая за функции, за которые ответственна область перекрытия двигательных и мотивационных процессов [49]. М.М. Лорист (M.M. Lorist) и М.А.С. Буксем (M.A.S. Boksem) также показали, что испытуемые с недостатком дофамина в передней поясной извилине и полосатом теле испытывают более сильное умственное утомление после непрерывного выполнения когнитивных заданий в течение двух часов, по сравнению с испытуемыми с нормальным уровнем дофамина [42].
Выводы
Из представленного обзора мы можем сделать несколько выводов, касающихся современного состояния научных исследований по утомлению, а также еще нерешенных задач в данной области.
Мы видим, что в настоящее время данная проблема является весьма актуальной и требующей использования хорошего методологического аппарата, включающего в себя комплексную оценку данного состояния.
Мы видим, что общее направление исследования утомления движется в сторону использования комплексного подхода, учитывающего различные показатели: субъективные, поведенческие, электрофизиологические, молекулярно-генетические.
Однако вместе с этим, даже при использовании целого комплекса параметров, остается целый ряд сложностей, затрудняющих анализ и интерпретацию результатов. К подобного рода проблемам можно отнести неоднозначность и разнонаправленность некоторых электрофизиологических показателей, к примеру, динамики альфа-, бета- и тета-ритмов. Как правило, это связано с тем, что различные исследователи используют различные схемы экспериментов, которые не всегда приводят к развитию состояний утомления, так как пороги его развития у каждого человека индивидуальны и зависят от различных факторов.
Источник: www.socialcompas.com