Анастаз: на грани жизни и смерти
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-07-18 13:10
Теория эволюции, биологические нейронные сети, Психология, изучение сознания человека

«Когда клетки становятся ненужными, они умирают, причем делают это с великим достоинством», — написал Билл Брайсон в «Краткой истории почти всего» [1]. Неизбежность апоптотического каскада с закономерным финалом в виде клеточной смерти долгое время считалась незыблемой, но по мере расширения представлений о клеточной биологии определение клеточной жизни и смерти становится все более гибким.
Прецедентом стало исследование, опубликованное в апреле 2019 года, в котором команда Йельской школы медицины привлекла внимание всего мира к кратковременному восстановлению клеточной активности в мертвых нейронах. Нейробиологи Zvonimir Vrselja с коллегами разработали бесклеточную перфузионную систему на основе гемоглобина BrainEx, которая, уменьшая реперфузионное повреждение, предотвращая отек и набухание клеток и поддерживая их энергетические потребности, способствовала репарации после аноксии.
Исследователи проверяли перфузат на мозговых клеточных культурах, извлеченных из лишенных крови забитых свиней (ex vivo), при комнатной температуре в течение четырех часов после смерти, что делало их совершенно мертвыми по общепринятым стандартам.
После перфузии экспериментальным раствором в течение шести часов многие из этих разрушающихся и, казалось бы, безжизненных клеток головного мозга восстановили — хотя бы временно — часть своей нормальной структуры и метаболической активности (рис. 1). Срезы нервной ткани даже могли проводить электрические сигналы. BrainEx и подобные растворы могут быть перспективными для восстановления мозга после ишемических повреждений различной этиологии [2].
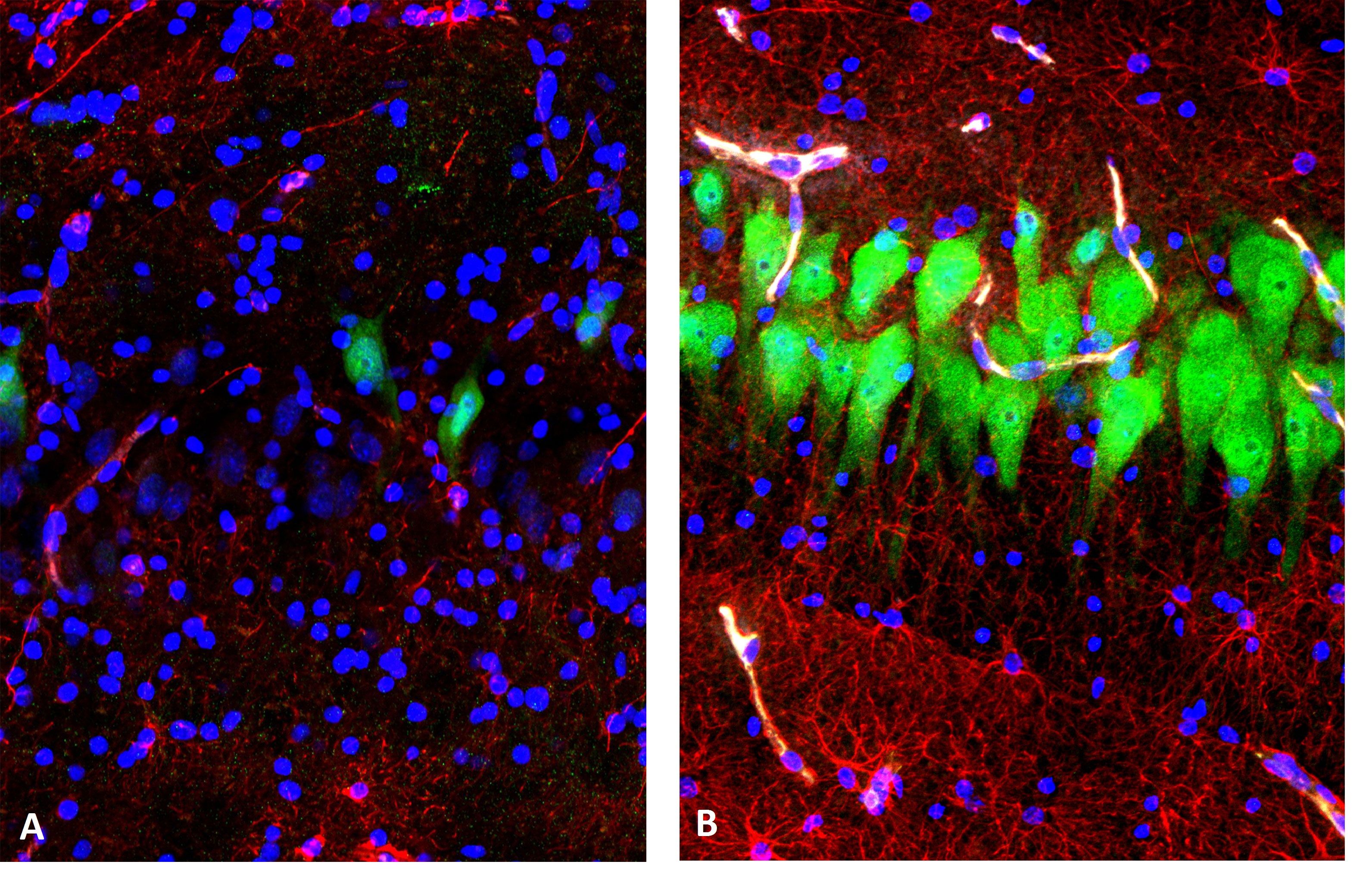
Рисунок 1 | Анализ целостности цитоархитектуры и морфологии нейронов в неокортексе:
Через десять часов после смерти клетки наблюдается выраженный процесс распада клеточных структур в необработанной мозговой ткани (А) и сохранение их морфологии в ткани, обработанной системой BrainEx (В). На этих иммунофлюоресцентных изображениях нейроны — зеленые, астроциты — красные, а ядра клеток – голубые [2].
Апоптоз — упорядоченная и регулируемая форма «самоубийства» клеток, характеризующаяся уникальным морфотипом: при этом процессе происходят фрагментация и дисфункция митохондрий, ядерная конденсация и пикноз цитоплазмы. Дирижером в этой симфонии умирания являются апоптотические протеазы — каспазы, которые служат маркерами апоптотической гибели клеток.
Но так ли однозначна их трагичная функция? Чтобы выяснить это, в 2009 году братья Tang с коллегами разработали и провели достаточно простой и показательный эксперимент. Они погрузили опухолевые клетки человека (рака шейки матки, кожи, печени, молочной железы и предстательной железы) в этанол, чтобы запустить процесс апоптоза. Затем предположительно мертвые клетки промыли и поместили в свежую культуральную среду.
Результаты были шокирующими. К следующему утру некоторые клетки обрели нормальный, «здоровый» вид. Вместо сморщенных клеток они обнаружили клетки с неповрежденными мембранами. Ключевые органеллы, такие как митохондрии, снова функционировали нормально (рис. 2) [3].
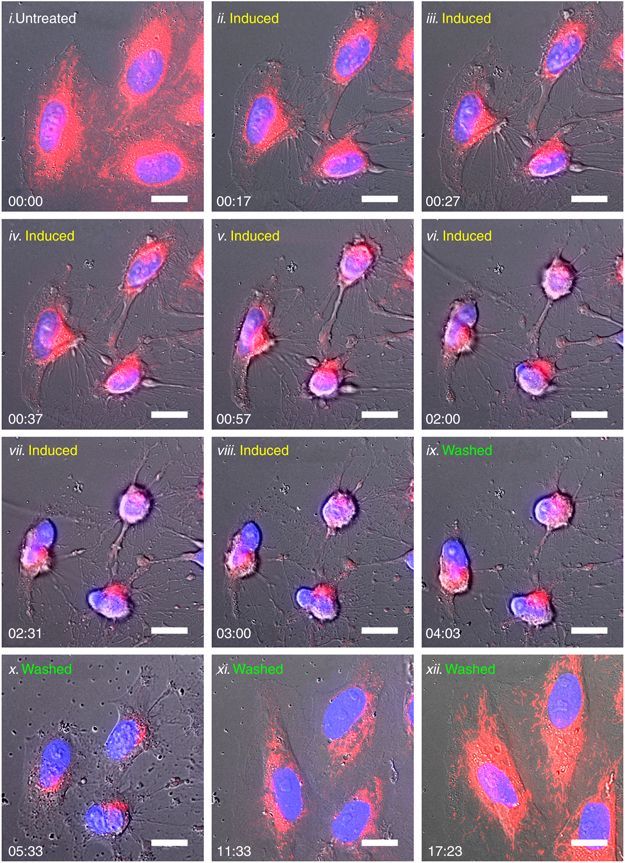
Рисунок 2 | Микроскопия опухолевых клеток в динамике:
Необработанные первичные клетки (i), далее обработанные этанолом на протяжении 3 часов (ii-vii), а затем промытые и дополнительно инкубированные в свежей культуральной среде еще в течение 14,5 часов (ix-xii). Флюоресцентные изображения: митохондрии (красные) и ядра (синие).
На рисунке изображено время в формате часы:минуты [3]; Untreated — первичная ткань; Induced — обработанные этанолом; Washed — промытые.
Ими же в 2012 году был предложен яркий термин анастаз, от греч. «возвращение к жизни, воскрешение» (апоптоз же указывает на нисходящий процесс — дословно «листопад»).
В исследовании 2018 года были изучены здоровые клетки, не имеющие опухолевой трансформации. Для стимулирования репарации оказалось достаточно удаления апоптотических индукторов, что указывает на то, что анастаз — это физиологический процесс [4].
В то же время в культурах первичных клеток печени и фибробластов после «воскрешения» были обнаружены хромосомные нарушения и онкогенная трансформация. Анастаз можно рассматривать как форму индуцированного стрессом мутагенеза или как один из механизмов, объясняющих, почему повторное повреждение увеличивает риск развития злокачественной трансформации в различных тканях. Например, наблюдение, что лица, злоупотребляющие алкоголем, более склонны к раку печени, можно трактовать как опухолевое перерождение гепатоцитов после преодоления вызванного этанолом апоптоза. Закономерно предположить, что пережившие анастаз злокачественные клетки имеют повышенную лекарственную устойчивость, более склонны к миграции и инвазии по сравнению с неанастатическими опухолевыми клонами [5].
Воскрешение клетки в процессе анастаза должно прицельно бить по ключевым моментам апоптотического цикла, восстанавливая утраченные структуры и не допуская прогрессирования каскада смерти (рис. 3) [4].
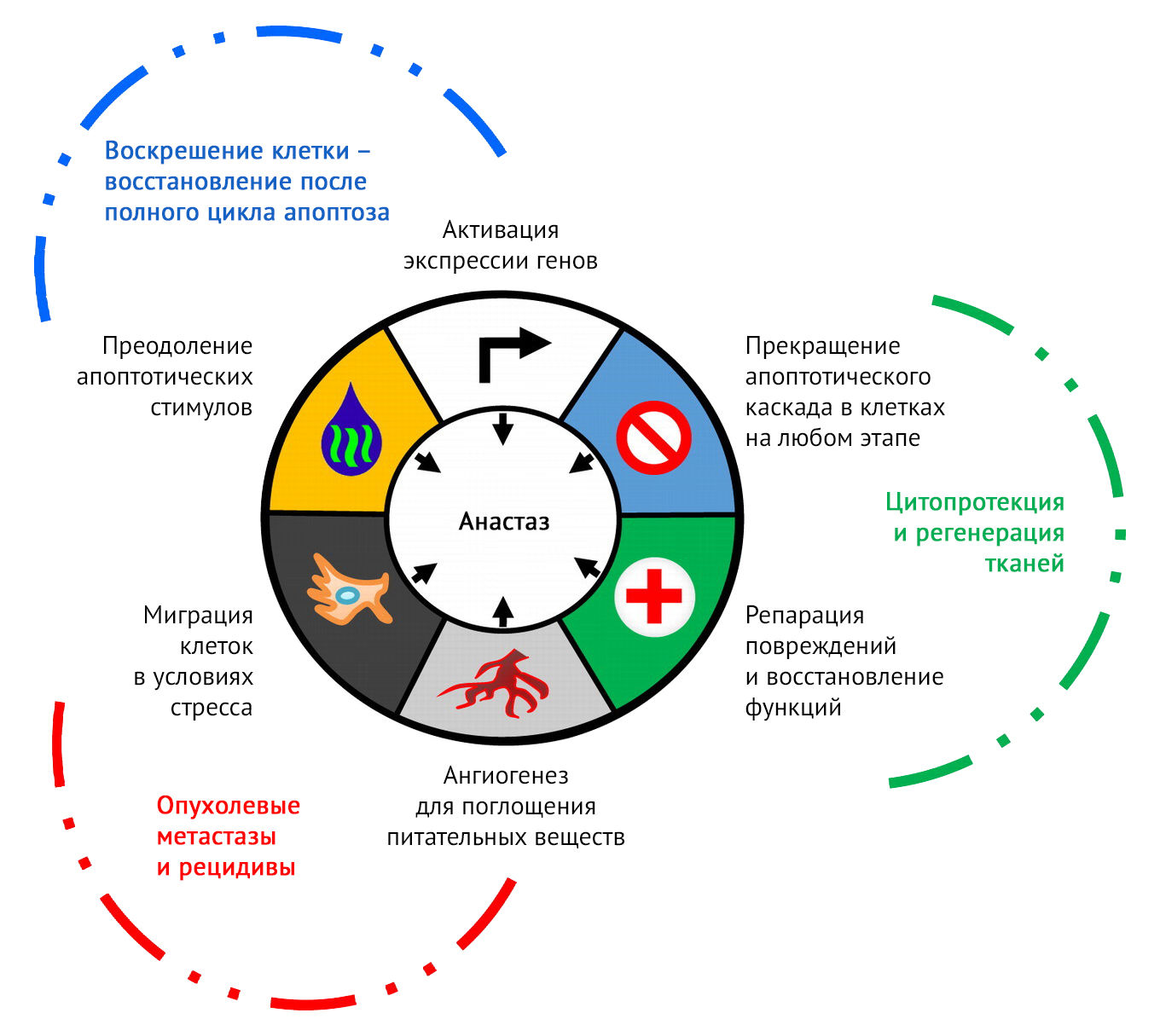
Рисунок 3 | Ключевые признаки анастаза [4].
Первая мишень — митохондрии, так как рост проницаемости их наружных мембран по мере рассеивания энергии за счет изменения разницы потенциалов — важнейший шаг на пути клетки к апоптозу. В случае же неполной митохондриальной проницаемости наружной мембраны (конкретной митохондрии или при вовлечении в процесс меньшей части всех митохондрий клетки) возможно восстановление утраченной структуры. Фрагментированные митохондрии могут сливаться и восстанавливать свою нормальную трубчатую структуру, а с ней — и свою функцию «электростанций» для обеспечения биоэнергетики и метаболической поддержки во время последующего восстановления.
Также каскад анастатических белков, среди которых важную роль играют белки-шапероны теплового шока, например, HSP27 и HSP70, ограничивает митохондриальное высвобождение цитохрома с, взаимодействуя с HSP90 для ингибирования активации каспазы, опосредованной цитохромом с. Белок Atg12 (убиквитин-подобный белок, связанный с аутофагией) способствует быстрой деградации цитозольного цитохрома с в случае, если каспаза еще не была активирована. Экспрессия гемоксигеназы, отмеченная при анастазе, также может способствовать выживанию клеток, удаляя свободные радикалы, образующиеся во время апоптоза.
При апоптозе происходит экстернализация фосфатидилсерина, который действует как рецептор, сигнализирующий голодным фагоцитам «съешь меня». В анастатических клетках наблюдается его преапоптотическое расположение, при котором он ограничен внутренней оболочкой плазматической мембраны (то есть происходит его интернализация) [4].
Так клетки могут «играть» со смертью, восстанавливаясь и возвращая себе утраченную функцию. Смерть — не точка, а процесс, причем, как оказалось, не обязательно необратимый.
Список литературы:
- Bryson, B. A short history of nearly everything. New York: Broadway Books, 2003.
- Vrselja Z. et al. Restoration of brain circulation and cellular functions hours post-mortem. Nature. 2019;568(7752):336-343.
- Tang H.L., Yuen K.L., Tang H.M., Fung M.C. Reversibility of apoptosis in cancer cells. Br J Cancer. 2009;100(1):118–122.
- Tang H.M., Tang H.L. Anastasis: recovery from the brink of cell death [published correction appears in R Soc Open Sci. 2018 Oct 10;5(10):181629]. R Soc Open Sci. 2018;5(9):180442.
- Seervi M., Sumi S., Chandrasekharan A., Sharma A.K., SanthoshKumar T.R. Molecular profiling of anastatic cancer cells: potential role of the nuclear export pathway. Cell Oncol (Dordr). 2019. [Epub ahead of print]
Источник: medach.pro