12 методов в картинках: нейробиология
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-05-16 09:30
Мы — это способ, которым космос познает себя.
Карл Саган
Нейробиология — одна из самых сложных и одновременно захватывающих дух областей сегодняшней науки. Число нейронов в среднем мозге человека приближается к ста миллиардам, а количество связей между ними исчисляется триллионами [1]. Работу этой невероятной суперсистемы можно изучать на самых разнообразных уровнях: структурная и молекулярная биология, цитология и электрофизиология тесно переплетаются друг с другом. Рассмотрение феноменов нейробиологии с одного ракурса зачастую просто не имеет смысла. Все это объясняет уникальный междисциплинарный набор методов, характерный для нейронаук.
Нейромикроскопия
Будет справедливо начать наше повествование с самой ранней и, пожалуй, самой заслуженной группы нейробиологических методов — с нейромикрокопии. Микроскопии посвящена отдельная публикация нашего спецпроекта [2], в этой же статье мы коснемся лишь ее приложений к изучению мозга. В середине 19-го века развитие микроскопии позволило описать тонкое строение практически всех тканей, но нервная ткань все еще оставалась «крепким орешком», упорно не поддаваясь изучению. Ее загадочные клетки практически не подвергались окрашиванию, представляя взорам ученых лишь мутную, аморфную картинку в окуляре микроскопа. Однако все изменилось, когда в 1872 году итальянский цитолог Камилло Гольджи открыл свою знаменитую «черную реакцию» [3]. Пропитка фиксированных срезов мозга слабым раствором нитрата серебра придавала некоторым телам нервных клеток угольно-черный цвет, отлично видимый на светлом фоне. Метод был подробно описан в его монографии 1886 года [4].
Выход этого фундаментального труда произвел эффект разорвавшейся бомбы — с новой силой вспыхнули споры о природе нервной системы. Стороны разделились на два лагеря: одни придерживались мнения о ретикулярном строении нервной ткани, считая, что она представляет собой синцитий из слившихся друг с другом клеток. Им оппонировали сторонники нейрональной теории, уверенные, что нервная ткань состоит из отдельных, пусть и имеющих контакты, клеток-нейронов. Гольджи был горячим сторонником первой гипотезы, однако по иронии судьбы, именно открытый им метод серебрения нейронов помог доказать теорию его оппонентов. И, пожалуй, основной вклад в становлении нейрональной теории строения нервной ткани внес один из главных научных противников Гольджи — испанский исследователь Сантьяго Рамон-и-Кахаль [5]. Его кропотливые наблюдения, а также точные и изящные зарисовки наблюдаемых препаратов (рис. 1) (в юности он чуть было не стал художником) доказали индивидуальность нейронов. Символично, что два непримиримых противника разделили между собой Нобелевскую премию по физиологии и медицине 1906 года с формулировкой: «В знак признания трудов о строении нервной системы». Вкратце основные открытия в сфере нейробиологии обобщены на рисунке 2.
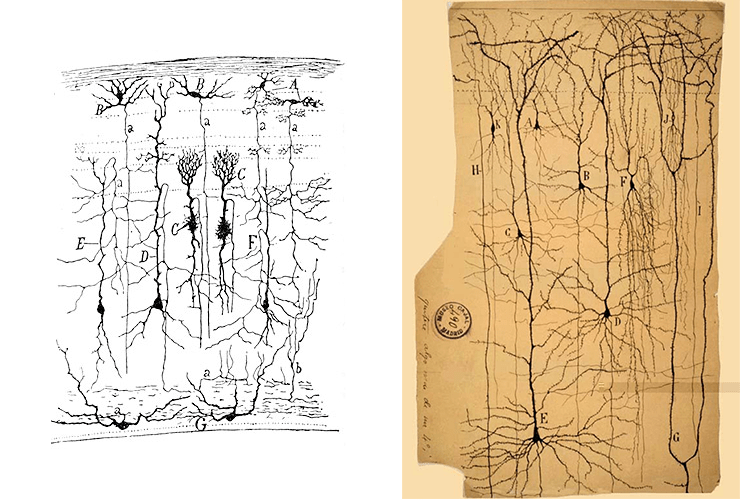
Рисунок 1. Нервные клетки, покрашенные методом серебрения. Рисунки выполнены Рамон-и-Кахалем.
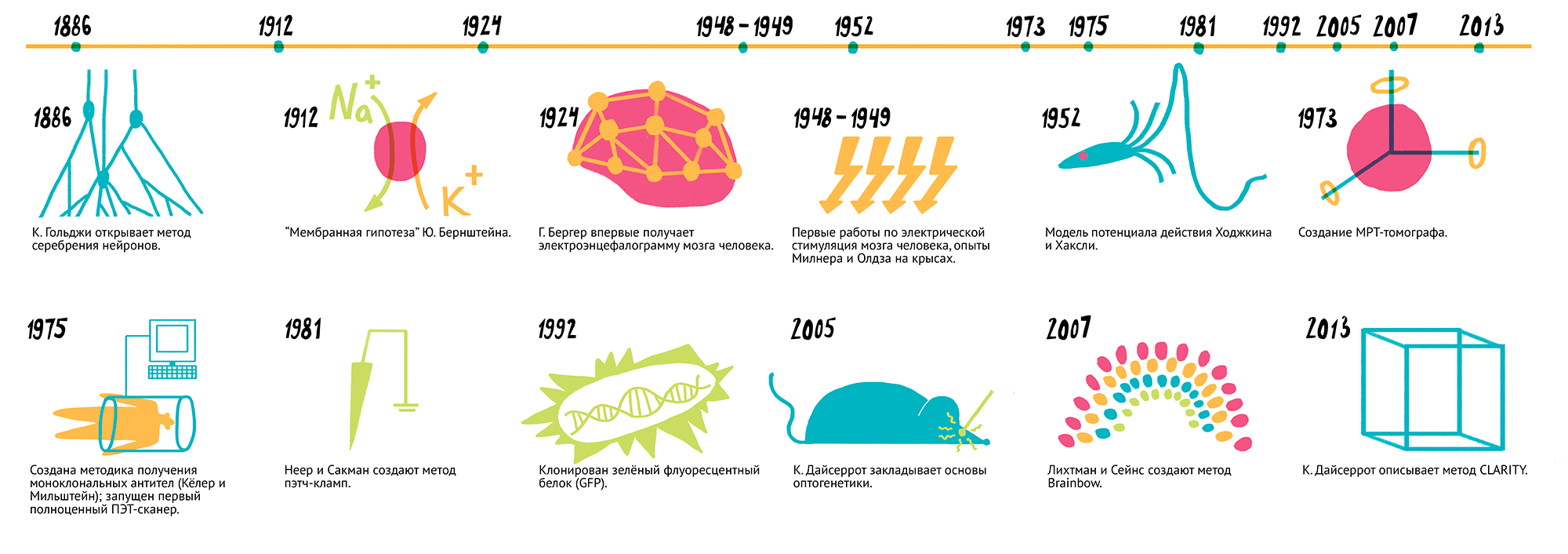
Рисунок 2. Наиболее заметные открытия нейробиологии. 1886 г. — К. Гольджи открывает метод серебрения нейронов. 1912 г. — «Мембранная гипотеза» Ю. Бернштейна. 1924 г. — Г. Бергер впервые получает электроэнцефалограмму мозга человека. 1948–1949 гг. — Первые работы по электрической стимуляция мозга человека, опыты Милнера и Олдза на крысах. 1952 г. — Модель потенциала действия Ходжкина и Хаксли. 1973 г. — Создание МР-томографа. 1975 г. — Создана методика получения моноклональных антител (Келер и Мильштейн); запущен первый полноценный ПЭТ-сканер. 1981 г. — Неер и Сакман создают метод пэтч-кламп. 1992 г. — клонирован зеленый флуоресцентный белок (GFP). 2005 г. — К. Дайсеррот закладывает основы оптогенетики. 2007 г. — Лихтман и Сейнс создают метод Brainbow. 2013 г. — К. Дайсеррот описывает метод CLARITY.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Аффинные окрашивания
Пожалуй, «метод Гольджи» оказался самым долгоживущим методом нейробиологии. Конечно, он давно перестал быть единственным способом окраски нейронов, но все еще активно используется, не потеряв своей актуальности даже спустя без малого полтора столетия [6]! Однако с накоплением знаний о мозге росли и запросы ученых: все больше исследований требовали целевой окраски необходимых клеточных структур, а в идеале — лишь определенных белков. Изредка оказывалось, что красящее вещество само по себе связывается с мишенью. Такая счастливая случайность произошла с флуоресцентным красителем тиофлавином Т, имеющим сродство к ?-амилоидному белку, накапливающемуся в мозге на поздних стадиях болезни Альцгеймера [7], [8]. Понятно, что подобные примеры являются скорее исключением из правил. Но что если связать светящуюся молекулу с каким-нибудь соединением, имеющим исключительное сродство к интересующему нас белку? Такими пунктуальными «курьерами», доставляющими краску точно по адресу, стали нейротоксины и антитела. Дело в том, что многие природные нервнопаралитические токсины — высокоэффективные блокаторы белков-рецепторов, часто имеющие высокое сродство лишь к определенным видам рецепторов-мишеней [9]. Так, например, змеиный ?-бунгаротоксин практически намертво связывается с никотиновыми ацетилхолиновыми рецепторами мышц и мозга, позволяя окрашивать их в срезах и метить радиоактивными изотопами [10], [11].
Стоит сказать, что при всем удобстве меченых токсинов круг их применения ограничен количеством белков-мишеней, что делает их мощным, но все же очень специфичным инструментом. Чего не скажешь об антителах (рис. 3). Разработка технологий получения моноклональных антител [12] к заданным антигенам в середине 1970-х перевернула всю современную биологию и медицину, не обойдя стороной и нейробиологию. Используя их флуоресцентно-меченные производные, исследователи получили реальную возможность специфически покрасить практически любой белок внутри индивидуальных клеток и срезов тканей [13]. Но, как и всегда, несмотря на свою теоретическую универсальность, антитела имеют и множество недостатков, ограничивающих их применение.
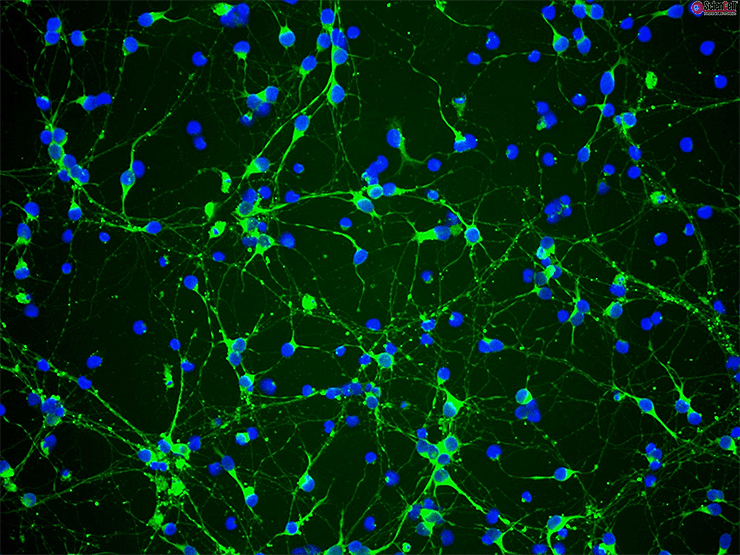
Рисунок 3. Аффинное окрашивание нейрональной культуры антителами.
Само получение антител — очень длительный, трудоемкий и не всегда предсказуемый процесс, поэтому к большинству белков коммерчески доступных антител просто не существует. К тому же огромные макромолекулы антител в принципе не способны пройти через плазматическую мембрану в живую клетку, из-за чего их работа с внутриклеточными белками возможна лишь на фиксированных препаратах. Да и яркость окраски оставляет желать лучшего — отдельные клетки не очень-то и разглядишь. Нейробиологам же с каждым годом все больше и больше хотелось заглянуть внутрь живого, нефиксированного мозга. И тут на помощь пришла молекулярная биология.
Молекулярно-биологические методы нейробиологии
Ген первого флуоресцентного белка — светящегося под ультрафиолетом зеленым цветом GFP — клонировали в 1992 году [14]. К середине 2000-х в распоряжении молекулярных биологов была уже целая палитра разнообразных флуоресцентных белков [15]. В 2008 году за работы с флуоресцентными белками вручили Нобелевскую премию [16]. Совместная экспрессия «разноцветных» флуоресцентных белков в нейронах могла бы дать целый спектр оттенков, видимых даже на нефиксированных препаратах. Метод, воплотивший эти идеи в жизнь, был описан в 2007 году в работе группы сотрудников Гарвардского университета и получил броское название Brainbow [17]. В геном трансгенных мышей вносили кассету с генами нескольких флуоресцентных белков, разделенных сайтами рекомбинации lox. При скрещивании с линией мышей, имеющих ген рекомбиназы Cre, получалось потомство, несущее и ген рекомбиназы, и «многоцветную» кассету. После индукции рекомбиназы гены случайно вырезаются, меняются местами или вообще инвертируются по одинаковым lox-сайтам. При этом в активном состоянии остается лишь ген, оказавшийся ближайшим к единственному промотору системы. Он-то и экспрессируется клеткой, заставляя ее светиться своим собственным цветом. Если в клетке несколько кассет, то случайный выбор активного гена на каждой из них даст внушительный спектр оттенков окраски клетки. Свечение индивидуальных нейронов создает потрясающий фронт работы для конфокальной микроскопии — можно выявить мельчайшие особенности морфологии каждого из них и даже проследить путь индивидуальных аксонов и дендритов. Все вместе это дало возможность для полноценного картирования cтруктуры нейронных цепей мозга [18]. А заодно превратило фотографии гистологических препаратов в настоящее произведение современного искусства (рис. 4)!
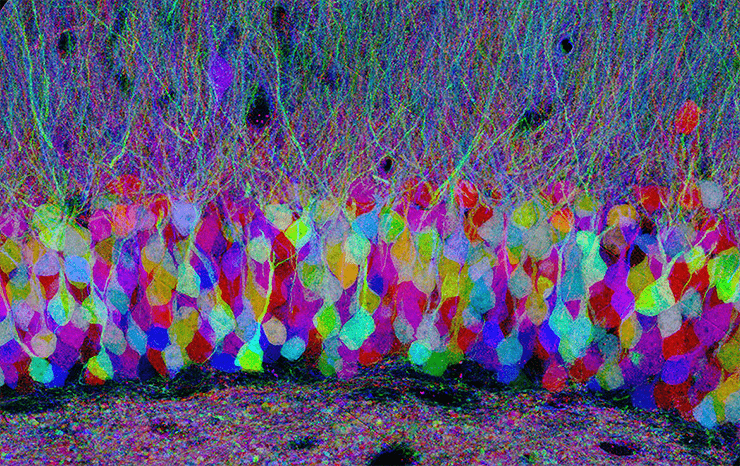
Рисунок 4. Метод Brainbow в действии. Хорошо видны два слоя белого вещества (отростки нейронов) и слой серого вещества (тела нейронов) между ними.
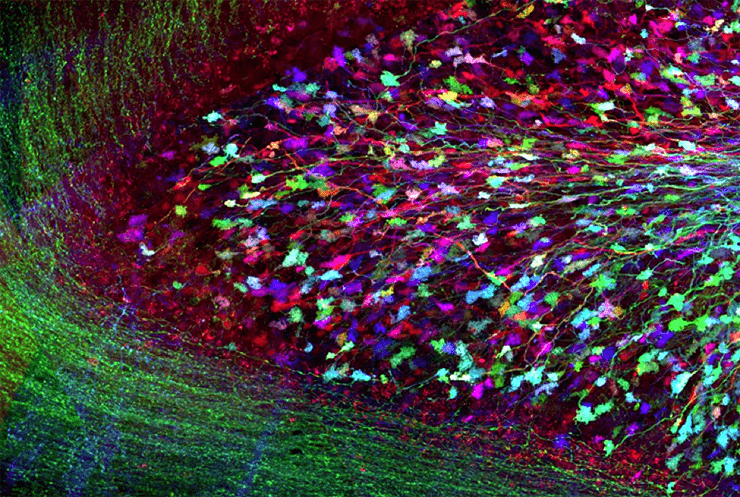
Рисунок 4. Метод Brainbow в действии. Хорошо видны два слоя белого вещества (отростки нейронов) и слой серого вещества (тела нейронов) между ними.
Но даже для такого мощного метода как Brainbow в большинстве случаев мозг мыши избыточно сложный, поэтому метод адаптировали для более простых лабораторных объектов — рыбки Danio rerio и мухи Drosophila melanogaster [19].
Для подкованных читателей «Биомолекулы» не станет откровением, что чаще всего для микроскопических исследований ткань приходится нарезать на тончайшие срезы. Основную массу мозга составляют липиды клеточных оболочек нейронов и глии. Эта плотная масса липидов представляет собой мощный барьер, препятствующий диффузии частиц, используемых для мечения или окрашивания. Да и сама липидная составляющая мозга слабопрозрачна для света — даже двухфотонная лазерная микроскопия, созданная для визуализации глубоких слоев живых тканей, способна заглянуть вглубь мозга лишь на 800 мкм [2], [20]. Словом, львиная доля гистологических работ с нервными тканями до недавнего времени была обречена начинаться с фиксации и изготовления срезов. Именно поэтому нейрофизиологи издавна питают стойкую любовь к простым и, главное, прозрачным модельным объектам, вроде червячков Caenorhabditis elegans или мальков рыбы Danio rerio. Однако недавно появившийся метод CLARITY (рис. 5) способен сделать мозг любой мыши таким же чистым и ясным, как у свежевылупившейся из икринки рыбки данио.

Рисунок 5а. CLARITY: прозрачнее слезы младенца. Метод CLARITY способен сделать мозг мыши практически прозрачным.
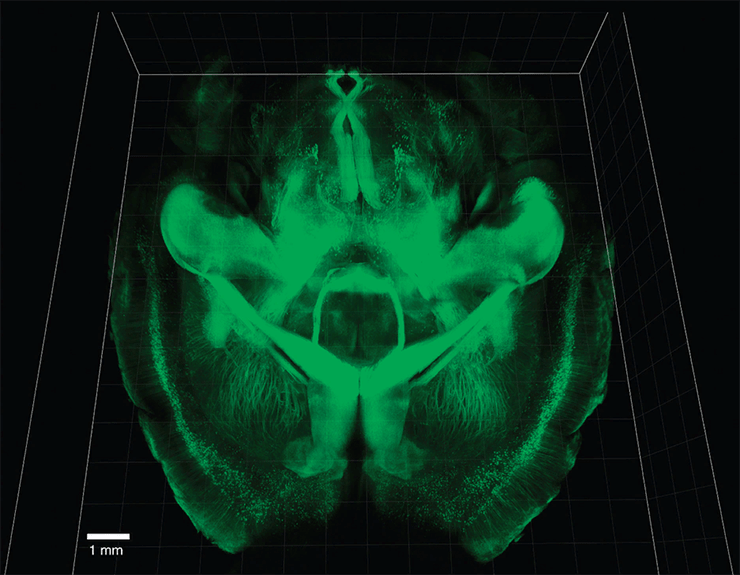
Рисунок 5б. Использование CLARITY совместно с флуоресцентной микроскопией позволяет получить потрясающие изображения.
Одним из «отцов» метода, описанного в статье 2013 года, является создатель оптогенетики (о ней мы еще поговорим) Карл Дейссерот [21]. Суть CLARITY состоит в том, что препарированный мозг фиксируют формальдегидом для «прошивки» и удержания на своих местах белков и нуклеиновых кислот, а также насыщают раствором мономеров геля-носителя, призванного играть роль «матрицы», после чего запускается реакция полимеризации. После нее ткани мозга оказываются буквально слиты с прозрачным гидрофильным акриламидным гелем-носителем. Затем блок с мозгом, а точнее — тканево-гелевым гибридом, — подвергают электрофорезу в присутствии ионного детергента (всем знакомого SDS). В течение нескольких дней движимые электрическим полем мицеллы SDS протискиваются через тканево-гелевый гибрид, «вымывая» из него липиды. На выходе мы получаем уже практически прозрачный блок, пригодный для любого вида флуоресцентной микроскопии. Однофотонная микроскопия уже способна заглядывать в такой препарат на глубину 3,6 мм, а не на 50 мкм, как в случае с нативным «непрозрачным» мозгом.
Электрофизиология
Итак, мы можем смело заявить, что элементарной функциональной единицей нервной системы является нейрон. Мощь современной нейромикроскопии показывает нам, как он выглядит, а иногда даже демонстрирует его связи с другими нейронами. Но она практически ничего не говорит о его работе. Как же нейроны проводят и обрабатывают информацию? Оказалось, что ключевую роль в этом играет электричество. И здесь, начав говорить об электрофизиологии, нам снова придется заглянуть вглубь истории, вернувшись к самым истокам.
В 1840–1860-х годах опыты Германа Гельмгольца и Эмиля Дюбуа-Реймонда наглядно показали, что нервные клетки способны генерировать электрические импульсы. Опираясь на их опыт, а также на собственные работы, в 1912 году их ученик Юлиус Бернштейн опубликовал свою «мембранную гипотезу» [22].
В ее основе лежало предположение о том, что мембрана нервной клетки обладает избирательной проницаемостью для различных ионов. Появляющиеся ионные градиенты, в частности, катионов калия, приводят к тому, что внутренняя часть мембраны получает отрицательный заряд, а внешняя — положительный. С помощью сконструированного им самим прибора — «дифференциального реотома» — Бернштейну удалось измерить величину трансмембранного потенциала покоя [23]. Она составила примерно —60 мВ. Бернштейн предположил, что стимулирование клетки, имеющей подобный заряд мембраны, приводит к открыванию в ее мембране неких «пор», проводящих ионы натрия и хлора [24]. В результате мембрана быстро теряет разность потенциалов, деполяризуясь, а протекающий при этом электрический ток может быть зарегистрирован. Этот ток, сопровождающий мышечное сокращение и работу нервной клетки, Бернштейн назвал «током действия» [22].
Гипотеза Бернштейна во многом оказалась пророческой. Однако настоящий прорыв в электрофизиологии случился лишь спустя сорок лет, вместе с изобретением метода двухэлектродной фиксации потенциала. Он произвел настоящую революцию и, несмотря на свой почтенный возраст, пережив несколько модификаций, используется до сих пор.
Как это часто бывает в науке, к созданию нового метода ученых подтолкнуло нахождение подходящего объекта исследования. В 1936 году открыли гигантские аксоны кальмаров (рис. 6) [25]. Оказалось, что это причудливое эволюционное приобретение головоногих исключительно удобно для препарирования и наложения электродов — диаметр аксонов достигает аж целого 1 мм, по сравнению с типичными несколькими микрометрами. Вскоре Алану Ходжкину и Эндрю Хаксли практически одновременно с Кеннетом Колем и Говардом Кертисом удается создать миниатюрные электроды и ввести их в аксон. Обе группы независимо регистрируют потенциал действия на нейроне и публикуют свои результаты в 1939 и 1940 годах [26], [27]. Наконец, в 1949 году Кеннет Коль [28] и Джордж Мармон [29] описывают метод двухэлектродной фиксации потенциала.
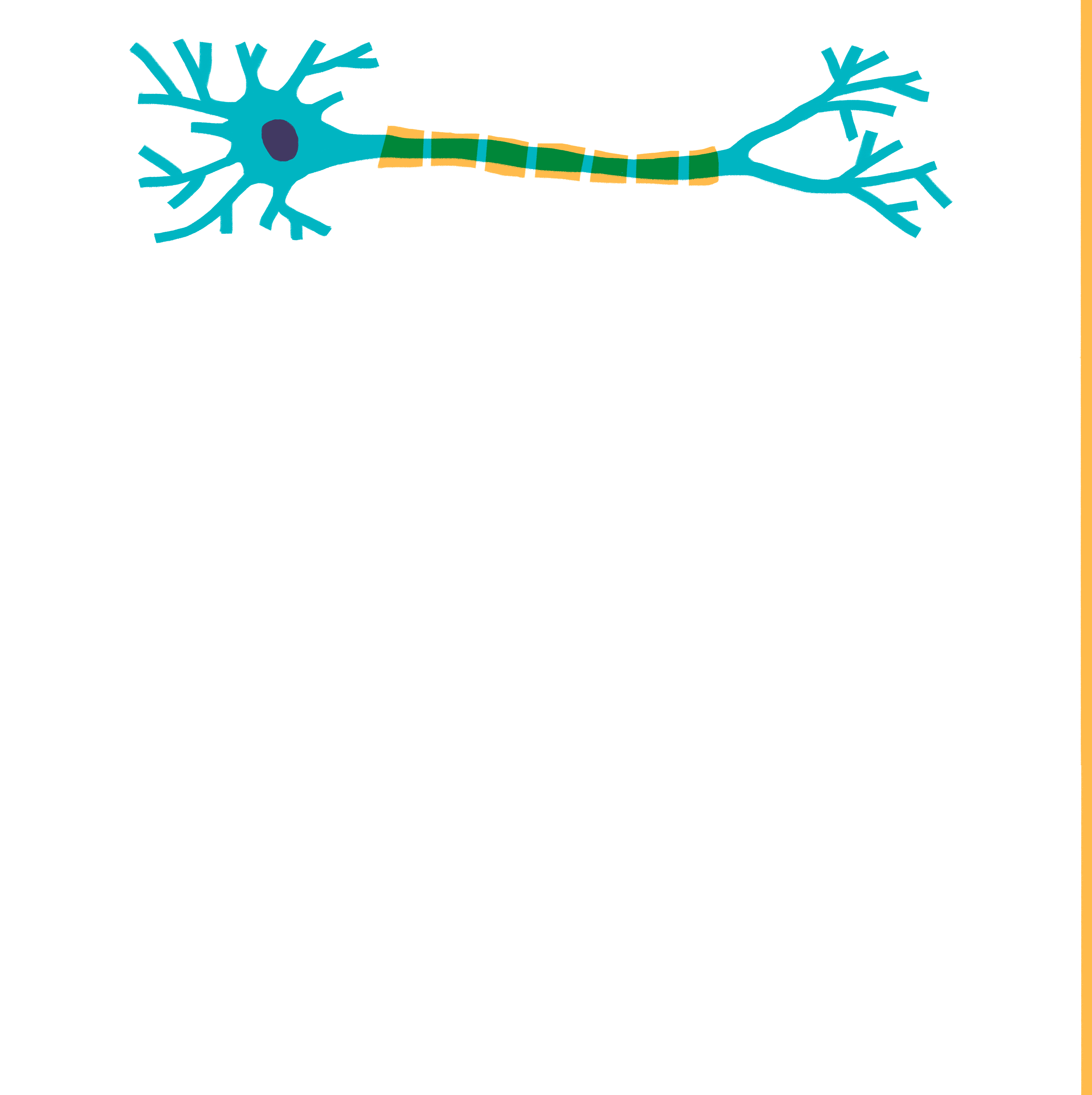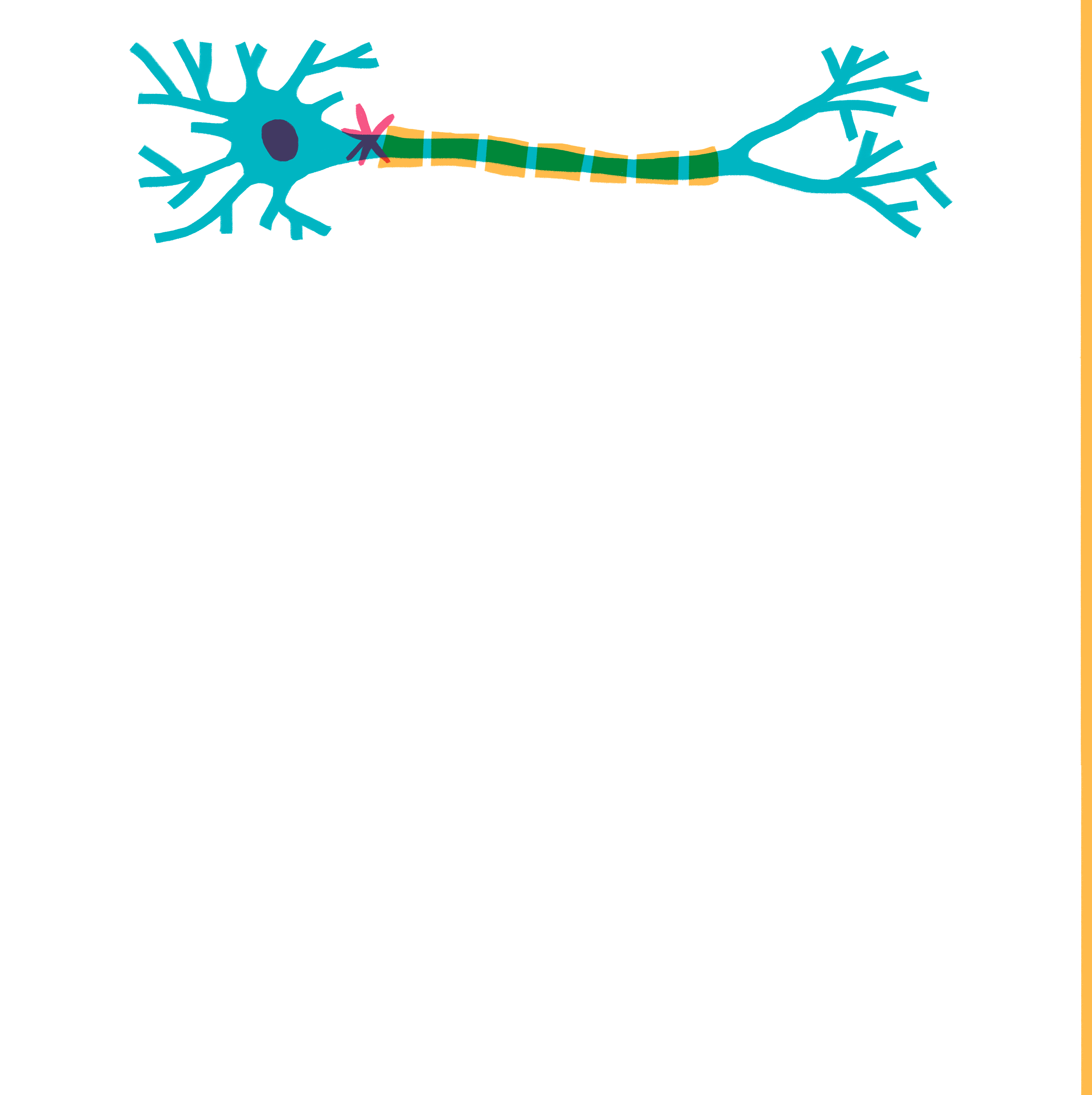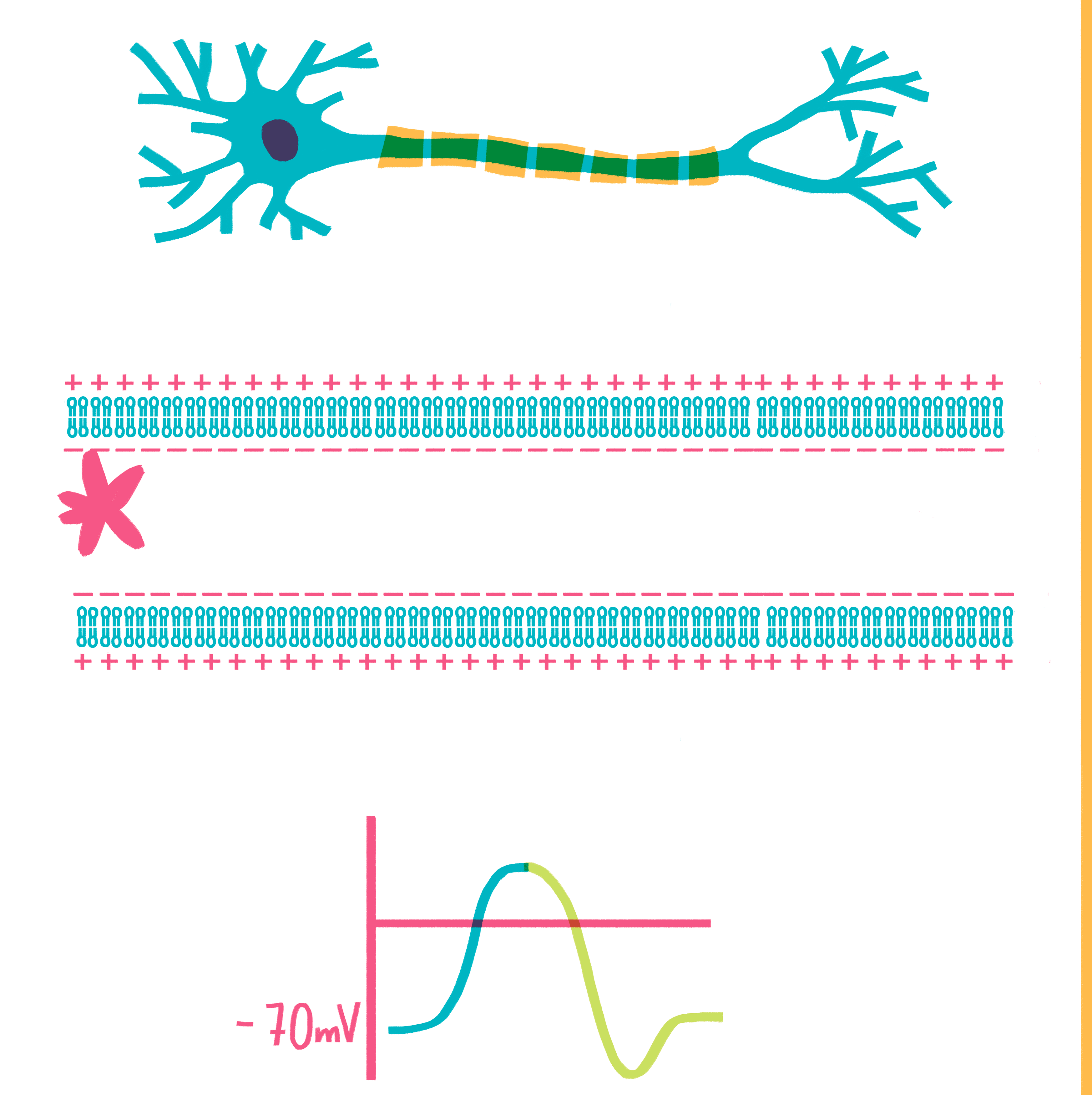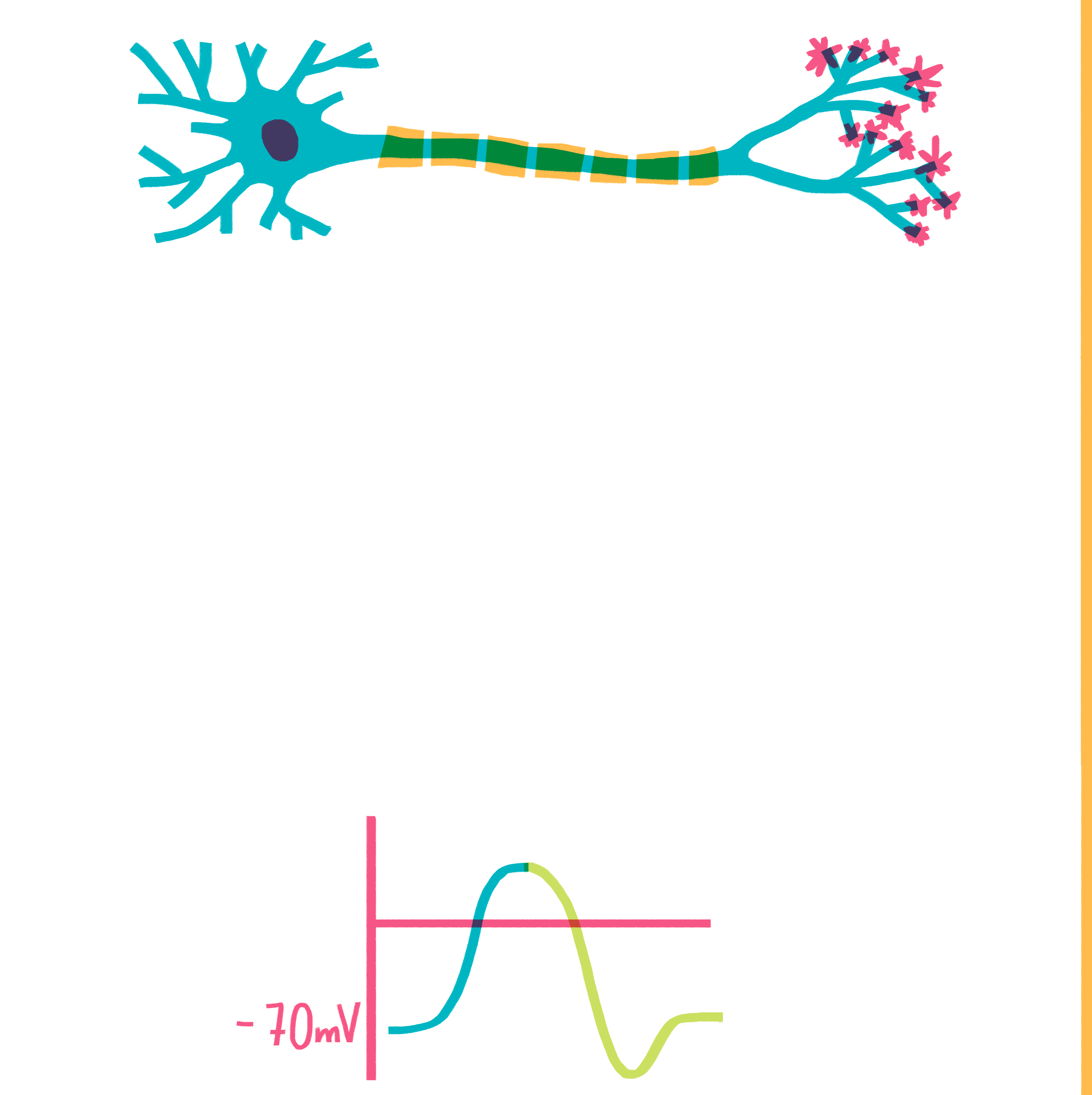
Рисунок 6. Гигантский аксон кальмара. Аксон представляет собой удлиненный отросток нейрона, по которому потенциал действия (ПД) распространяется строго в направлении от тела нейрона. Сам потенциал действия — это изменение мембранного потенциала, волнообразно распространяющееся по аксону. При этом мембранный потенциал на участке мембраны быстро изменяется от значения —70 мВ (примерно соответствует равновесному потенциалу K+) до значения +40 мВ (близко к равновесному потенциалу Na+) и обратно.
Название метода (двухэлектродная фиксация потенциала) отражает его суть — в аксон, лежащий в ванночке с солевым раствором, вводится сразу два электрода. Один из них, работая в паре с внеклеточным электродом сравнения, постоянно измеряет разницу потенциалов на мембране клетки. Второй электрод нужен для введения в клетку тока и поддержания тем самым потенциала на заданном экспериментаторами уровне. Именно поэтому англоязычное название метода часто сокращают до voltage clamp (фиксация потенциала). Как только первый электрод регистрирует изменение разницы потенциалов, электронный блок прибора выдает команду генератору тока на введение поддерживающего импульса через второй электрод. То есть между двумя электродами находится петля отрицательной обратной связи. Такая система отличается высокой стабильностью и позволяет регистрировать ионные токи через мембраны клеток, имеющих самое разное сопротивление. Мощь нового метода проявилась в работах Ходжкина и Хаксли, создавших с его помощью математическую модель потенциала действия нейрона в 1952 году [29]. В 1963 году этот труд принес им Нобелевскую премию по физиологии и медицине.
Метод двухэлектродной записи пережил множество усовершенствований и используется по сей день. Режим фиксации разницы потенциалов на мембране (voltage clamp) идеально подходит для изучения электрофизиологических свойств ионных каналов мембраны. Но многие задачи, например изучение потенциала действия нейрона, требуют записи потенциала при фиксированном значении тока, поэтому большинство современных усилителей позволяет работать еще и в режиме фиксации тока (current clamp). Во многом эти два режима зеркальны: в current clamp на постоянном уровне поддерживается ток, а потенциал записывается, а в voltage clamp — наоборот. Эта, несколько более редкая модификация метода, приобретает актуальность, например, при изучении проведения нервных импульсов по отросткам нейронов.
Внедрение стеклянных хлорсеребряных электродов, заполненных солевым раствором, позволило использовать метод на более мелких объектах. А развитие молекулярной биологии в начале 1970-х вообще подарило электрофизиологам практически универсальную модель для изучения любых ионных каналов. Оказалось, что ооциты (икринки) шпорцевых лягушек Xenopus laevis после введения в них матричной РНК или рекомбинантной плазмидной ДНК с геном нужного ионного канала во многих случаях успешно экспрессируют их на своей мембране [30]. Крупный, отлично видимый невооруженным глазом ооцит позволяет легко ввести в него два стеклянных электрода и уверенно измерять изменение электрофизиологических свойств каналов под воздействием различных токсинов или нейромедиаторов. Ооциты легко выделяются из яичников лягушек, удобны в работе благодаря своему размеру и легко экспрессируют самые разные виды ионных каналов, что делает их практически универсальным модельным объектом электрофизиологов (рис. 7).
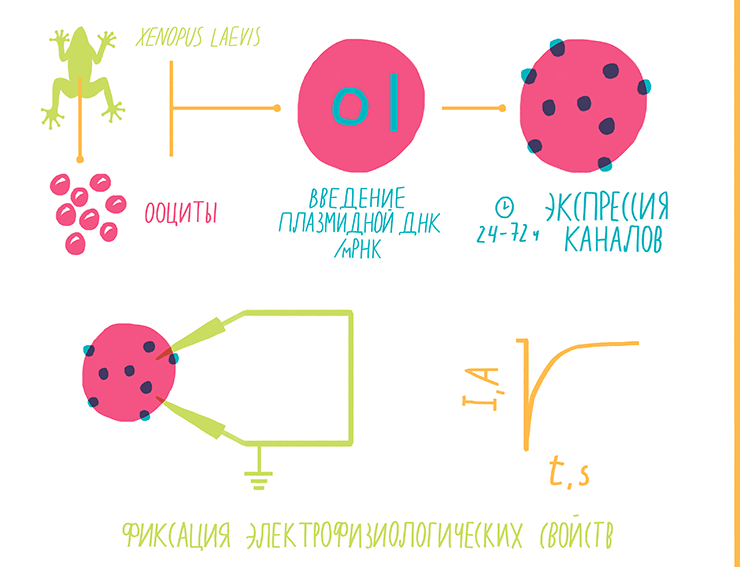
Рисунок 7. Схема работы методом voltage clamp на ооцитах Xenopus laevis. Ген изучаемого ионного канала в виде плазмидной ДНК или мРНК вводится в ооцит с помощью микроинъектора. За следующие несколько дней — обычно 24–72 часа — происходит сборка ионных каналов, и ооцит становится пригоден для введения электродов и изучения специфических ионных токов.
Исследования Ходжкина и Хаксли привели к заключению о критической важности ионных каналов как для генерации потенциала действия, так и для самого появления разности потенциалов на мембране. Однако метод двухэлектродной записи дает представление лишь об усредненной активности многих тысяч ионных каналов на поверхности клетки. Кроме того, крупные стеклянные электроды, используемые в двухэлектродной записи, протыкают плазматическую мембрану насквозь, и не позволяют работать с клетками «традиционных» размеров (рис. 7). Вот если бы можно было использовать один электрод, настолько маленький, чтобы записать ток с одиночного ионного канала? Эта фантазия воплотилась в методе patch clamp — методе локальной фиксации потенциала.
Его предтечей стали опыты Альфреда Стрикхольма, выполненные в начале 1960-х. В них он использовал в качестве микроэлектродов стеклянные пипетки с диаметром отверстия в несколько микрометров (рис. 8).

Рисунок 8. Для изготовления микрокапилляра стеклянная заготовка в виде трубочки нагревается вольфрамовой спиралью и вытягивается струбциной пуллера (микрокузницы).
Прижимая кончик такого капилляра к мембране мышечного волокна, Стрикхольму удалось добиться электрической изоляции участка мембраны, попавшего внутрь кончика пипетки [31]. Всасывание участка мембраны внутрь электрода приводит к разрыву мембраны и соприкосновению цитоплазмы с буфером внутри пипетки. В результате цитоплазма модельной клетки может быть практически полностью замещена раствором контролируемого состава [32]. Одновременно совершенствуются усилители, делая возможной работу методом voltage clamp с одним электродом [33]. Наконец, на рубеже 1970–1980-х годов Эрвин Неер и Берт Сакман описывают метод patch clamp (рис. 9) [34].
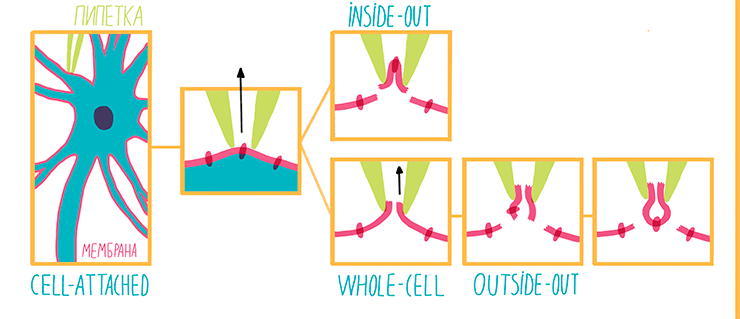
Рисунок 9. Варианты метода пэтч-кламп. Конфигурация cell-attached предполагает создание плотного контакта между стенками микропипетки и мембраной. При этом сопротивление этого контакта достигает гигаомной величины. Cell-attached может быть легко переведен в inside-out при быстром отведении микропипетки от клетки и поднятии ее из буфера в воздух, во время чего участок мембраны вырывается из плазмалеммы. При понижении давления внутри микропипетки мембрана легко рвется, и cell-attached переходит в whole-cell. Важно, что из-за значительной разницы объемов клетки и содержимого микропипетки, буфер, заполняющий пипетку практически полностью, замещает собой цитоплазму клетки. За счет медленного отведения пипетки от клетки, отрыва участков мембраны и их последующего спадания whole-cell может быть преобразован в outside-out.
Одна из главных «фишек» метода patch clamp — использование супертонких стеклянных микроэлектродов, диаметр концевого отверстия которых составляет 1–2 мкм. Если кончик такой пипетки идеально ровный и чистый, то при контакте с клеточной мембраной и понижении давления в нем, он легко присасывается к мембране, формируя контакт с очень высоким электрическим сопротивлением («гигаомный контакт»). Участок мембраны, накрытый таким капилляром, называется patch и имеет площадь меньше 10 мкм2. Это значит, что на нем с большой вероятностью может оказаться единственный ионный канал. Подобная конфигурация называется cell-attache и позволяет записывать ионные токи, проходящие через каналы, накрытые пипеткой.
После того, как был достигнут cell-attache, можно быстро отвести микропипетку от клетки; тогда кусочек мембраны, закрывающий ее конец, оторвется: его внеклеточная часть будет омываться буфером, заполняющим капилляр, а внутриклеточная окажется в растворе, наполняющем ванночку, в которую погружены клетки. Такую пипетку можно перенести в другую ванночку — с буфером, имитирующим цитоплазму клетки, и менять его состав по мере необходимости. Но изменить состав внеклеточного буфера, заполняющего пипетку, в таком случае не так просто — для этого придется брать новую пипетку и новую клетку. Этот вариант метода называется inside-out («внутренняя сторона снаружи»). Им можно изучать, например, потенциал-зависимые ионные каналы и механизмы регуляции их активности со стороны искусственной «цитоплазмы».
Важнейшую роль в нервной системе играют лиганд-управляемые ионные каналы. Эти белки-рецепторы имеют ион-селективную пору, проницаемостью которой можно управлять с помощью веществ — лигандов. Если же мы хотим изучать то, как лиганд-управляемые ионные каналы отвечают на различные лиганды (например, медиаторы или токсины), нам будет удобно использовать конфигурацию whole-cell («вся клетка»). При этом, после того как был достигнут cell-attache, мы еще сильнее понижаем давление в микропипетке, и в результате мембрана внутри нее разрывается. После этого буфер из пипетки частично замещает собой цитоплазму. Добавляя изучаемые вещества в раствор, омывающий клетку, мы легко можем построить кривые ответа рецептора на различные дозы лиганда. Если же мы хотим варьировать состав цитоплазмы модельной клетки, мы можем менять состав внутриклеточного буфера, заполняющего пипетку. Правда при этом для каждого варианта буфера придется использовать новую пипетку и новую клетку.
Наконец, если мы хотим изучать действие внеклеточных лигандов на одиночный лиганд-управляемый ионный канал, нам понадобится конфигурация outside-out («наружная сторона снаружи»). Сначала мы достигаем состояния whole-cell, а затем медленно отводим пипетку. Мембрана тянется вслед за ней, вытягиваясь в трубочку, пока не рвется, образуя маленький пузырек, висящий на кончике пипетки-электрода. В этом случае, так же как в whole-cell, буфер внутри пипетки имитирует цитоплазму, а лиганды рецепторов добавляются во внеклеточный буфер, омывающий кусок мембраны, висящий на капилляре снаружи. Разница в том, что на крохотном, вырванном из клетки участке мембраны, запросто может оказаться единственный ионный канал, ток через который мы и изучим.
Первое, что бросается в глаза, когда знакомишься со всеми вариантами пэтч-клампа, это то, что в них фигурирует лишь один стеклянный электрод-микропипетка и электрод сравнения, незаметно лежащий в ванночке. Как же с помощью единственного электрода удается и поддерживать «командный потенциал» на мембране клетки, и регистрировать его изменения?
В методе patch clamp используются не две пары электродов, как в двухэлектродной записи потенциала (два внутриклеточных и два внеклеточных), а одна пара (рис. 10). При этом электронная начинка усилителя с высокой частотой чередует измерение потенциала клетки и введение в нее ионного тока. То есть один электрод работает сразу за два, сокращая повреждения клетки при измерении. Любопытная особенность patch clamp состоит еще и в том, что в единственной оставшейся паре электродов нельзя однозначно выделить внеклеточный и внутриклеточный. Металлический электрод сравнения погружен в ванночку, в которой находятся клетки. А вот единственный стеклянный электрод, входящий в контакт с клеткой, может работать и как внеклеточный (cell-attache и inside-out), и как внутриклеточный (whole-cell и outside-out).

Рисунок 10. Установка для patch clamp. Микроскопический размер электродов для patch clamp, а также работа с отдельными клетками вынуждают размещать микроэлектроды и ванночку для образца под микроскопом. Сам «пэтч» (контакт микрокапилляр-мембрана) крайне чувствителен к вибрациям, поэтому микроскоп монтируется на антивибрационном столе, крышка которого плавает в потоке сжатого воздуха. Амплитуда токов, регистрируемых прибором, крайне мала, поэтому электроды защищены от электрических наводок ящиком Фарадея.
Метод patch clamp открыл новую эру в электрофизиологии. Ионные каналы перестали быть абстракцией — появилась возможность буквально пощупать их: зарегистрировать ионный ток, проходящие через индивидуальный канал [35]. Параллельное развитие молекулярной биологии привело к настоящему взрыву исследований ионных каналов в 1990-е. Именно в эти годы клонировали и охарактеризовали большинство лиганд-управляемых и потенциал-зависимых ионных каналов. Особенности работы этих белков, да и само их наличие или отсутствие на поверхности клетки, напрямую определяют ее электрофизиологические свойства. Можно сказать, что ионные каналы формируют своеобразный функциональный костяк нашей нервной системы. Именно их работа определяет значения потенциала на мембране в тот или иной момент времени, а значит, и само возникновение нервного импульса. Клонирование и дальнейшее изучение дало ученым ключ к пониманию фундаментальных основ работы нервных клеток.
Нейромодуляция
Если электричество неразрывно связано с работой нервной системы, почему бы не попытаться повлиять на ее работу с помощью электрического тока? Первые попытки сделать это были совершены еще в XIX веке. Экспериментальная техника тех времен была крайне простой: в качестве подопытных обычно выступали собаки или кошки с трепанированным черепом или в исключительных, а от того более интересных, случаях — больные во время нейрохирургических операций. Электрическая стимуляция определенных зон коры мозга (моторной коры, как бы мы сказали сегодня) приводила к сокращениям мышц и движениям конечностей. То есть раздражение различных зон мозга вызывает разные реакции. Этот принцип использовали для составления функциональных карт мозга. Впоследствии эти карты сослужили хорошую службу хирургам.
В 1949 году был предложен метод стереотаксической малоинвазивной хирургии мозга [36]. Его суть состоит в том, что координаты цели в мозге фиксируются по трем координатам с помощью специального прибора, устанавливаемого на голове пациента. После чего необходимый участок мозга может быть разрушен — например, введением через иглу точно рассчитанного количества этанола. Но мозг пациентов отличается по форме и размеру, а значит, требуются дополнительные ориентиры. Как нельзя лучше для поиска таких ориентиров подходит тонкий электрод, с помощью которого можно раздражать структуры мозга и точно определять их принадлежность по функциональному ответу. Такой подход вскоре стал непременным атрибутом большинства стереотаксических операций (рис. 11) [37].
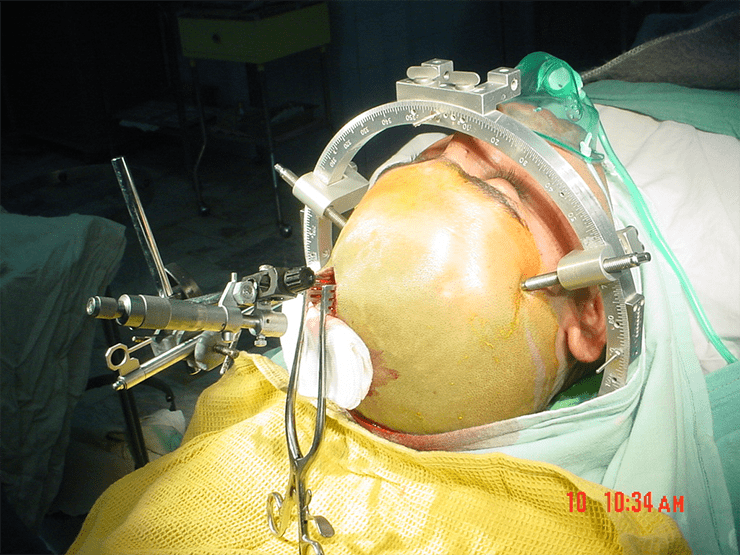
Рисунок 11. Во время стереотаксической операции зоны мозга больного жестко позиционируются по трем осям координат с помощью специального прибора.
Если электроды можно использовать для активации различных зон мозга во время операции, то почему же не попробовать оставить их в мозге и после, выведя контакты прямо на поверхность скальпа? Такие электроды можно использовать по мере необходимости в терапевтических целях. Первая подобная операция с введением электродов во фронтальный тракт мозга прошла в 1948 году [38]. По понятным причинам, внедрение этой техники в медицину происходило очень медленно и ограниченно. А вот для экспериментов над животными она подходила как нельзя лучше. Наверняка каждый, кто хоть как-то связан с биологией, слышал про историю с крысами, до изнеможения нажимающими на педальку и получающими электрический разряд в центр удовольствия. Эта классическая работа Джеймса Олдза и Питера Милнера, опубликованная в 1954 году, стала одной из первых экспериментальных работ по электрической стимуляции глубоколежащих структур мозга [39].
Оказалось, что этот же принцип может служить и медицинским целям — электрическая стимуляция выброса эндорфинов давала заметный обезболивающий эффект. За последние полвека глубокая стимуляция мозга стала самостоятельным методом лечения (рис. 12). Описано ее применение для лечения некоторых форм эпилепсии [40], депрессии [41], болезни Паркинсона [42] и синдрома Туретта [43]. Вживление электродов стало действенным методом лечения, однако эта операция так и не потеряла некоторого ореола загадочности и авантюрности. Отчасти это связано с тем, что механизм терапевтического действия глубокой стимуляции мозга так и не изучен [44].
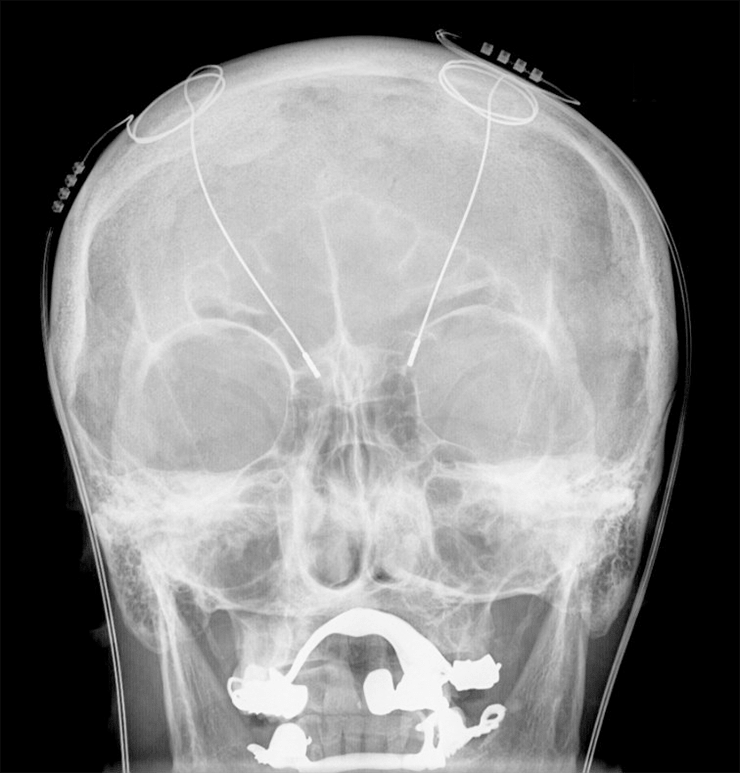
Рисунок 12. Рентгенограмма головы пациента, проходящего лечение методом глубокой стимуляции мозга. Кроме электродов в центре мозга, на нижней части снимка резко выделяется зубной протез.
Нужно сказать, что электрическая нейромодуляция — донельзя грубый метод воздействия на мозг. Электроды вводятся в мозг с точностью до миллиметров, но тем не менее их токи возбуждают сразу миллионы нервных клеток без всякого разбора. Если бы удалось научиться стимулировать лишь целевые клетки определенного типа!.. И тут на помощь нейрофизиологам пришла молекулярная биология.
Оптогенетика
Появление этого фантастического направления предсказал еще великий Френсис Крик, увлекшийся во второй половине своей карьеры нейрофизиологией [45]. К рубежу нового века стало очевидно, что именно внедрение методов молекулярной биологии в науку о мозге способно передать в руки ученых давно желанную возможность управлять индивидуальными клетками мозга [46]. Вместо неразборчивого электрического тока средством управления стал свет. Клетки мозга не имеют фоторецепторов, но методами молекулярной биологии можно заставить нужные нам нейроны синтезировать фоточувствительные белки, возбуждающие клетку в ответ на освещение светом с необходимой длиной волны.
Предтечей современной оптогенетики стали работы Бориса Земельмана, собравшего вместе с соавторами вектор, включающий родопсин, аррестин-2 и гетеромерный G-белок дрозофилы. Три этих белка формировали устойчивую, хотя и громоздкую и относительно медленную систему, изменяющую мембранный потенциал клеток в ответ на освещение [45]. Однако настоящее рождение оптогенетики состоялось после клонирования белка каналродопсина-2 (channelrhodopsin-2) из зеленой водоросли Hlamydomonas reinhardtii. Этот белок представляет собой катионный канал, открывающийся при освещении и имеющий пик поглощения на 480 нм.
В августе 2005 года лаборатория под руководством Карла Дайссерота (Стэнфорд, США) опубликовала статью с описанием экспрессии этого белка в первичной нейрональной культуре. Теперь просто освещая нейроны, можно было заставить сгенерировать их потенциал действия с миллисекундным откликом [47]! Но оставалась еще задача заставить работать новый метод в живом мозге. Для этого ген каналродопсина был клонирован вместе с геном желтого флуоресцентного белка (YFP) под общий промотор, а вся эта конструкция была помещена в лентивирусный вектор [48], [49]. Лентивирус легко вводится в необходимый район мозга инъекцией, а определить, какие именно клетки были трансдуцированы вектором, можно по их свечению (рис. 13, 14).
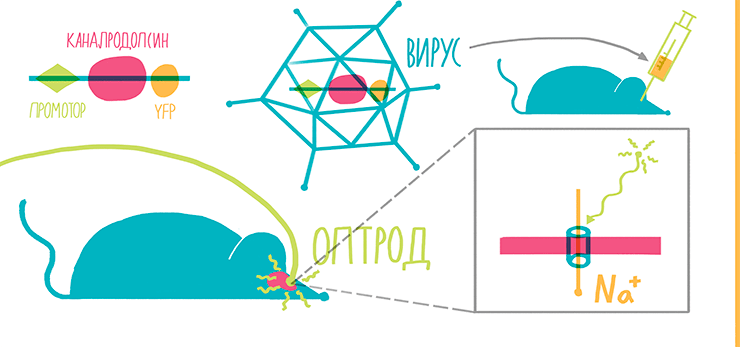
Рисунок 13. Оптика + генетика = ? Лентивирус, содержащий ген светочувствительного белка, точечно вводится в мозг мыши. Промотор гена может также обладать тканевой специфичностью, что приводит к еще большей избирательности метода.
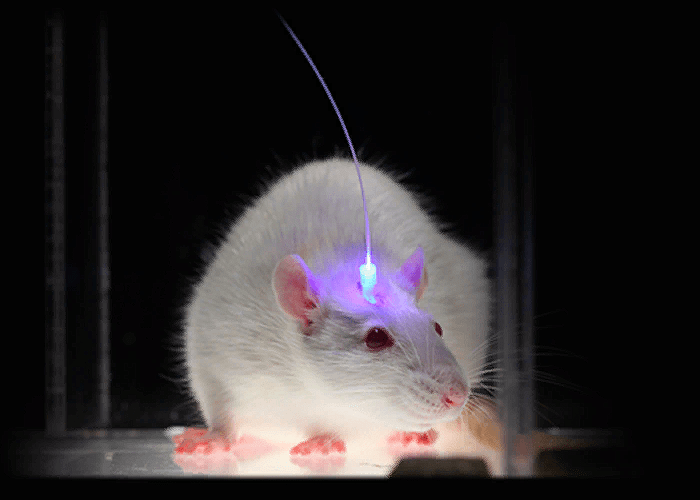
Рисунок 14. «Оптогенетическая» мышь с оптродом на голове.
В то же время и такой избирательности может оказаться недостаточно для решения поставленной задачи, ведь иногда нужно получить возможность возбуждать не только клетки определенной зоны, но и определенного типа. И этот вопрос нашел сразу несколько решений [50]. Так, например, гены белков фоторецепторов можно поместить под высокоспецифичный промотор, такой как CaMKII?, работающий только в возбуждающих нейронах [51]. Или использовать трансгенных мышей и систему рекомбинации Cre-Lox [52]. Помимо катионных фотоуправляемых каналов, клонировали анионные насосы [53] и каналы [54], позволяющие гиперполяризовать мембрану целевых клеток, блокируя нейропередачу. Потенциал нового метода стал понятен практически сразу: в 2010 году журнал Nature назвал оптогенетику методом года (см. видео) [55], [56].
Видео. Оптогенетика — метод 2010 года по версии журнала Nature.
Нейроимиджинг
Магнитно-резонансная томография
Многие методы из арсенала ученых-нейрофизиологов очень плохо подходят для исследования живых систем in vivo. Все они требуют «нарезки» организма на срезы, а то и на отдельные клетки. В этом смысле особняком стоят методы, позволяющие исследовать нервную деятельность живого организма с минимальным вмешательством. И, конечно, особую роль среди них занимает магнитно-резонансная томография. Этот метод позволил, как по волшебству, заглянуть внутрь живого мозга, изучая его строение и даже отслеживая распределение зон активности в нем.
Физические принципы МРТ идентичны тем, которые используют для установления структуры молекул в методе ЯМР-спектроскопии [57]. Самый распространенный по числу атомов элемент человеческого тела (как и Вселенной) — водород, который имеет ядро, состоящее всего лишь из одного протона. Этот протон, в отличие от ядер большинства других атомов, имеет собственный магнитный момент (спин). Спин ядра можно представить в виде вектора, направление которого обычно случайно. Однако если поместить атомы водорода в постоянное магнитное поле, то векторы спинов ядер сориентируются либо по направлению внешнего магнитного поля, либо против него. Теперь, если воздействовать на атомы переменным магнитным полем резонансной частоты, часть атомов поменяет магнитный момент своих ядер на противоположный. При исчезновении этого переменного поля они вернутся в свое изначальное состояние, выделив энергию, которая и будет зарегистрирована датчиками МР-томографа [58]. Для некоторых видов МРТ могут применяться контрастные вещества на основе гадолиния либо оксидов железа.
Фактически МРТ родился вместе с публикацией в Nature статьи Пола Лотербура в 1973 году [59]. Спустя 40 лет этот труд принес ему Нобелевскую премию по физиологии и медицине 2003 года совместно с Питером Мэнсфилдом. Однако, как это часто бывает с идеями, меняющими картину науки, у метода МРТ тяжело назвать единственного автора. Важнейший, если не решающий, вклад в создание аппарата МРТ внес Реймонд Дамадьян, а заявка на патент самого принципа МРТ была подана еще в 1960 году советским ученым Владиславом Ивановым (рис. 15) [60].
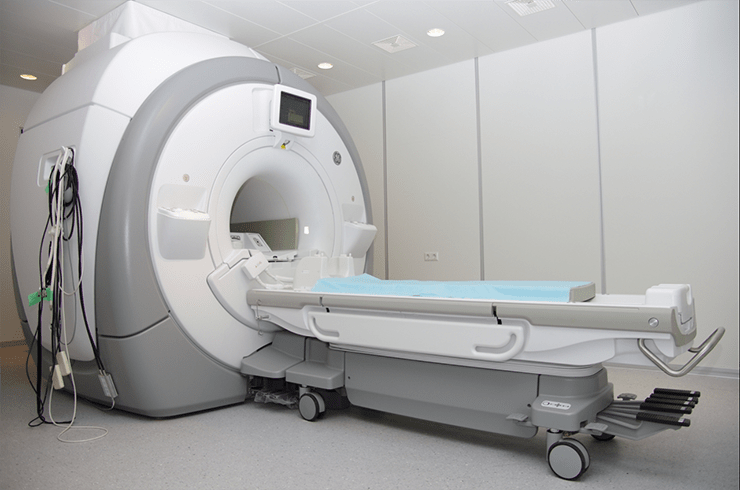
Рисунок 15. Основа всех МР-томографов — мощный магнит (в случае высокопольных МРТ-сканеров — сверхпроводящий), окруженный криогенной рубашкой. Из-за этой технологической особенности МР-томографы отличаются внушительными габаритами.
Мозг гетерогенен по своему строению. Длинные отростки нервных клеток образуют тяжи, окутанные оболочкой из нейроглии. Все вместе они слагают белое вещество. Его волокна перемежаются с отдельными ядрами, а то и с целыми пластами (корой) серого вещества, состоящего из тел нейронов и нейроглии. Все эти структуры чудовищно усложняют диффузию молекул воды, ограничивая ее свободу и придавая предпочтительные направления движения. Этим и пользуются ученые в методе диффузионно-тензорной МРТ. Регистрируя направление движения молекул воды, томограф строит трехмерную модель расположения проводящих путей мозга. Сумасшедшие картинки, неизменно сопровождавшие публикации проекта «Коннектом человека» получены как раз этим, немного экзотическим методом (рис. 16).
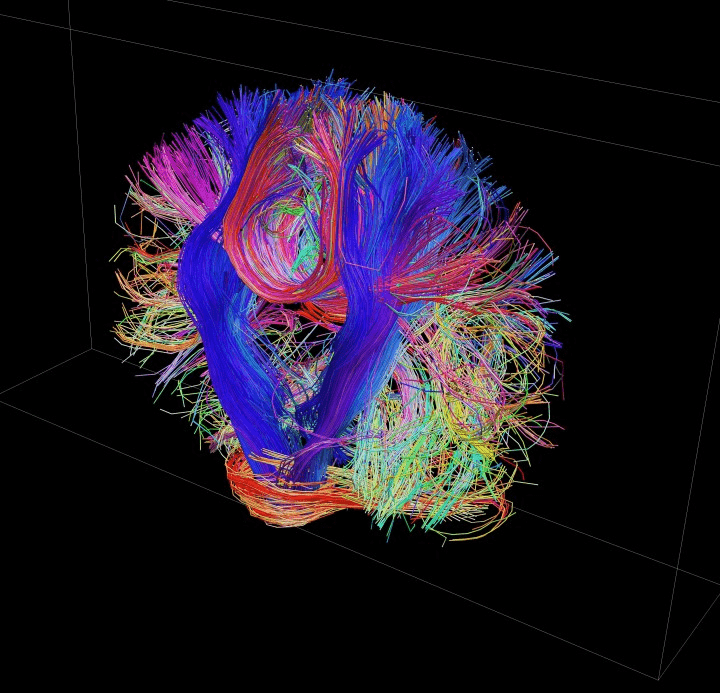
Рисунок 16. Трехмерная реконструкция нервных путей белого вещества — результат диффузионно-тензорной МРТ-трактографии.
Позитронно-эмиссионная томография
Наверное, услышав слово «аннигиляция», любители научной фантастики живо представят себе армады космодредноутов, движимых силой невероятной реакции превращения материи и антиматерии в чистую энергию. Но, оказывается, этот процесс вполне способен происходить и внутри нашего тела, не причиняя нам какого-либо дискомфорта. На аннигиляции основан метод позитронно-эмиссионной томографии (ПЭТ). По сути, ПЭТ-сканер (рис. 17) представляет собой трехмерный детектор ?-частиц, вылетающих из тела пациента. Ключевой компонент метода — радиофармпрепарат. Как правило, это вещество-метаболит, способное к накоплению в исследуемой ткани. Оно может иметь самую разную природу, но обязательно должно содержать изотоп, способный к позитронному ?-распаду. Например, для исследования тканей мозга, активно поглощающих глюкозу, а также для поиска некоторых типов опухолей часто используют 18F флудеоксиглюкозу.
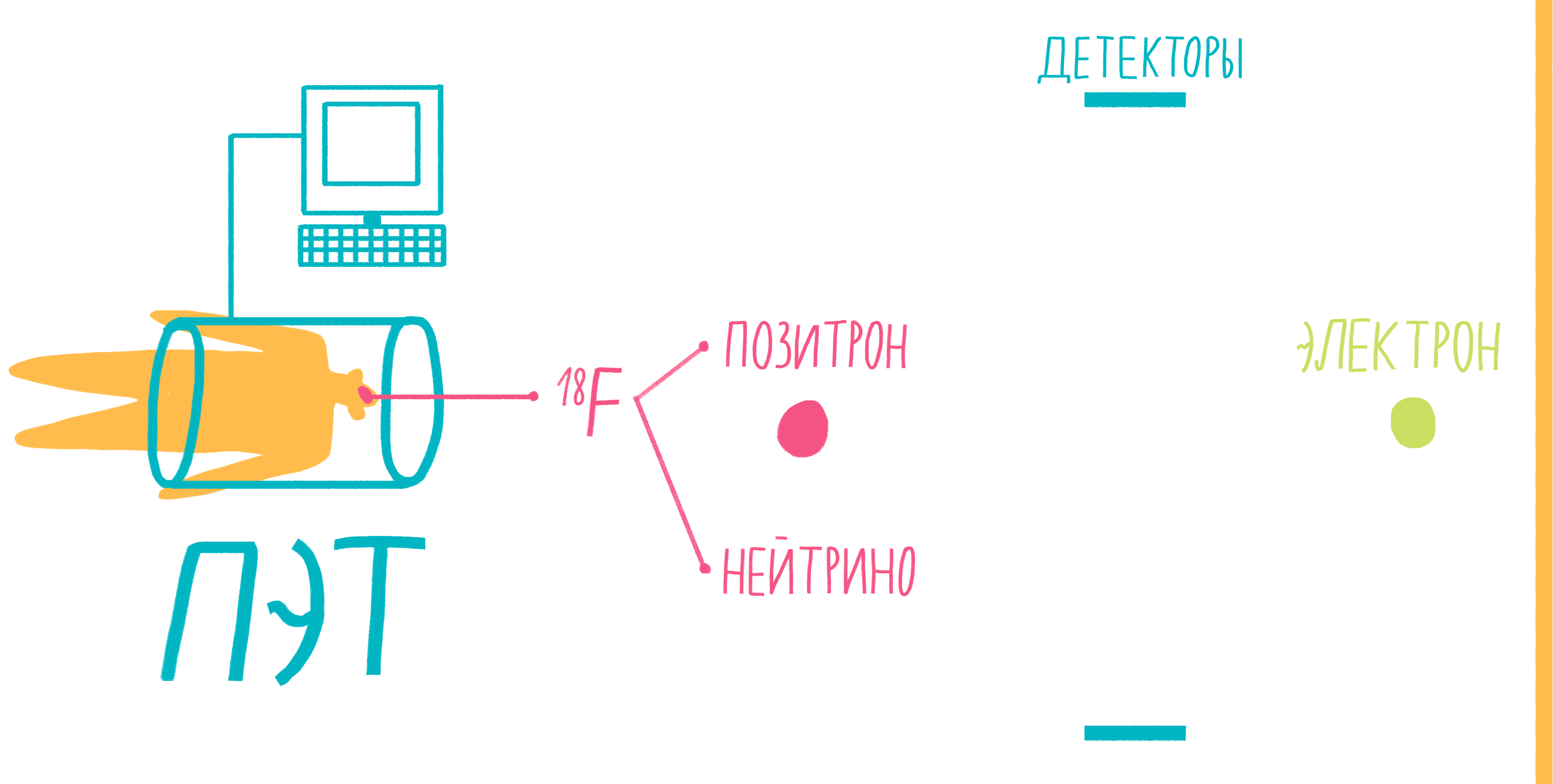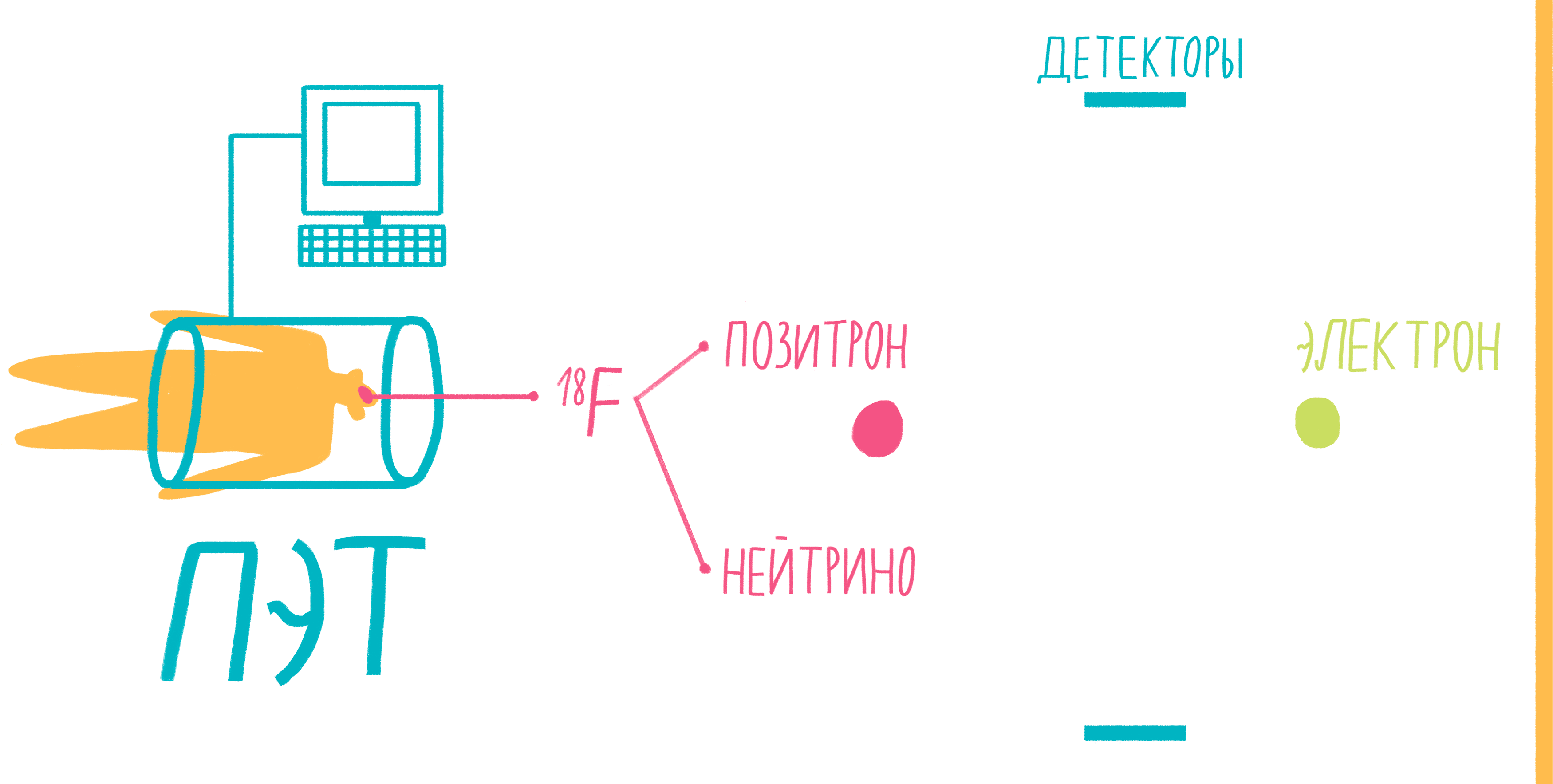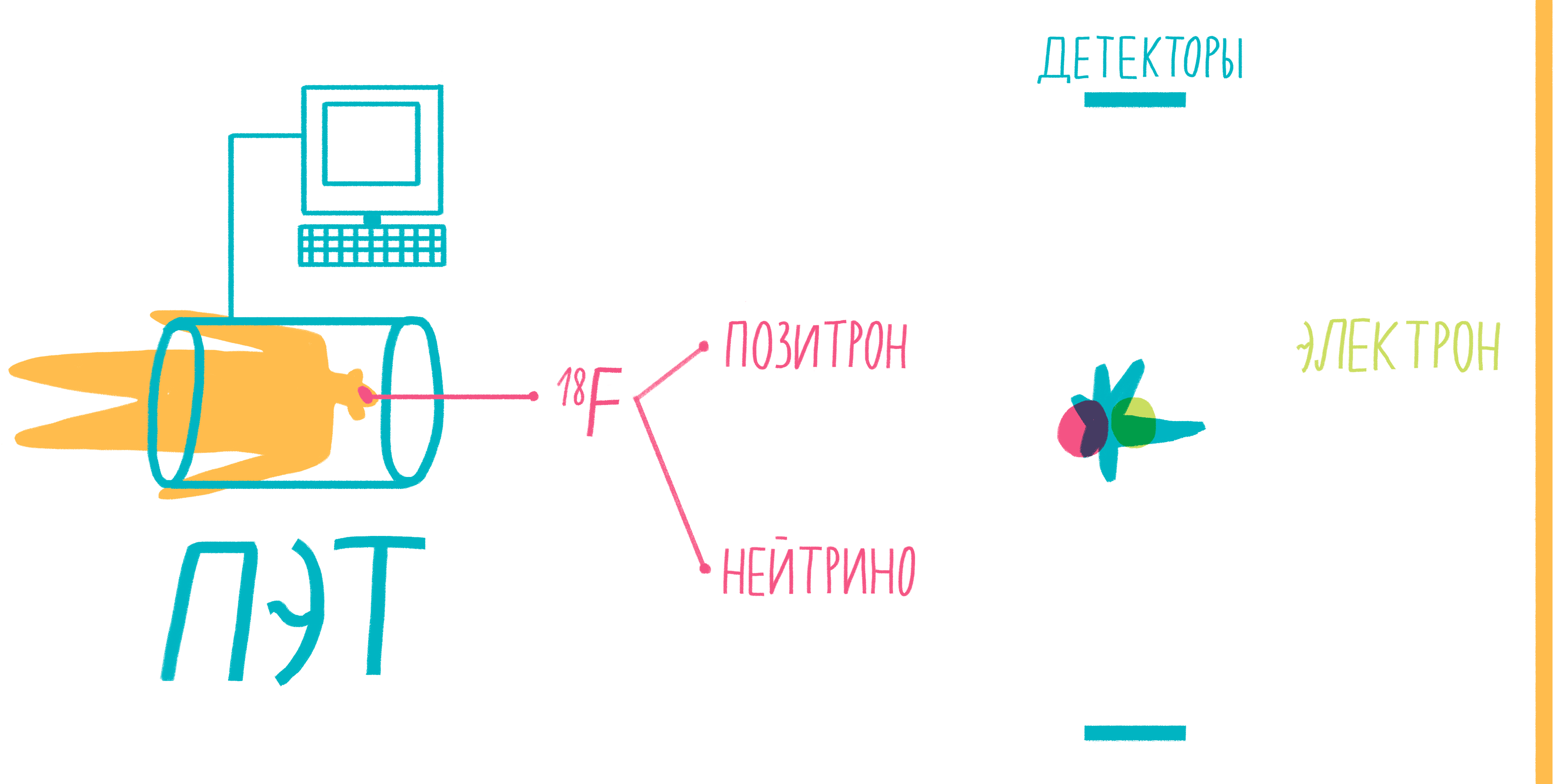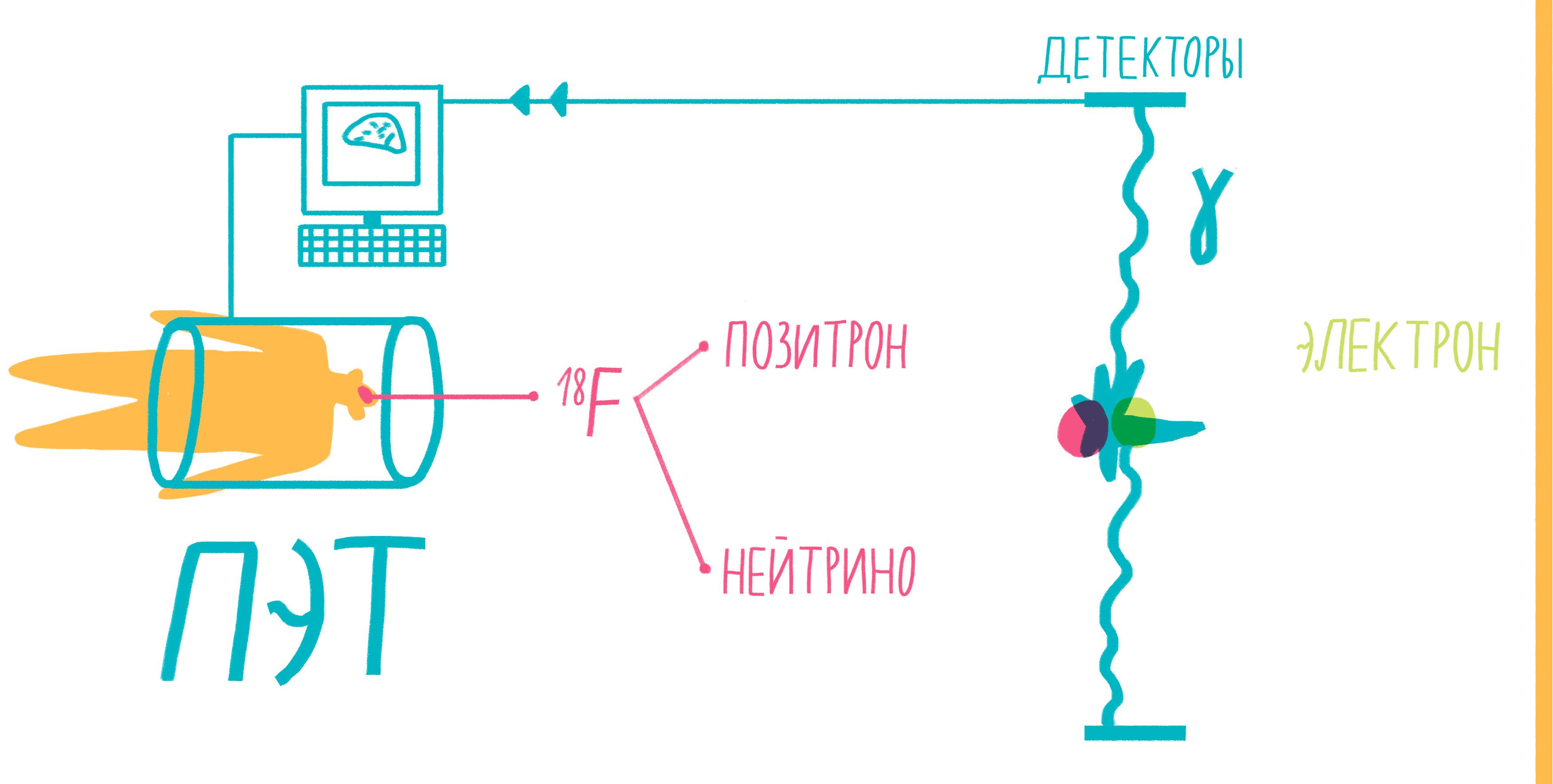
Рисунок 17. Схема позитронно-эмиссионной томографии.
Во время ?-плюс (позитронного) распада протон ядра превращается в нейтрон, одновременно испуская нейтрино и позитрон. Нейтрино свободно улетает, никак не взаимодействуя с веществом, а вот позитрон далеко улететь не может. Очень быстро он натыкается на какой-нибудь электрон, и они оба исчезают, испуская пару ?-частиц. Эти частицы и детектируются сцинтилляционными детекторами, установленными в кольце ПЭТ-сканера. Несмотря на большую энергию ?-частиц, их число невелико и не может нанести урон здоровью пациента. Кроме того, количество радиофармпрепарата рассчитывается так, чтобы не превысить максимально допустимой дозы облучения.
Установку с несколькими ?-датчиками для локализации опухолей мозга описал Уильям Свит в работе 1953 года [61]. Практически одновременно Фрэнк Ренн с соавторами опубликовал в Science результаты исследования опухолей мозга с использованием аннигиляции [62]. Однако настоящая ПЭ-томография появилась лишь с появлением надежных методов реконструкции изображения по множественным сечениям. Эту работу начали Дэвид Кул и Рой Эдвардс в конце 1960 года и закончили в 1975 г. Тер-Погосяном, Фелпсом и Хоффманом постройкой первого полноценного томографа [63].
Важнейшая составляющая метода ПЭТ — наличие подходящих радиофармпрепаратов. Они тоже прошли долгую эволюцию: от экзотических 64Cu и 75As до 18F, ставшего в составе 18F-меченной флудеоксиглюкозы самым популярным радиомаркером ПЭТ. Большинство изотопов для ПЭТ, способных к ?-плюс распаду, изготавливают на циклотроне прямо перед исследованием, что необходимо из-за довольно непродолжительного времени их полураспада [64].
Электроэнцефалография
Говоря о нейроимиджинге, нельзя не упомянуть об электроэнцефалографии. Этот старейший метод мониторинга активности мозга по своей физической основе стоит гораздо ближе к методам электрофизиологии, однако возможности по неинвазивному наблюдению активности мозга заставляют причислить его именно к методам нейроимиджинга.
Поскольку внутри нервной системы протекает множество электрических токов, то их можно попытаться зарегистрировать прямо на поверхности мозга, а может, даже и тела — без нарушения кожного покрова. Как и следовало ожидать, эта мысль пришла к исследователям еще на заре электрофизиологии — во второй половине XIX века. Первые работы по записи суммарной активности полушарий мозга животных выполнили Адольф Бек и Наполеон Цибульский в конце 1880-х годов. В этих работах электроды помещали непосредственно на поверхность мозга животного. Гораздо сложнее оказалось получить запись токов с помощью электродов, устанавливаемых на поверхность тела. Лишь спустя 20 лет, в 1912 году, русский физиолог Правдич-Неменский получил первую ЭЭГ млекопитающего, и лишь в 1924 году Ганс Бергер провел первую человеческую электроэнцефалографию [65].
Анализируя частоты и амплитуду изменения потенциалов, можно сделать множество выводов об общей активности мозга. Свои частоты характерны для сна, бодрствования, активной умственной работы и восприятия стимулов. Однако сигнал, получаемый при ЭЭГ — это лишь суммарные изменения электрического поля, порождаемые миллиардами нервных клеток. Использовать его для точной локализации нейрофизиологических процессов в мозге почти невозможно — это как пытаться идентифицировать личности пловцов по волнам на поверхности бассейна. Зато характерный, нездоровый плеск или наоборот, его пугающее отсутствие — вполне можно отличить. Именно поэтому в наши дни ЭЭГ уже крайне редко используется исследователями, а вот медикам она, наоборот, нужна в самых разных областях [66]. Так, электроэнцефалографию используют для диагностики тяжелых нарушений, таких как эпилепсия, и общего мониторинга состояния мозга. Пусть ЭЭГ дает намного меньше информации, чем функциональная МРТ, но в отличие от многотонного томографа, электроэнцефалограф легко может поместиться в чемоданчике среднего размера и мгновенно дать множество базовых данных о работе мозга больного [67]. В то же время мощным фронтом ведутся работы по увеличению разрешающей способности метода и созданию ЭЭГ-датчиков для интерфейса мозг-компьютер [68].
Выводы
У каждой науки есть свой набор самых главных вопросов. И можно с гордостью сказать, что биология здорово преуспела в поиске ответов на свои. Мы практически разобрались в происхождении вида Homo sapiens, да и само появление жизни на Земле перестало казаться таким уж загадочным событием. Но вот вопрос нашего собственного устройства оказался гораздо более изощренным. Пока что наука не может полностью объяснить, как же наш мозг формирует сознание. Однако усилия последних 20-и лет привели к тому, что в арсенале нейробиологов появился уникальный набор междисциплинарных методов, позволяющий хотя бы подступиться к решению этой важнейшей суперзадачи XXI века.
Литература
- Suzana Herculano-Houzel. (2017). Numbers of neurons as biological correlates of cognitive capability. Current Opinion in Behavioral Sciences. 16, 1-7;
- 12 методов в картинках: микроскопия;
- Окрасивший нейроны;
- Golgi C. Sulla fina anatomia degli organi centrali del sistema nervoso. Milano: U. Hoepli, 1886. — 374 p.;
- Сотворивший нейробиологию: Сантьяго Рамон-и-Кахаль;
- Das G., Reuhl K., Zhou R. (2013). The Golgi—Cox method. Methods Mol. Biol. 1018, 313–321;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- LeVine H. (1999). Quantification of ?-sheet amyloid fibril structures with thioflavin T. Methods Enzymol. 309, 274–284;
- Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов;
- Peter Ravdin, Daniel Axelrod. (1977). Fluorescent tetramethyl rhodamine derivatives of ?-bungarotoxin: Preparation, separation, and characterization. Analytical Biochemistry. 80, 585-592;
- Clarke P.B., Schwartz R.D., Paul S.M., Pert C.B., Pert A. (1985). Nicotinic binding in rat brain: autoradiographic comparison of [3H]acetylcholine, [3H]nicotine, and [125I]-alpha-bungarotoxin. J. Neurosci. 5, 1307–1315;
- Моноклональные антитела;
- Tsukada T., Tippens D., Gordon D., Ross R., Gown A.M. (1987). HHF35, a muscle-actin-specific monoclonal antibody. I. Immunocytochemical and biochemical characterization. Am. J. Pathol. 126, 51–60;
- Douglas C. Prasher, Virginia K. Eckenrode, William W. Ward, Frank G. Prendergast, Milton J. Cormier. (1992). Primary structure of the Aequorea victoria green-fluorescent protein. Gene. 111, 229-233;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Флуоресцирующая Нобелевская премия по химии;
- Jeff W. Lichtman, Jean Livet, Joshua R. Sanes. (2008). A technicolour approach to the connectome. Nat Rev Neurosci. 9, 417-422;
- Dawen Cai, Kimberly B Cohen, Tuanlian Luo, Jeff W Lichtman, Joshua R Sanes. (2013). Improved tools for the Brainbow toolbox. Nat Meth. 10, 540-547;
- Fritjof Helmchen, Winfried Denk. (2005). Deep tissue two-photon microscopy. Nat Meth. 2, 932-940;
- Kwanghun Chung, Karl Deisseroth. (2013). CLARITY for mapping the nervous system. Nat Meth. 10, 508-513;
- Raju Tomer, Li Ye, Brian Hsueh, Karl Deisseroth. (2014). Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nat Protoc. 9, 1682-1697;
- Ernst-August Seyfarth. (2006). Julius Bernstein (1839–1917): pioneer neurobiologist and biophysicist. Biol Cybern. 94, 2-8;
- Формирование мембранного потенциала покоя;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- Young J.Z. (1936). Structure of nerve fibres and synapses in some invertebrates. Cold Spring Harb. Symp. Quant. Biol. 4, 1–6;
- Hodgkin A.L. and Huxley A.F. (1939). Action potentials recorded from inside a nerve fibre. Nature. 144, 710–711;
- Curtis H.J. and Cole K.S. (1940). Membrane action potentials from the squid giant axon. J. Cell. Compar. Physiol. 15, 147–157;
- Cole K.S. (1949). Dynamic electrical characteristics of the squid axon membrane. Archives des Sciences Physiologiques. 3, 253–258;
- George Marmont. (1949). Studies on the axon membrane. I. A new method. J. Cell. Comp. Physiol.. 34, 351-382;
- Hodgkin A.L. and Huxley A.F. (1952). A quantitative description of membrane current and its application to conduction and excitation in nerve. J. Physiol. 117, 500–544;
- St?hmer W. (1992). Electrophysiological recording from Xenopus oocytes. Methods Enzymol. 207, 319–339;
- Strickholm A. (1961). Impedance of a small electrically isolated area of the muscle cell surface. J. Gen. Physiol. 44, 1073–1088;
- P. G. KOSTYUK, O. A. KRISHTAL, V. I. PIDOPLICHKO. (1975). Effect of internal fluoride and phosphate on membrane currents during intracellular dialysis of nerve cells. Nature. 257, 691-693;
- W. A. Wilson, Marcia Monahan Goldner. (1975). Voltage clamping with a single microelectrode. J. Neurobiol.. 6, 411-422;
- O. P. Hamill, A. Marty, E. Neher, B. Sakmann, F. J. Sigworth. (1981). Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch - Eur J Physiol. 391, 85-100;
- E. A. SPIEGEL, H. T. WYCIS, M. MARKS, A. J. LEE. (1947). Stereotaxic Apparatus for Operations on the Human Brain. Science. 106, 349-350;
- R. HASSLER, T. RIECHERT, F. MUNDINGER, W. UMBACH, J. A. GANGLBERGER. (1960). PHYSIOLOGICAL OBSERVATIONS IN STEREOTAXIC OPERATIONS IN EXTRAPYRAMIDAL MOTOR DISTURBANCES. Brain. 83, 337-350;
- Philip L. Gildenberg. (2005). Evolution of Neuromodulation. Stereotact Funct Neurosurg. 83, 71-79;
- Olds J. and Milner P. (1954). Positive reinforcement produced by electrical stimulation of septal area and other regions of rat brain. J. Comp. Physiol. Psychol. 47, 419–427;
- Chabard?s S., Kahane P., Minotti L., Koudsie A., Hirsch E., Benabid A.L. (2002). Deep brain stimulation in epilepsy with particular reference to the subthalamic nucleus. Epileptic Disord. 4, 83-93;
- Helen S. Mayberg, Andres M. Lozano, Valerie Voon, Heather E. McNeely, David Seminowicz, et. al.. (2005). Deep Brain Stimulation for Treatment-Resistant Depression. Neuron. 45, 651-660;
- G?nther Deuschl, Carmen Schade-Brittinger, Paul Krack, Jens Volkmann, Helmut Sch?fer, et. al.. (2006). A Randomized Trial of Deep-Brain Stimulation for Parkinson's Disease. N Engl J Med. 355, 896-908;
- Richard S. Dowd, Michael Pourfar, Alon Y. Mogilner. (2017). Deep brain stimulation for Tourette syndrome: a single-center series. Journal of Neurosurgery. 1-9;
- Паевский А. (2016). Непонятное, но эффективное лечение «Паркинсона». Сайт «Нейроновости»;
- Boris V. Zemelman, Georgia A. Lee, Minna Ng, Gero Miesenb?ck. (2002). Selective Photostimulation of Genetically ChARGed Neurons. Neuron. 33, 15-22;
- Светлая голова;
- Edward S Boyden, Feng Zhang, Ernst Bamberg, Georg Nagel, Karl Deisseroth. (2005). Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268;
- Benjamin R. Arenkiel, Joao Peca, Ian G. Davison, Catia Feliciano, Karl Deisseroth, et. al.. (2007). In Vivo Light-Induced Activation of Neural Circuitry in Transgenic Mice Expressing Channelrhodopsin-2. Neuron. 54, 205-218;
- Элементы: Оптогенетика. Как управлять нейроном с помощью света;
- V. Gradinaru, K. R. Thompson, F. Zhang, M. Mogri, K. Kay, et. al.. (2007). Targeting and Readout Strategies for Fast Optical Neural Control In Vitro and In Vivo. Journal of Neuroscience. 27, 14231-14238;
- Alexander M Aravanis, Li-Ping Wang, Feng Zhang, Leslie A Meltzer, Murtaza Z Mogri, et. al.. (2007). An optical neural interface:in vivocontrol of rodent motor cortex with integrated fiberoptic and optogenetic technology. J. Neural Eng.. 4, S143-S156;
- Linda Madisen, Tianyi Mao, Henner Koch, Jia-min Zhuo, Antal Berenyi, et. al.. (2012). A toolbox of Cre-dependent optogenetic transgenic mice for light-induced activation and silencing. Nat Neurosci. 15, 793-802;
- Feng Zhang, Alexander M. Aravanis, Antoine Adamantidis, Luis de Lecea, Karl Deisseroth. (2007). Circuit-breakers: optical technologies for probing neural signals and systems. Nat Rev Neurosci. 8, 577-581;
- Lief Fenno, Ofer Yizhar, Karl Deisseroth. (2011). The Development and Application of Optogenetics. Annu. Rev. Neurosci.. 34, 389-412;
- Когда ослепшие прозреют?;
- . (2011). Method of the Year 2010. Nat Meth. 8, 1-1;
- Сверхпроводящие магниты и рецепторы биомембран: Лаборатория биомолекулярной ЯМР-спектроскопии ИБХ РАН;
- Прокудина Д. (2015). Развернуть атомы: магнитно-резонансная томография. «Нейротехнологии.рф»;
- Lauterbur P.C. (1973). Image formation by induced local interactions: examples employing nuclear magnetic resonance. Nature. 242, 190;
- . (2003). Russian claims first in magnetic imaging. Nature. 426, 375-375;
- William H. Sweet. (1951). The Uses of Nuclear Disintegration in the Diagnosis and Treatment of Brain Tumor. N Engl J Med. 245, 875-878;
- F. R. Wrenn, M. L. Good, P. Handler. (1951). The Use of Positron-emitting Radioisotopes for the Localization of Brain Tumors. Science. 113, 525-527;
- Henry N. Wagner. (1998). A brief history of positron emission tomography (PET). Seminars in Nuclear Medicine. 28, 213-220;
- Nutt R. (2002). The history of positron emission tomography. Mol. Imaging Biol. 4, 11–26;
- Anton Coenen, Edward Fine, Oksana Zayachkivska. (2014). Adolf Beck: A Forgotten Pioneer in Electroencephalography. Journal of the History of the Neurosciences. 23, 276-286;
- Mahmoud Al-Kadi, Mamun Reaz, Mohd Ali. (2013). Evolution of Electroencephalogram Signal Analysis Techniques during Anesthesia. Sensors. 13, 6605-6635;
- Прокудина Д. (2017). Нейронауки для всех. Методы: электроэнцефалография. Сайт «Нейроновости»;
- F Lotte, M Congedo, A L?cuyer, F Lamarche, B Arnaldi. (2007). A review of classification algorithms for EEG-based brain–computer interfaces. J. Neural Eng.. 4, R1-R13.
Источник: biomolecula.ru