Какой сон лучше «промывает» мозг?
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-03-04 17:22
Исследование, опубликованное в журнале Science Advances, показывает, что медленная и стабильная деятельность мозга и сердечно-легочной системы, связанная с глубоким не-быстрым (non—REM) сном, являются оптимальной для функционирования глимфатической системы – уникального механизма для удаления отходов из замкнутой экосистемы мозга. Результаты помогают понять, почему некоторые формы анестезии могут привести к когнитивным нарушениям у пожилых людей, а также объясняют связь между старением, недосыпанием и повышенным риском болезни Альцгеймера.
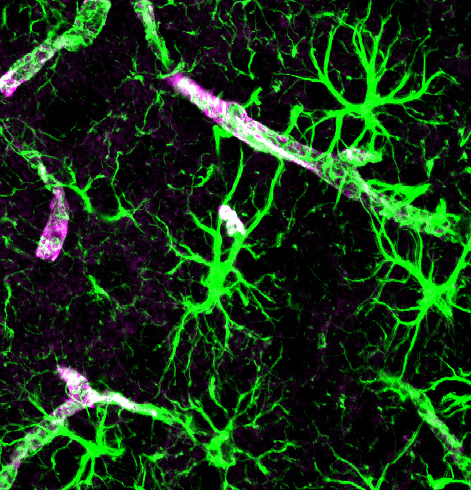
Астроциты (зелёный) и аквапорины (фиолетовый) — основные составляющие глимфатической системы
Глимфатическая система была впервые описана Майкен Недергаард и ее коллегами в 2012 году. Так называемая «канализационная система мозга» перекачивает спинномозговую жидкость через ткани головного мозга, вымывая отходы. Показано, что эта система работает преимущественно пока мы спим.
Поскольку накопление токсичных белков (бета-амилоид, тау-протеин) связано с развитием болезни Альцгеймера, исследователи предполагают, что нарушения в работе глимфатической системы в связи с некачественным сном могут провоцировать развитие этой болезни. Это согласуется и с клиническими наблюдениями, показывающими связь между недостатком сна и повышенным риском развития Альцгеймера.
«Сон имеет решающее значение для функционирования системы удаления отходов мозга, и наше исследование показывает, что чем глубже сон, тем лучше, — говорит Майкен Недергаард, доктор медицинских наук, со-директор Центра трансляционной нейромедицины при Рочестерском университете и ведущий автор исследования. — Эти данные также дополняют накапливающиеся доказательства того, что плохое качество сна или недосыпание могут предсказать возникновение болезни Альцгеймера и деменции».
В новой работе исследователи провели эксперименты с мышами, которых анестезировали шестью различными способами. Пока животные находились под наркозом, ученые отслеживали электрическую активность мозга, сердечно-сосудистую активность и фиксировали интенсивность потока спинномозговой жидкости через мозг. Было отмечено, что комбинация
кетамина и ксилазина (К/Х) наиболее точно имитировала медленную и устойчивую электрическую активность мозга в диапазоне дельта-ритма и замедленный сердечный ритм, связанные с глубоким не-быстрым сном. Кроме того, электрическая активность мозга мышей, которым вводили K/X, оказалась оптимальной для работы глимфатической системы.
Исследование затрагивает несколько важных клинических проблем. Оно еще раз подтверждает взаимосвязь между качеством сна, его возрастными изменениями и развитием болезни Альцгеймера: известно, что с возрастом снижается количество времени, проведенного в глубоком сне небыстрой фазы. Исследование подчеркивает важность глубокого сна для правильного функционирования глимфатической системы и также демонстрирует возможность манипуляции данной системой путем регуляции времени и фаз сна, что может найти клиническое применение: например, терапия сном для пациентов группы риска.
Более того, поскольку несколько из применявшихся в экспериментах соединений были аналогичны анестетикам, используемым в клинической практике, исследование также проливает свет на когнитивные сложности, которые испытывают люди старшего возраста после операций под общим наркозом. Подбор правильных препаратов для анестезии необычайно важен: у мышей, которым вводили анестетик, не способный индуцировать медленноволновую активность, наблюдалась пониженная активность глимфатической системы.
Текст: Диана Галимова
Increased glymphatic influx is correlated with high EEG delta power and low heart rate in mice under anesthesia by Lauren M. Hablitz, Hanna S. Vinitsky, Maiken Nedergaardet al in Science Advances. Published February 2019.
http://dx.doi.org/10.1126/sciadv.aav5447
Источник: neuronovosti.ru