Генетически-модифицированные близняшки
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-03-09 12:20

Первые генетически-модифицированные близняшки родились в Китае. Генетик Hi Jiankui из Южного университета науки и технологий в Шэньчжэне. Выложил видео из лаборатории и рассказал о своем эксперименте:
Hi Jiankui с помощью генной инженерии на клеточном уровне на момент оплодотворения смог вырезать ген CCR5 из цепей ДНК. Один из родителей близняшек (Лулу и Нана), является носителем вируса ВИЧ.
CCR5 (C-C chemokine receptor type 5) — белок человека, кодированный данным геном, относится к подклассу рецепторов бета-хемокинов из класса интегральных белков. Хемокин — белок адгезии, относится к семейству цитокинов, контролирующих клеточную миграцию, инициирует иммунный ответ и хемотаксис клеток. Рецепторы к хемокинам сопряжены с G-белком и находятся на поверхности CD4, CD8 и T-клеток. CCR5 — является коферментом для проникновения (М-тропных) штаммов ВИЧ-1 в клетку.
Вирус проникает в клетку с помощью двух рецепторов: сначала взаимодействует с CD4, который закрепляет и захватывает гликопротеин, затем CCR5 приближается к комплексу CD4-ВИЧ и связывается с ним. Это влияет на конформацию вирусного гликопротеина gp41, вследствие чего вирус проникает в мембрану и инфицирует клетку. Данный механизм отражен на рисунке 1.
Инфицированный организм продуцирует от одного до десяти миллиардов вирусных частиц в день. Среднее время полного истощения CD4 и начала развития симптомов СПИДа, составляет 10 лет.
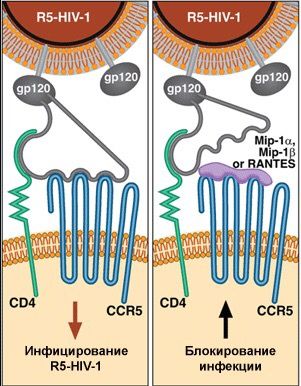
Рисунок 1. Поражение клетки ВИЧ-1
В генетике известны мутации CCR5-?32, которые делают человека невосприимчивым к ВИЧ-1. Данная мутация в гетерозиготном состоянии уменьшает риск инфицирования, а в гомозиготном сводит этот риск к 1 %.
Для того, чтобы вырезать CCR5 ген, Hi Jiankui воспользовался методом CRISPR/Cas9. CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) — регулярно сгруппированные, разделенные короткие палиндромные повторы. CRISPR/Cas9 — система адаптивного иммунитета состоящая из двух частей: CRISPR-кассета и прилегающий к ней кластер генов Cas. Кассета — блок палиндромных повторов перемежающихся со спайсерами (прим.: спайсеры — участки нетранскребируемой ДНК, «память» об инородном генетическом материале). Cas9 — нуклеаза, разрезающая ДНК, выделенная из культуры Streptococcus pyogenes (возбудитель скарлатины). Лидирующая последовательность играет роль промотора, с которого начинается транскрипция CRISPR на РНК. Получившаяся молекула РНК с помощью РНКазы III разрезается на фрагменты CRISPR РНК (crРНК), в состав которой входит спайсер и кусочки повторов. Для активации Cas9 белка необходима tracrРНК (trans-activating CRISPR RNA), которая закодирована рядом с Cas-кластером. Следующим этапом идет образование интерференционного функционального модуля (рабочая иммунная единица), который состоит из дуплекса crРНК-tracrРНК и связанного с ним белка Cas9. Чтобы комплекс crРНК- tracrРНК-Cas9 узнал закодированный участок ДНК, необходимо наличие РАМ (protospacer adjacent motif).
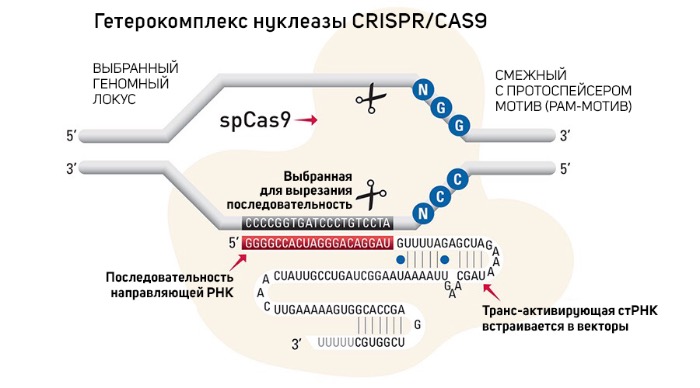
Для генной инженерии ученые генетики усовершенствовали CRISPR/Cas9: поместили на векторы (молекулы нуклеиновой кислоты ДНК, используемые для передачи генетического материала внутрь клетки in vivo) ген Cas9-белка и CRISPR-кассеты, спайсеры запрограммировали идентично участку, который необходимо изменить. Ученые смогли объединить crРНК и tracrРНК в молекулу sgРНК (single guide РНК) и заменить РНКазу III на другие рибонуклеазы. В итоге получилась простая двухкомпонентная система: ген cas9 и CRISPR-кассета транскрибируются в клеточном ядре. CRISPR-транскрипт после транскрипции нарезается на отдельные sgРНК, которые объединяются с белками Cas9 и ищут комплементарный участок в геноме, в котором в дальнейшем наблюдается сплайсинг. Далее репарация идет по двум альтернативным путям: негомологичное соединение концов (просто сшивание), или гомологичная рекомбинация (с двух концов комплементарных участков-«заплаток»).
Генетический эксперимент получил широкую огласку и критику со стороны мировой общественности и министерства здравоохранения Китая. Относительно ученого будет собрана комиссия, поскольку его действия сочли не гуманными и неправомерными.
Считаете ли вы этичным модифицировать гены еще не рожденных эмбрионов?
Источники
1) Wright A.V., Nu?ez J.K., Doudna J.A. Biology and applications of CRISPR systems: harnessing nature’s toolbox for genome engineering. Cell. 2016, 29–44;
2) Ebina H., Misawa N., Kanemura Y., Koyanagi Y. Harnessing the CRISPR/Cas9 system to disrupt latent HIV-1 provirus. 2013;
3) K., Kaminski R., Gordon J., Cosentino L., Hu W. Genome editing strategies: potential tools for eradicating HIV-1/AIDS. J. Neurovirol. 2015 310–321;
4) Liao H.K., Gu Y., Diaz A., Marlett J., Takahashi Y., Li M. et al. Use of the CRISPR/Cas9 system as an intracellular defense against HIV-1 infection in human cells. Nat. Commun., 2015;
5) Haworth G.H., Peterson C.W. CCR5-edited gene therapies for HIV cure: Closing the door to viral entry. J. Cytotherapy 2017, 1325-1338;
6) Espy N., Pacheco B., Sodriski J., Adaptation of HIV-1 to cells with low expression of the CCR5 coreceptor, 2017 90-107;
7) Chira S., Gulei D., Hajitou A. Et al. CRISPR/Cas9: Transcending the Reality of Genome Editing J. Molecular Therapy 2017, 211-222.
Источник: www.medach.pro