Влияние генетических факторов на развитие биполярного аффективного расстройства (БАР)
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-02-09 18:56

Согласно данным национального института психического здоровья США около 4,4 % американцев в течение жизни сталкиваются с биполярным аффективным расстройством. Люди, больные БАР, страдают от смены эпизодов мании и депрессии, вызывающих сильные изменения настроения, уровня активности и продуктивности. Эпизоды отличаются своей отчетливой выраженностью, превосходя перепады настроения здоровых людей. Больным тяжело справляться с повседневными задачами, контактировать с другими людьми, заниматься интеллектуальным трудом и достигать поставленных целей. Медикаментозное лечение обычно не приносит особых результатов, т. к. у пациентов не наблюдается полного выздоровления. БАР — одна из ведущих причин самоубийств, инвалидности, а также несоизмеримых эмоциональных и финансовых трудностей для семей больных. На данный момент существует немного перспективных исследований, вносящих понимание в биологические основы БАР. Однако новые исследования генетического происхождения БАР, проведенные учеными Массачусетского технологического института, раскрывают новые перспективы в лечении и диагностике БАР. Ученые продемонстрировали взаимосвязь между регуляцией активности синапсов межнейрональных связей и белком CPG2 (Candidate Plasticity Gene 2 — потенциальный ген пластичности 2). Обнаружилось снижение концентрации CPG2 у больных биполярным аффективным расстройством. Исследователи связали изменения гена, кодирующего CPG2, с синаптической дисфункцией, которая наблюдается у людей, страдающих биполярным аффективным расстройством.
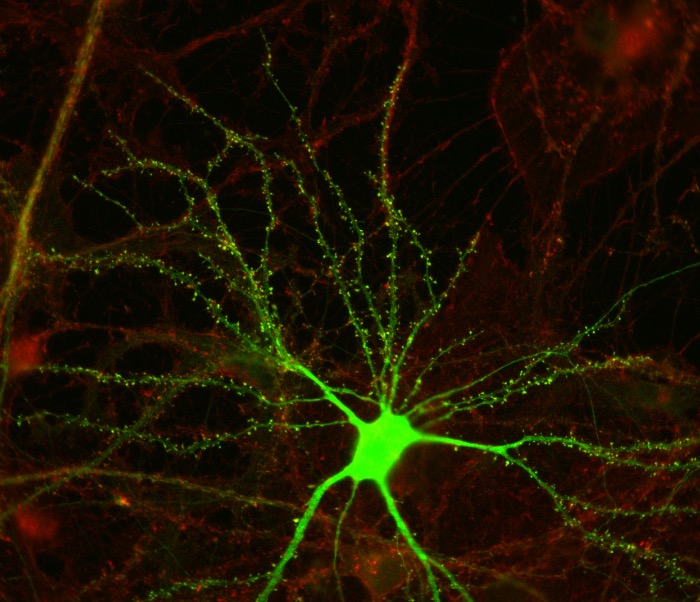
Экспрессирующий CPG пирамидальный нейрон. Источник: https://nedivilab.mit.edu/research/cpg2/
Команда исследователей сообщает о результатах в статье, опубликованной в журнале «Molecular Psychiatry». «Это тот редкий случай, когда ученые смогли обнаружить генетическую связь между мутациями и повышенным риском развития психического заболевания из-за клеточной дисфункции», — заявляет старший исследователь Элли Недиви, профессор кафедр биологии и когнитивных наук Массачусетского технологического института. Стоит заметить: профессор Недиви и ее коллеги не предполагают, что обнаруженные ими вариации генов вызывают БАР, однако они убеждены, что наличие данных вариаций увеличивает риск развития биполярного аффективного расстройства.
Транскрипт cpg2 — продукт SYNE1 гена, кодирующего множество белков с различной функциональностью. Зависимая от активности транскрипции регуляция, субклеточная локализация белкового продукта, а также характер экспрессии cpg2 участвуют в регуляции синаптической пластичности. Белок CPG2 локализован в эндоцитарной зоне рядом с возбуждающими синапсами в дендритных шипиках. Предполагают, что клатрин-зависимый эндоцитоз (CME) AMPA-глутамат рецепторов (AMPAR) из постсинаптической мембраны участвует в разных формах синаптической пластичности, включая длительный период депрессии.
Актиновый цитоскелет является важной составляющей клатрин-зависимого эндоцитоза, однако долгое время от исследователей ускользало понимание его взаимодействия с эндоцитарным процессом. Ученые идентифицировали CPG2 в качестве связующего F-актинового компонента, функционально опосредующего взаимодействие цитоскелета с постсинаптическим эндоцитозом. Регуляция CPG2/F-актиновой ассоциации протеинкиназой А обеспечивает возможность клеточного контроля интернализации синаптических рецепторов посредством вторичных мессенджеров. Идентификация SYNE1 в качестве вероятного локуса, причастного к развитию БАР, предполагает, что CPG2 может играть важную роль в синаптической дисфункции, характерной для данного заболевания. В настоящее время ученые идентифицируют гомологи cpg2 и проверяют, изменяют ли мутации в этих транскриптах глутаматергическую функциональность синапсов, параллельно работая над выявлением функциональных модулей в белке CPG2, опосредующих различные белковые взаимодействия, связанные с эндоцитозом глутаматных рецепторов.
Патологоанатомические исследования продемонстрировали снижение экспрессии NMDA-глутамат рецепторов (NMDAR) в кортикальной и гиппокампальной тканях, а также экспрессии AMPA-глутамат рецепторов (AMPAR) в кортикальной и стриарной тканях больных БАР. Другим связующим звеном глутаматергической синаптической функциональности является медикаментозное лечение расстройств настроения. Препараты лития и вальпроата — золотой стандарт лечения БАР — способствуют активации AMPA-глутамат рецепторов (AMPAR), в то время как однонуклеотидные полиморфизмы (SNP — single nucleotide polymorphism), локализованные в GRIA2 и кодирующие субъединицу GluA2 AMPA-глутамат рецепторов, связаны с длительностью периода, предшествующего смене настроения у больных БАР, принимающих препараты лития.
Недавние исследования GWAS (genome-wide association studies — полногеномный поиск ассоциаций), связанные с изучением взаимосвязи между геномными вариантами и разизофрении, БАР и депрессии, подтвердили связь между однонуклеотидными полиморфизмами (SNPs), локализованными в гене SYNE1, и повышенным риском развития БАР. Связанные с БАР импульсы преимущественно возникают в частях SYNE1, кодирующих CPG2. Учитывая важную роль CPG2 в интернализации глутаматных рецепторов, гипотезой исследователей под руководством профессора Недиви являлось то, что генетические вариации CPG2 оказывают последующий эффект на их цитоскелетные/эндоцитотические взаимодействия, тем самым влияя на эффективность глутаматергической передачи. При содействии Центра психиатрических исследований им. Стэнли исследователи провели скрининг гена SYNE1 у группы пациентов и обнаружили дополнительные однонуклеотидные полиморфизмы (SNPs), локализованные в CPG2 локусе SYNE1, что может быть связано с развитием заболевания. С помощью картирования транскриптов данного локуса ученые доказали существование транскриптов cpg2, а также их белковых продуктов в головном мозге.
Количество глутаматных рецепторов на постсинаптической мембране определяет силу возбуждающей нейротрансмиссии путем изменения чувствительности постсинаптической клетки к высвобождению нейротрансмиттера. В данный момент проводятся исследования молекулярных механизмов, регулирующих экспрессию глутамат-рецепторов, с целью изучения возбуждающей синаптической пластичности. Транскрипт cpg2 кодирует белок, локализующийся на постсинаптических шипах возбуждающих нейронов, где регулирует интернализацию глутаматных рецепторов. CPG2 имеет модульную структуру с множественными доменами взаимодействия с белками и вследствие этого функционирует как большой комплекс-адаптер, опосредующий взаимодействие различных синаптических компонентов, участвующих в регуляции циклирования глутаматных рецепторов в синапсе.
Источники:
https://www.medicalnewstoday.com/articles/324147.php
https://nedivilab.mit.edu/research/cpg2/
Источник: medach.pro