Биология старения. Декабрь 2018.
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-01-07 16:00
Сенесценция: антибиотики в роли сенолитиков и апдейт по клиническим испытаниям UNITY Biotechnology.
Тема сенолитиков, безусловно, является одной из ведущих в контексте борьбы со старением. Недавно ученым удалось обнаружить сенолитические свойства известных и одобренных FDA антибиотиков – Азитромицина и Рокситромицина, входящих в группу макролидов.
Изначально исследователи провели скрининг клинически-одобренных препаратов с целью определения тех, которые будут удалять сенесцентные клетки. Для этого были использованы культуры человеческих “нормальных” (здоровых) и сенесцентных фибробластов (сенесценция была вызвана повреждением ДНК с помощью BrdU). Удачными препаратами были выбраны те, которые убивали сенесцентные, но не здоровые клетки. Азитромицин оказался самым селективным препаратом, в то время как Рокситромицин способствовал гибели в том числе и здоровых фибробластов. Эффект двух препаратов был дозозависимым с большей эффективностью при более высокой дозе (100µM по сравнению с 50µM). Важно, что еще один препарат из той же группы макролидов Эритромицин не продемонстрировал сенолитических свойств, что указывает на высокую специфичность Азитромицина и Рокситромицина. Метаболический анализ воздействия Азитромицина показал, что этот препарат запускает аутофагию и гликолиз, а также увеличивает митохондриальную активность при высокой дозе, но обладает противоположным эффектом при низкой дозе.
Важно, что Азитромицин используется для лечения костозного фиброза (воспалительное заболевание легких генетического характера), удаляя про-воспалительные фибробласты, вероятно, сенесцентные, а также защищает мышей от повреждения легких, вызванного радиацией. Рокситромицин же способствует росту волос, вероятно, стимулируя производство стволовых клеток волосяных фоликул, а также обладает более сильными противовоспалительными свойствами, чем Азитромицин и Эритромицин. Таким образом, эти антибиотики являются обнадеживающим способом борьбы с сенесценцией. Однако, не стоит забывать, что эксперименты были проведены на культуре клеток, и препараты пока одобрены только в качестве антибиотиков.
Научная статья: https://www.aging-us.com/article/101633/text
Новостная статья: https://medicalxpress.com/news/2018-11-antibiotics-senescent-cells-ageing.html?fbclid=IwAR2bG9UlHl64epylcstt3gqXWyonSE8cY4ZI5tPvbRZsfzpUyn6uPaeW5e8
В обзоре за июль мы писали о запуске первой фазы клинических испытаний препарата UBX0101, мишенью которого являются сенесцентные клетки, компании UNITY Biotechnology. В декабре же UNITY объявила о дополнительном наборе добровольцев (когорта 6) с целью оценки более высокой дозы препарата в 4 мг. Результаты исследования с участием когорт 1-5 по применению препарата в дозах от 0,1 до 2 мг ожидались в первой четверти 2019 года. Однако, теперь результаты будут включать данные и по когорте 6, и ожидаются во второй четверти 2019. Исследователи полагают, что включение данных по более высокой дозе помогут определить оптимальную дозу для дальнейших исследований.
Метформин и физические упражнения: лучше не смешивать.

Метформин, самый часто выписываемый препарат для людей, страдающих от диабета 2 типа, уже давно привлекает внимание как потенциальное анти-эйджинговое средство. Однако, результаты последнего исследования показывают, что, если вам около 60 и вы регулярно занимаетесь аэробными тренировками, метформин может нивелировать положительный эффект упражнений, и, вероятно, окажется бесполезным для увеличение ПЖ.
Так же как и физические упражнения метформин снижает уровень глюкозы за счет энергетического стресса и/или окислительно-восстановительного механизма в скелетных мышцах и печени. Метформин активирует AMPK для захвата глюкозы и может улучшать чувствительность к инсулину путем снижения производства активных форм кислорода (ингибирование митохондриального дыхания) в скелетных мышцах. Физическая же нагрузка также активирует AMPK, но приводит к повышению производства энергии за счет увеличенного митохондриального биогенеза и дыхания. Неизвестно, приводит ли применение метформина к повышенному митохондриальному биогенезу. Ранее было показано, что метформин и физические упражнения (150 минут средней интенсивности) независимо предотвращают прогрессию от стадии преддиабета к диабету 2 типа. Однако, комбинация из этих двух мер не приводит к аддитивному эффекту. Т.о., авторы исследования решили проверить, не нивелирует ли применение метформина увеличение в кардиореспираторной выносливости и чувствительности к инсулину после 12 недель аэробной нагрузки за счет ингибирования митохондриального дыхания и синтеза белков.
Участники исследования возрастом 62 ± 1 года были разделены на две группы: в течение 12 недель все участники подвергались аэробной нагрузке, но контрольная группа (26 участников) получала плацебо, а экспериментальная группа (27 участников) принимала метформин. В результате в независимости от группы физ.нагрузка способствовала уменьшению жировой массы, гликированного гемоглобина (HbA1c), уровня инсулина плазмы натощак, среднего уровня глюкозы и вариабельности гликемии. Однако, только в контрольной группе было замечено значительное увеличение показателя VO2max. Метформин также ингибировал увеличение как чувствительности к инсулину после физ.нагрузки, так и митохондриального дыхания. Длина теломер увеличилась в обеих группах, разницы в уровне синтеза белков в зависимости от применения или отсутствия метформина обнаружено не было.
Таким образом, метформин нивелировал улучшения общей физиологической функции после 12 недель аэробных упражнений путем снижения митохондриального дыхания без влияния на синтез митохондриальных белков. В связи с этим возникают сомнения о рекомендациях применения метформина в качестве препарата против старения. А вот от физических упражнений посоветуем не отказываться, учитывая их системное воздействие на процесс старения.
Научная статья: https://onlinelibrary.wiley.com/doi/10.1111/acel.12880
Конечные продукты гликирования: роль в старении межпозвонковых дисков.
В обзоре за октябрь мы писали о том, как диета с высоким содержанием конечных продуктов гликирования (AGEs) пагубно влияет на состояние различных тканей организма. В новом исследовании ученые выяснили, что такая диета приводит к образованию сшивок и повреждений коллагена межпозвонковых дисков, что способствует их дегенерации.
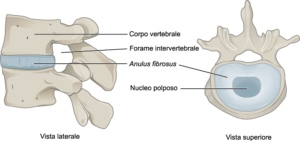
Исследование проводилось на мышах (21 самки и 23 самца). Как самки так и самцы были разделены на две группы: одна следовала диете с низким содержанием AGEs, другая – с высоким (на 80% больше, чем первая; аналогична западной диете типа курицы из Макдональдс). В результате у самок, но не у самцов, наблюдалось значительно увеличенное количество как циркулирующих AGEs (на 80%) так и накопленных внутри межпозвонковых дисков (на 150%). У самок на диете с высоким содержанием AGEs также наблюдалась повышенная жесткость при сжатии дисков и повреждение коллагена из-за образования поперечных сшивок. Вероятно, разница в результатах между самками и самцами объясняется тем, что эстроген взаимодействует с AGE рецепторами, эту гипотезу нужно будет проверить в будущих исследованиях. Важно, что ранее исследователи также показали, что экзогенные AGEs влияют на механические характеристики костей самок, опять же указывая на разницу в метаболизме мышей разного пола.
Учитывая, что дегенерация межпозвонковых дисков – важный фактор появления боли в нижнем отделе спины, что глобально является ведущей причиной недееспособности, важно понять причины этого процесса. Переводя результаты данного исследования на людей, можно сделать вывод о том, что диета с низким содержанием AGEs (уменьшение количества сахара и жареных в частности мясных продуктов) – один из возможных способов замедлить разрушение межпозвонковых дисков, особенно для женщин. Этот совет особенно пригодиться в период новогодних праздников
Научная статья: https://www.ncbi.nlm.nih.gov/pubmed/30498097
Иммунная система: корректировка изменений в метаболизме для борьбы со старением.

Известно, что старение приводит к нарушению функций иммунной системы, в частности Т-лимфоцитов, что обуславливает пониженный ответ на вакцинацию и повышенный риск инфекционных заболеваний среди пожилых людей. В связи с этим интерес представляет разработка методов укрепления иммунитета путем воздействия на Т-лимфоциты. В новом исследовании ученые разобрались с изменениями, происходящими в этих клетках с возрастом, и попробовали их скорректировать для улучшения функциональности Т-лимфоцитов.
Что было известно ранее: в ответ на инфекцию Т-лимфоциты активно делятся и дифференцируются в специализированные субпопуляции для запоминания и будущего ответа на патогены. С возрастом происходит сокращение пула наивных Т-лимфоцитов (не специализированных) и нарушение активации этих клеток в ответ на инфекцию. Сигнальный путь известный как митохондриальный метаболизм одного углерода (mitochondrial one-carbon metabolism – серия химических реакций
метаболизма аминокислот и нуклеотидов с участием переноса групп, содержащих один углерод) является одним из центральных путей активации Т-лимфоцитов. Как именно старение влияет на метаболизм Т-лимфоцитов, в частности к каким изменениям в пути метаболизма одного углерода оно приводит, понятно не было.
Новые данные: на Т-лимфоцитов, взятых у старых и молодых мышей было показано, что при активации в молодых Т-лимфоцитах запускается митохондриальный биогенез и повышенное дыхание, в то время как старые Т-лимфоциты генерируют меньшие митохондрии и отличаются пониженной дыхательной способностью. Протеомный анализ показал, что экспрессия 150 белков была понижена (включая белки воспаления и иммунной реакции), а 40 белков повышена в старых клетках по сравнению с молодыми. В старых Т-лимфоцитов наблюдались изменения в метаболизме глюкозы, возможно, из-за пониженного уровня ее захвата, и жиров. Протеомный анализ митохондрий показал, что в старых Т-лимфоцитов путь метаболизма одного углерода был активирован на ~35% меньше по сравнению с молодыми клетками. Однако, добавление метаболитов этого пути, формата и глицина, в среду культуры старых Т-лимфоцитов улучшило выживаемость, рост и функционирование клеток.
Таким образом, корректировка изменений метаболизма Т-лимфоцитов с возрастом может оказаться успешной интервенцией для улучшения функционирования иммунной системы в пожилом возрасте. Дополнительные исследования необходимы для подтверждения механизмов старения Т-лимфоцитов у людей и проверки потенциальных терапий.
Научная статья: https://www.pnas.org/content/115/52/13347
Новостная статья: https://www.leafscience.org/one-carbon-metabolic-pathway-implicated-in-age-related-immunosenescence/
Стволовые клетки: трансплантация для борьбы с одряхлением и пчелиный белок, поддерживающий плюрипотентность клеток млекопитающих.
Были опубликованы результаты I и IIа фаз клинических исследований под названием CRATUS для оценки безопасности и эффективности внутривенной доставки мезенхимальных стволовых клеток, взятых из костного мозга доноров, для лечения пациентов со старческим одряхлением.
Старение ведет за собой целый ряд симптомов таких, как потеря мышечной массы, силы, выносливости, баланса, снижение скорости ходьбы, активности и энергичности, что в целом получило название одряхления. Существует несколько шкал для определения уровня одряхления, с помощью которых было показано, что уровень одряхления увеличивается с 3,9% у людей в возрасте 65-74 до 25% в возрасте старше 85 лет. По оценкам женщины страдают от одряхления больше, чем мужчины (8% по сравнению с 5%). Пожилые люди с одряхлением более подвержены риску развития сердечно-сосудистых заболеваний, а также демонстрируют повышенный уровень хронического воспаления. С возрастом наблюдается нарушение производства и функций стволовых клеток, что, вероятно, является одной из причин одряхления.
Исследования показали потенциал применения мезенхимальных стволовых клеток для борьбы с одряхлением за счет выделения ими противовоспалительных и иммуномодулирующих молекул. Возможно, такого же эффекта можно добиться, применяя не сами клетки, а экзосомы (внеклеточные везикулы), выбрасываемые этими клетками. В новом обзоре, например, обсуждается потенциал применения экзосом стволовых клеток не только для контроля воспаления, но и заживления ран и омоложения кожи. Правда, на данный момент, существует ряд проблем, в том числе технических, для разработки терапий, основанных на применении экзосом.
В результате клинических исследований CRATUS была определена оптимальная доза мезенхимальных стволовых клеток в 100 миллионов для улучшения физических способностей пациентов с одряхлением. Данная терапия также привела к снижению уровня системного воспаления и иммунного ответа, и увеличению объема форсированного выдоха (параметр оценки функции легких). Следующим шагом является проведение исследований с многоразовым вливанием клеток и более продолжительным периодом наблюдения, а также с большим количеством пациентов (фаза IIb).
Научная статья: https://www.frontiersin.org/articles/10.3389/fnut.2018.00108/full
Новостная статья: https://www.leafscience.org/stem-cell-therapy-for-aging-frailty/

Королевское желе давно интересует исследователей ввиду его эффективности для увеличения ПЖ, фертильности и регенерации млекопитающих. Королевское желе – это корм, которым питается пчелиная матка (королева) Apis mellifera на протяжение всей жизни (в отличии от рабочих пчел, которые питаются им только на стадии личинки), что, по всей видимости, обуславливает удивительную разницу в фенотипе королев и рабочих.
Ученые из Стенфорда выяснили, что один из компонентов королевского желе, белок Ройялактин (Major Royal Jelly Protein 1 или MRJP1), поддерживает состояние плюрипотентности стволовых клеток (способность дифференцировать в любой тип) за счет активации определенной сети генов путем модуляции доступности хроматина.
Сначала исследователи добавили Ройялактин в среду культуры эмбриональных клеток мышей. Это предотвратило дифференцировку клеток, что происходит в отсутствие Ройялактина. Далее они проверили in vivo поведение клеток, подвергшихся воздействию Ройялактина in vitro и привитых подкожно мышам. В результате в течение 6 недель после прививки у мышей образовались тератомы – опухоли, состоящие из клеток разных тканей, что свидетельствует о сохраненной плюрипотентности клеток. Далее с помощью метода секвенирования РНК было показано, что экспрессия генов, участвующих в поддержании плюрипотентности была повышена, а способствующих дифференцировке понижена в клетках, подверженных воздействию Ройялактина. Наконец, ученым удалось выделить белок млекопитающих, структурно (но не последовательно) похожий на Ройялактин под названием NHLRC3, который они затем переименовали как Реджина (от лат. “королева”) в связи с эволюционно сохраненной функцией этого белка в поддержании плюрипотентности клеток мышей, как было в дальнейшем показано в экспериментах.
Теперь перед учеными стоит задача по детальному разбору механизмов поддержания плюрипотентности белком Ройялактином и его структурным аналогом Реджиной для разработки методов регенеративной медицины.
Научная статья: https://www.nature.com/articles/s41467-018-06256-4
Новостная статья: http://med.stanford.edu/news/all-news/2018/12/honeybee-protein-keeps-stem-cells-youthful.html
Всё дело в генах.
Влияние температуры на продолжительность жизни (ПЖ) коловраток.

Наряду с более известными беспозвоночными такими как мушка дрозофила и червяк С.elegans коловратки уже давно выступают в качестве модельных организмов для изучения биологии старения. Ранее на этих многоклеточных микроскопических животных, обитающих в основном в пресной воде и живущих в среднем 2 недели, были исследованы эффекты сокращения калорий, применения антиоксидантов и изменения температуры окружающей среды на ПЖ. В новом исследовании ученые показали, что понижение температуры окружающей среды по-разному влияет на ПЖ генетически отличающихся линий коловраток. Ранее общепринятым объяснением увеличения ПЖ при более низких температурах основывалось на чисто термодинамическом принципе: низкие температуры замедляют скорость химических реакций (метаболизма), что приводит к более медленному накоплению повреждений и увеличению ПЖ. Такое объяснение, однако, подверглось сомнению на основе данного и ранее проведенных исследований на других модельных организмах.
Исследователи наблюдали за ПЖ 11 линий коловраток группы видов Brachionus при температуре 21°C и 16°C. Из них медианная ПЖ при 16°C по сравнению с 21°C увеличилась от 6% до 100% в 9 линиях, уменьшилась на 9% в 1 линии и не изменилась в 1 линий. Максимальная ПЖ увеличилась у всех линий, но опять же с высокой вариативностью от 26% до 110%. Ранее эта же группа ученых выяснила, что ограничение калорий также привела к большой вариативности в изменении ПЖ разных линий. Некоторым линиям удалось увеличить ПЖ как при снижении температуры, так и при ограничении калорий. ПЖ некоторых же линий не изменилась ни при одном из данных интервенций. В то же время не наблюдалось корреляции между ответом на обе интервенции в 8 линиях. Несмотря на это, удалось достичь снижения уровня смертности при 16°C во всех линиях, а также продлить репродуктивный период в большинстве из них (продлить период здоровой жизни – healthspan).
Это говорит о том, что один и тот же стимул (будь это изменение температуры или ограничение калорий) приводит к разному результату в зависимости от генотипа индивидуумов. Если проводить аналогию с людьми, то можно сделать вывод о важности персонализации интервенций для их успешного применения с целью увеличение ПЖ.
Научная статья: https://www.sciencedirect.com/science/article/pii/S0531556518305011?via%3Dihub
Новостная статья: https://www.sciencedaily.com/releases/2018/12/181210171847.htm
Секреты долголетия гигантских черепах.

Гигантские черепахи относятся к животным-долгожителям – по некоторым оценкам их ПЖ превышает 100 лет. В связи с этим они представляют особый интерес для изучения механизмов, обуславливающих высокую ПЖ, в том числе для определения генов долгожительства.
В новом исследовании ученые проанализировали геномы Одинокого Джорджа, последнего представителя вида абингдонских черепах Chelonoidis abingdonii, и исполинской черепахи Aldabrachelys gigantea. Неудивительно, что на основе сравнительного геномного анализа удалось выявить многочисленные гены, влияющие на различные составляющие процессы старения.
Во-первых, были обнаружены дупликации генов, участвующих в репарации ДНК, таких как NEIL1 и RMI2. Во-вторых, был обнаружен вариант гена DCLRE1B, который участвует в поддержке теломер. В-третьих, были выявлены изменения в генах белков, участвующих в протеостазе (совокупность процессов, контролирующих протеом клетки), например, гене EEF1A1. В-четвертых, наличие не функционирующего гена NLN может указывать на улучшенное усвоение глюкозы. В-пятых, определенные варианты генов таких как NLN и ALDH2 могут защищать черепах от ранней дисфункции митохондрий. Наконец, наличие вариантов генов, влияющих на межклеточную коммуникацию, таких как ITGA1, MIF и IGF1R указывает на пониженный уровень воспаления и изменения внутриклеточных сигнальных путей.
Более того ученые выяснили, что гигантские черепахи обладают дополнительными копиями генов, участвующих в усилении иммунного ответа, что помогает им бороться с патогенами и подавлять рост раковых опухолей.
Таким образом, это исследование проливает свет на генетические составляющие долгожительства гигантских черепах и еще раз подтверждает необходимость многостороннего подхода к проблеме старения людей.
Научная статья: https://www.nature.com/articles/s41559-018-0733-x
Новостная статья: https://ivao.com/news/science-and-medicine/sekret-cherepashego-dolgoletiya/
Секреты долголетия попугаев.

Еще одним долгожителями, только уже среди птиц, являются попугаи, возраст которых в неволе может достигать 90 лет, а также отличающихся развитыми когнитивными и вокально- коммуникативными способностями. В новом исследовании ученые опять-таки проанализировали геном синелобого амазона (Amazona aestiva) и провели сравнительный анализ с 30 другими видами птиц, включая 4 вида попугаев. Ученые выделили как значительное число специфичных для попугаев генов (которые отсутствуют у других животных), так и характерные для попугаев изменения в кодирующих и регуляторных последовательностях генов, в том числе ассоциированных с ПЖ.
Для выявления генов, влияющих на ПЖ, ученые проанализировали 23 вида птиц, разделив их на долгоживущих (в эту группу вошли не только попугаи) и птиц с обычной ПЖ. Часть выделенных генов и ранее была ассоциирована с ПЖ других модельных организмов, в то время как большая часть генов включает новые гены-кандидаты, влияющие на ПЖ. Функционально эти гены характеризуются их участием в процессах деления клетки, регуляции клеточного цикла, РНК сплайсинга, ДНК репарации, митохондриальной функции и окислительного метаболизма.
Одним из механизмов, например, является повышенная активность обратной транскриптазы теломеразы, которая защищает теломеры ДНК от укорачивания и клетки от сенесценции. Однако, это чревато повышенной пролиферацией клеток и образованием опухоли. У долгоживущих птиц эта проблема решается наличием генов, позволяющих строго контролировать цикл клетки. Вцелом новые гены-кандидаты, связанные с высокой ПЖ птиц, могут пролить свет на возможные цели для манипуляции с целью увеличения ПЖ человека.
Научная статья: https://www.cell.com/current-biology/fulltext/S0960-9822(18)31417-9
Новостная статья: https://www.sciencedaily.com/releases/2018/12/181206114829.htm
Секреты долголетия летучих мышей.

Еще одним родом животных, генетика которых позволяет им защищать теломеры от укорачивания c возрастом, и, по-видимому, гарантирует долгожительство, является род короткоухих летучих мышей (Myotis). Ранее было показано, что, несмотря на длинные теломеры рак у летучих мышей наблюдается крайне редко. В новом исследовании было показано, что ключевую роль в этом процессе играет, однако, не теломераза, а гены, участвующие в репарации ДНК и альтернативном способе удлинения теломер (ALT).
Основой исследования стали наблюдения за четырьмя дикими популяциями долгоживущих летучих мышей на протяжении более 60 лет. Целью исследования было определить происходит ли укорочение теломер этих животных с возрастом, что лежит в основе динамики теломер, а также как это влияет на их долгожительство. Для этого у пойманных летучих мышей была взята биопсия ткани крыльев, выделена ДНК и проведена количественная ПЦР для определения длины теломер. У двух видом рода Myotis не было выявлено корреляции между возрастом и длины теломер в отличие от остальных двух видов летучих мышей и, как известно, других млекопитающих. Также не была обнаружена экспрессия теломеразы в крови и фибробластах представителей Myotis, что говорит об альтернативном пути удлинения теломер.
Далее было установлено, что 21 ген, участвующих в поддержании теломер, экспрессируются по-разному у Myotis и других млекопитающих. 20 из них характеризуются повышенной экспрессией, включая ATM и SETX, которые участвуют в починке и предотвращении поломки ДНК, и один (TEN1) – пониженной, что опять указывает на механизм ALT.
Будущие исследования должны быть направлены на подтверждение, является ли ALT ключевым способом поддержания длины теломер летучих мышей Myotis. На данный момент этот механизм был замечен только в аномальных условиях (при раке). Если же ALT действительно ответственен за необычно длинные теломеры летучих мышей, но не приводит к онкообразованиям, стоит присмотреться к этому механизму как потенциально успешному для интервенций с целью увеличения ПЖ людей.
Научная статья: http://advances.sciencemag.org/content/4/2/eaao0926
Новостная статья: https://interestingengineering.com/can-bats-live-forever-a-new-study-reveals-the-secret-behind-bats-longevity
Автор обзора: Лариса Шелоухова
Перепечатка разрешается при сохранении ссылок на источник публикации
Источник: ir.unitybiotechnology.com