Определены мозговые схемы компульсивной наркомании
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2018-12-27 17:00
Ученые описали нейробиологический механизм, который может объяснить, почему некоторые наркоманы продолжают употреблять наркотики, несмотря на негативные последствия.
В эксперименте трансгенные мыши могли стимулировать собственные дофаминовые нейроны, при этом получая удар током. В итоге популяция разделилась на тех, кто не стал терпеть боль ради дофаминового всплеска, и тех, кто «плакал, кололся, но продолжал есть кактус».
Было показано, что у мышей, которые готовы терпеть боль ради удовольствия, усилилась синаптическая связь между орбитофронтальной корой (OFC), областью, участвующей в принятии решений, и дорсальным стриатумом, отвечающим за целенаправленное поведение. С помощью методов оптогенетики ученые сымитировали вызванную наркотиками синаптическую нейропластичность. Они смогли контролировать компульсивное поведение мышей, уменьшая или увеличивая силу связи между OFC и дорсальным стриатумом. Пока неясно, почему генетически гомогенная популяция мышей разделилась на отказавшихся от удовольствия и стремящихся к награде несмотря ни на что, однако известно, что стимулируемые наркотиками дофаминовые нейроны не связаны непосредственно с OFC и дорсальным стриатумом. Поэтому вероятно именно различия в мультисинаптических связях между этими регионами мозга у разных мышей определяют склонность к компульсивному поведению.
Исследование на мышах определяет адаптацию мозга, которая лежит в основе компульсивного поведения, связанного с наркоманией, и которая может объяснить, почему некоторые потребители наркотиков ведут себя навязчиво, в то время как другие нет.
Злоупотребление препаратами оказывает комплексное Фармакологическое действие, которое вызывает многочисленные изменения функции мозга. Один из этих эффектов, прямая или косвенная активация нейронов, которые выделяют нейромедиатор допамин, является общим для всех наркотиков злоупотребления и уже давно считается способствовать развитию зависимости. Пишу в природе, Пасколи и соавт.Один отчет о нейробиологических механизмов, вызванные повторной активации дофаминовых нейронов, что может объяснить, почему некоторые наркоманы ищут награду, несмотря на негативные последствия — вид навязчивого поведения, что является определяющей чертой человека наркомания2.
Авторы использовали оптогенетический подход, чтобы имитировать активацию дофаминовых систем мозга препаратами злоупотребления: они использовали лазерный свет, подаваемый через оптическое волокно, для активации дофаминовых нейронов в вентральной тегментальной области (ВТА) мозга генетически модифицированных мышей. Мыши могли непосредственно стимулировать эти нейроны, нажимая на рычаг, и выполняли это действие жадно в течение 40 минут в день в течение почти 2 недель.
В последующие дни мыши получили кратковременный удар током по их ногам в одной трети случаев нажатия рычага, в случайном порядке. Их поведение в этом состоянии выявило интригующую изменчивость: 40% мышей (именуемых ренунцерами) значительно уменьшили частоту нажатия рычага при заданных толчках стопы (Рис . 1А), тогда как остальные 60% (настойчивые) были готовы получить мучительное наказание за возможность самостоятельно стимулировать свои нейроны допамина (Рис.1а). 1b). Как некоторые из этих авторов уже показано3, настойчивые мыши обеспечивают модель для упорного употребления наркотиков, несмотря на негативные последствия, и параллельно подмножество потребителей наркотиков человека, чье употребление наркотиков становится компульсивным.
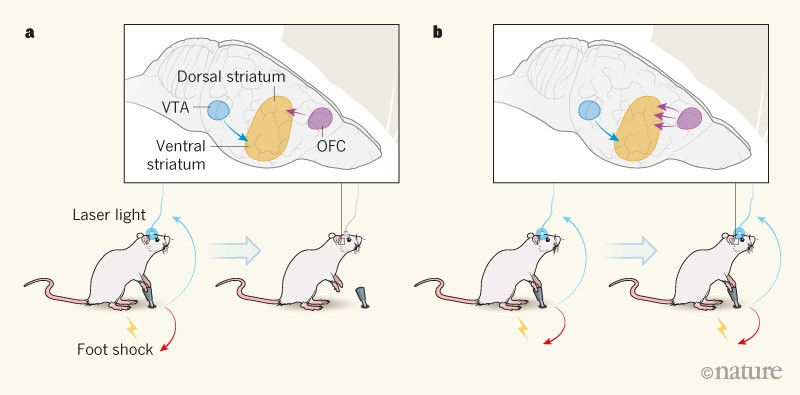
Рисунок 1 / Компульсивная активация нейронов дофамина в головном мозге. В исследовании Пасколи и соавт.1, мыши нажал на рычаг, чтобы активировать допамин-выпуская нейронов посредством доставки лазерного излучения проводится с помощью оптического волокна. Эти нейроны, которые проецируют от вентральной области tegmental (VTA) к вентральной striatum в мозге, связаны с вознаграждением. один Некоторые мыши, называемые renouncers, снижали давление рычага, когда это было связано с болезненным электрическим током на их ногах. У этих мышей сила связей между нейронами орбитофронтальной коры головного мозга (OFC), выступающей к дорсальной полосе, была низкой. б, Другие мыши, называемые упорными, продолжали нажимать на рычаг, несмотря на наказание-признак компульсивного поведения. Нейронные связи между OFC и дорсальной полоской были сильнее у этих мышей, чем у renouncers. Когда авторы ослабили эти связи у настойчивых мышей, компульсивное поведение животных уменьшилось (не показано).
Далее авторы попытались определить, чем отличаются мозги персеверов и ренонсеров. Они измеряли активность нейронов, соединяющих различные области мозга в реальном времени, чтобы определить, какие сети были активны, когда мыши нажимали на рычаг. Связь между орбитофронтальной корой (OFC), областью, участвующей в принятии решений, и дорсальной полосой, которая занимается добровольным действием, увеличивалась до нажатия рычага у мышей, которые были готовы получить удары вместе с дофаминовой самостимуляцией. Оптогенетическое ингибирование этого нейронного пути превратило настойчивых мышей в отказ от мышей. Этот вывод показывает, что для этой формы компульсивной активации дофаминовых нейронов была необходима повышенная активность нейронов, выступающих из ОФК в дорсальную полосу.
Однако, этот поведенческий переключатель был только временным: когда было выключено ингибирование оптогенетики, у персистирующих мышей возобновилось компульсивное поведение. Авторы обосновали, что длительные изменения в синапсах-соединениях между нейронами — которые соединяют OFC и дорсальные стриатумные нейроны, могут возникнуть в результате многих дней самостимуляции дофаминовых нейронов. Если бы эти изменения произошли только у настойчивых мышей, это объяснило бы их стойкое компульсивное поведение.
Если эта гипотеза верна, сила синаптических связей между OFC и дорсальными нейронами стриатума должна быть больше у персеверов, чем у ренонсеров, что позволяет лучше активировать дорсальные нейроны стриатума нейронами OFC. Действительно, Пасколи и соавт. далее было показано, что сила синапсов между нейронами OFC и нейронами дорсального стриатума у устойчивых мышей увеличилась (Рис. 1). Renouncers, наряду с мышами, которые никогда не подвергались экспериментальной установке, и мышами, которые получили удары, но не могли использовать рычаг, все показали низкую синаптическую силу между нейронами ОФК и дорсального стриатума.
Примечательно, что авторы обнаружили, что компульсивное поведение может быть подавлено или индуцировано соответственно уменьшением или увеличением прочности этой нейронной связи. Ослабление синаптических связей между ОФК и дорсальной полоской у настойчивых мышей уменьшило их Готовность к самостимуляции перед лицом возможного шока стопы. И наоборот, renouncers могут быть превращены в perseverers путем увеличения прочности этих синаптических соединений. В отличие от временного реверсирования, наблюдаемого после оптогенетического ингибирования нейронов ОФК, проецирующих на дорсальную полосу, эти изменения в синаптической силе вызвали поведенческий переключатель, который сохранялся в течение шести дней.
Пасколи и соавт. обнаружили neuroadaptation, что позволяет мыши, чтобы переопределить болезненный стимул продолжить активацию дофаминовых нейронов. Хроническое потребление наркотических средств у человека приводит к повторной активации одной и той же схемы дофамин-подкрепления, поэтому подобная нейроадаптация может привести к тому, что они будут продолжать принимать наркотики, несмотря на негативные последствия. Чтобы проверить это предположение, мы должны определить, являются ли изменения в силе связей между OFC и дорсальными нейронами стриатума опосредованным компульсивным поведением у мышей, нажимающих рычаг для получения кокаина, амфетаминов или опиоидов перед лицом возможного шока стопы.
Точно ли оптогенетическая стимуляция дофаминовых нейронов имитирует активацию дофаминовых нейронов препаратами злоупотребления? Существуют очевидные различия между быстрым включением и выключением лазера во время оптогенетической стимуляции и более медленным началом и более длительным действием препарата. Тем не менее, авторы ранее показали4 , что потребление кокаина и оптогенетики активации вызывают практически идентичные изменения в дофаминовых нейронов и их ближайших нисходящих целей, обеспечивая прочное обоснование экспериментальный подход, используемый в данной работе.
Почему самостимуляция нейронов допамина приводит к компульсивному поведению только у подмножества людей? Упорство и отказ от мышей самостимулировалось примерно в одно и то же время и с таким же количеством событий до того, как начались удары ног, но мозги двух групп, похоже, изменились в разных направлениях. Нейроны дофамина VTA, стимулируемые мышами, не соединяются непосредственно с OFC или дорсальной полосой, поэтому связь между этими областями должна включать несколько синаптических соединений. В multisynaptic маршрут, по которому активация ВТА дофаминовых нейронов могут вызывать изменения в дорсальном стриатуме ранее были описаны5, и был предложен лежат в основе переходов от номера-навязчивое компульсивное влечение к наркотикам6,7. Ранее существовавшие различия в этой мультисинаптической цепи могут объяснить, почему компульсивное поведение и связанные с ним изменения в синаптических соединениях происходят только у некоторых мышей.
Синаптические изменения могут длиться дни, годы или даже всю жизнь. Возможно, изменения, обнаруженные Пасколи и соавт. формируют основу устойчивых изменений в поведении, которые являются отличительной чертой наркомании? Для решения этого вопроса потребуются экспериментальные доказательства того, что, несмотря на негативные последствия, самолечение наркотиков происходит путем укрепления связей между OFC и дорсальной полосой, и что именно активация дофаминовых систем приводит в движение цепочку нейронных событий, которая приводит к компульсивному принятию наркотиков.
Источник: www.nature.com