Биология старения. Обзор за ноябрь 2018
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2018-12-04 11:00

NAD+: новые данные исследований на людях и червях
Ранее было показано, что с возрастом происходит снижение уровня NAD+, и, как мы писали ранее, уже было предложено несколько способов его повышения. На данный момент, однако, непонятно, происходит ли данный процесс за счет сниженного производства или повышенного потребления. Понимание динамики метаболома NAD+ поможет для оценки разного вида вмешательств, будь то режим питания, фармакологические методы и прочие. Поэтому исследователи решили провести анализ изменения метаболома NAD+ с возрастом.
Ученые провели маломасштабное исследование на 30 здоровых добровольцах в возрасте от 20 до 87 лет для выявления изменений концентраций метаболитов NAD+ в плазме крови с возрастом. Результаты показали, что с возрастом наблюдается значительное снижение уровня NAD+, NADP+, NAAD и других метаболитов в плазме крови. В то же время наблюдалось увеличение концентрации таких метаболитов как NADPH и NAM. Концентрация же некоторых метаболитов не изменилась с возрастом (NA, NMN, NAMN). Исследователи сделали следующие выводы на основе данного исследования: уровень NAD+ резко снижается в плазме крови с возрастом, внеклеточный NAD+ является доступным (может проникать внутрь клетки), надежные измерения концентрации метаболитов NAD+ помогут в разработке стратегии повышения концетрации NAD+ с помощью его предшественников и/или ингибиторов CD38 (гликопротеин, важнейший регулятор пула NAD+) таких как апигенин.
Новостная статья: https://www.leafscience.org/the-plasma-nad-metabolome-is-dysregulated-during-aging/
Научная статья: https://www.liebertpub.com/doi/10.1089/rej.2018.2077?fbclid=IwAR3EloIozW_pDGmijW_zObYGBnslSTEnhRpMo17HSFy75AH9q8mvjun0-3A&
В то время как результаты предыдущей исследования дополняют уже известные данные об изменениях в метаболизме NAD+, в исследовании, речь о котором пойдет дальше, ученые продемонстрировали ранее неизвестную роль фермента, участвующего в синтезе NAD+под названием NMAT-2 (принадлежит группе ферментов NMNAT), а именно – подавление регенерации аксона.
Регенерация аксона после травмы – важный биологический процесс, в котором участвует большое количество генов и молекулярных путей в том числе по реструктуризации цитоскелета и реорганизации внеклеточного матрикса нейрона. Во взрослой центральной нервной системе млекопитающих способность регенерации аксонов ограничена, что мешает функциональному восстановлению после травмы. Червь C. elegans, однако, обладает способностью функционально регенерировать аксон, ранее были выявлен ряд генов и путей, задействованных в этом процессе. В новом исследовании ученые выявили несколько генов обуславливающих или ингибирующих регенерацию аксонов. К последним в том числе относится как фермент NMAT-2, так и сам NAD+. Известна нейропротекторная функция NMNAT у мушек Drosophila и мышей. Исследователи делают вывод о том, что механизмы, лежащие в основе этих двух функций (нейропротекция и ингибирование регенерации аксонов) различны. Отмечается, что NMAT-2 действует как в нейронах так и в других клетках для ингибирования регенерации аксонов, также для этого процесса необходима именно ферментативная активность NMAT-2 (белки NMNAT также выполняют функцию шаперонов).
В статье также говорится о роли компонентов и регуляторов внеклеточного матрикса, мембранном транспорте, белков цитоскелета в регенерации аксонов. Понимание механизмов молекулярных ответов на травму поможет в разработке методов стимулирования регенерации в будущем.
Научная статья: https://elifesciences.org/articles/39756?
Физетин и куркумин: природные сенолитики в роли геронейропротекторов

Возраст – самый значимый фактор риска развития многих заболеваний, в том числе и нейродегенеративных, таких как болезнь Альцгеймера (БА). Один из подходов к лечению возраст-зависимых заболеваний (ВВЗ) является разработка препаратов, направленных непосредственно на процесс старения. Такие вещества получили название “геропротекторы”, т.е. вещества, замедляющие старение и увеличивающие ПЖ модельным организмам. На настоящий момент известно около 200 веществ, продлевающих ПЖ дрожжам, мухам, червям. Анализ воздействия этих компонентов указывает на важность определенных молекулярных путей для продления жизни, например, 5’АМФ-активируемая протеинкиназа (АМPK) и мишень рапамицина (mTOR). Эти пути присутствуют во всех клетках организма, соответственно непонятно замедляют ли геропротекторы старение путем воздействия на весь организм или на определенные ткани.
В новом исследовании ученые выделили набор веществ (геронейропротекторы, GNPs), способных преодолеть гематоэнцефалический барьер, и в дополнение к общему воздействию на организм в частности замедлить старение мозга. В результате первичного скрининга среди компонентов натурального происхождения были отобраны физетин и куркумин. Их синтетические производные, CMS121 и CAD31, J147 соответственно, являются более сильнодействующими, и успешность их применения уже была показана на животных моделях БА: они способствуют улучшению памяти, снижению воспаления, поддержанию синапсов и удалению токсических амилоидных пептидов. Как и ожидалось, эти вещества воздействуют на сигнальные пути “старения” (в том числе упомянутые ранее), которые также возможно модифицировать ограничением калорий, применением метформина или рапамицина. Напомним, что ранее мы также писали о сенолитических свойства как физетина так и куркумина.
Следующим этапом для исследователей является испытания на безопасность данных компонентов для дальнейшего применения людьми. CMS121 находится на стадии проверки на токсичность на животных, а клинические исследования J147 планируется начать в 2019 году.
Новостная статья: https://www.leafscience.org/fisetin-and-curcumin-appear-to-have-anti-aging-properties/
Научная статья: https://www.cell.com/trends/pharmacological-sciences/fulltext/S0165-6147(18)30178-0
Высокая длина теломеров и низкая концентрация ? амилоида ассоциируется с более здоровым старением

В новом исследовании ученые попытались оценить прогнозирующую способность некоторых известных биомаркеров возрастных когнитивных расстройств с целью их дальнейшего использования для детектирования кандидатов на здоровое или обремененное болезнями старение.
Для пилотного исследования были отобраны 58 человек старше 90 лет: 20 испытуемых в группе здоровых (без каких-либо неврологических заболеваний), средний возраст которых составил 92,37 лет, и 38 испытуемых в группе больных (с когнитивными или моторными нарушениями), средний возраст которых составил 94,13 лет. Группы сравнивали по следующим параметрам, ассоциированных с менее здоровым старением и /или когнитивным расстройством: длина теломер мононуклеарных клеток периферической крови (PBMC), циркулирующих в крови бета-амилоидов и антител к бета-амилоидам, генотип аллеля ApoE (главный генетический фактор риска БА).
Здоровые испытуемые отличались значительно более длинными теломерами и меньшей концентрацией циркулирующих бета-амилоидов. Они также продемонстрировали более высокий уровень антител к одному из бета-амилоидов, но разница была незначительной, хотя может указывать на защитный механизм против когнитивного нарушения. Зависимости от статуса ApoE выявлено не было. В результате исследователи предлагают “Комплексную шкалу неврологически здорового старения” на основе длины теломер и концентрации бета-амилоида Ab40 в плазме (TP40), именно комбинация этих двух параметров имела наибольшую дискриминирующую способность между двумя группами. Следующим шагом является проверка полученных данных на большей выборке и внедрение шкалы с превентивной целью.
Научная статья: https://www.frontiersin.org/articles/10.3389/fnagi.2018.00380/abstract
Систематический эффект физических упражнений для замедления старения

Многочисленные исследования подтверждают положительный эффект регулярных физических упражнений на состояние здоровья и замедление старения. Молекулярные механизмы, лежащие в основе этого процесса, однако, не так хорошо неизвестны. В недавно опубликованном обзоре суммированы результаты последних исследований, проливающих свет на основы систематического влияния физической нагрузки на старение как систематический процесс.
Для начала стоит отметить, что для оценки физической подготовки, независимого предиктора смертности, используется такой показатель как максимальное потребление кислорода (VO2 max), увеличение которого снижает смертность. По всей вероятности, это обусловлено улучшением функций митохондрий.
Физические упражнения на выносливость увеличивают массу митохондрий в скелетных мышцах, мозге, сердце, печени и почках, а также содержание митохондриальной ДНК в яичках старых мышей. В результате таких упражнений усиливается митохондриальный биогенез за счет повышенной транскрипции необходимых генов, кодируемых в ядре клетки, а также происходит нормализация митохондриальных сетей за счет их ремоделирования путем устранения поврежденных митохондрий и гипер-фрагментации, наблюдаемой с возрастом.
Ранее было показано, что сиртуины (SIR) играют важную роль в старении и адаптации к ограничению калорий и физической нагрузке. В частности речь идет о SIR3, который расположен в митохондриях. Он контролирует метаболизм углеводов и жиров, а также активирует фермент SOD2, восполняющий пул NADPH. Уровень SIR3 в гиппокампе, скелетных мышцах, печени и сердце увеличивается в результате физических упражнений, что приводит к снижению производства активных форм кислорода (ROS).
Производство ROS, скорость удаления ROS антиоксидантной системой, а также эффективность починки оксидативных повреждений суммарно носит название системы “домашнего хозяйства” клетки (cellular housekeeping system). Физические упражнения увеличивают активность этой системы за счет повышения активности протеасом (важнейшей системы деградации поврежденных белков), Lon протеазы (системы деградации поврежденных белков митохондрий), онко супрессора p53, аутофагии и митофагии, а также ферментов починки ДНК.
Таким образом, физические упражнения запускают целый ряд молекулярных механизмов, с помощью которых можно замедлить старение. Некоторые из этих же механизмов обусловливают увеличение ПЖ при ограничении калорий.
Научная статья: https://www.sciencedirect.com/science/article/pii/S0891584918322731?
Сенесцентные клетки: чем больше, тем хуже
C возрастом происходит накопление сенесцентных клеток в различных тканях организма, что ассоциировано с развитием возраст-зависимых заболеваний. В предыдущих исследованиях уже было показано, что сенесцентные клетки могут вызывать сенесценцию соседних клеток, вероятно, благодаря экспрессируемым факторам SASP. В новом исследовании ученые решили проверить насколько выражен этот эффект in vivo.
Для этого они трансплантировали сенесцентные клетки (фибробласты человека) в скелетные мышцы и кожу взрослым мышам с дефицитом иммунной системы (NSG мыши) 3 раза с интервалом в 1 неделю. В результате спустя 3 недели после последней трансплантации соседние с местом инъекции клетки характеризовались сенесцентным фенотипом: они экспрессировали биомаркеры сенесценции и демонстрировали измененную морфологию. Цепная реакция распространения сенесценции, однако, была локальной. Авторы замечают, что в дополнение к SASP такие факторы как различные белки, окисленные жиры и активные формы кислорода, выбрасываемые сенесцентными клетками, могут участвовать в этом процессе.
Исследователи также сравнили скорость накопления сенесцентных гепатоцитов (клеток печени) у мышей дикого типа и NSG мышей при двух режимах питания: ad libitum (мыши могли есть, сколько хотят) и ограничении калорий на 40%. В итоге, как и ожидалось, мыши с дефицитом иммунной системы накапливали сенесцентные клетки быстрее мышей дикого типа, но в обеих группах скорость была замедлена кратковременным (3 месяца) ограничением калорий, что в больше степени, очевидно, вызвано именно подавлением путей, вызывающих цепную реакцию сенесценции. Важно, что в группе диких мышей при режиме ограничения калорий, согласно построенной исследователям модели, производство сенесцентных клеток полностью невилируется, видимо, благодаря иммунному надзору.
Полученные данные указывают на потенциальный успех даже кратковременного применения так называемых сеностатиков – компонентов, мимикрирующих эффект ограничение калорий, например, рапамицин и метформин (недавно было показано, что последний может компенсировать снижение NAD+ с возрастом путем активации SIR1). Сеностатики в отличие от сенолитиков не вызывают апоптоз сенесцентных клеток, а подавляют сенесцентный фенотип клеток. Условием эффективности сеностатиков, однако, является нормально функционирующая иммунная система. К сожалению, в старом возрасте наблюдается противоположное. В любом случае известен уже целый ряд сенолитиков, некоторые проходят испытания на людях и, вероятно, скоро будут доступны рынке.
Новостная статья: https://www.leafscience.org/the-bystander-effect/
Научная статья: https://onlinelibrary.wiley.com/doi/full/10.1111/acel.12848
Старение кожи: фибробласты в роли адипоцитов и важность межклеточного матрикса
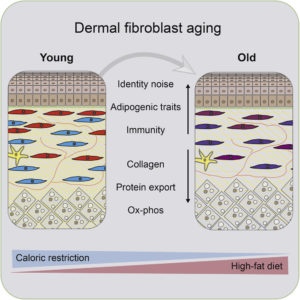
Фибробласты – клетки соединительной ткани, синтезирующие компоненты межклеточного матрикса такие как коллаген. Активность дермальных фибробластов играет ключевую роль в обеспечении барьерной функции кожи и починке повреждений кожи. С возрастом происходит уменьшение толщины дермиса, плотности межклеточного матрикса, количества фибробластов, что нарушает процесс восстановления после раны. Обусловлено ли дермальное старение потерей фибробластов или изменениями, накапливающимися с возрастом, или оба процесса имеют место быть, на данный момент не очень понятно.
В своем новом исследовании с помощью транскриптомного анализа ученые установили, что с возрастом фибробласты мышей приобретают черты адипоцитов (жировых клеток) и теряют свою идентичность. У этих клеток снижается экспрессия генов необходимых для формирования межклеточного матрикса и усиливается метаболизм жиров, адипогенез и воспаление. Данные изменения возможно обратить вспять путем долгосрочного ограничения калорий либо спровоцировать диетой с высоким содержанием жиров. Еще одной чертой старых фибробластов, по-видимому, является их предпочтение заполнять дермальное пространство, образованного в результате смерти других фибробластов, не путем увеличения клеточной пролиферации, а путем контактирования дальних фибробластов с помощью мембранных выпячиваний (протрузий).
Важно отметить, что в исследовании изменений межклеточного матрикса с возрастом было показано, что изименение секретома фибробластов и организации межклеточного матрикса способствует метастазированию меланомы у пожилых людей. Еще один пример того, как процессы, лежащие в основе старения, обеспечивают благоприятные условия для развития ВЗЗ таких как рак.
Новостная статья: https://www.sciencedaily.com/releases/2018/11/181108134147.htm
Научная статья: https://www.cell.com/cell/fulltext/S0092-8674(18)31320-5?
Старение лица как биомаркер хронологического, но не биологического возраста

Исследователи разработали простой и точный предиктор хронологического возраста на основе анализа фото кожи уголков глаз под названием PhotoAgeClock. Для этого нейронные сети с глубоким обучением анализировали 8 414 фото (соотношение тренировочного набора к тестовому набору составило 7:1) с высоким разрешением (2258 x 1506), на которых был указан хронологический возраст участников исследования. Наиболее точным предиктор оказался для определения хронологического возраста участников возрастом 40-65 лет. Ошибка прогнозирования была выше для возрастных групп 20-40 лет и 65+, вероятно, либо из-за меньшей репрезентативности данных групп, либо большей разницы фенотипов участников данных групп.
Авторы отмечают, что предикторы хронологического возраста можно использовать для определения разницы между биологическим и хронологическим возрастом людей с ускоренным или замедленным старением, а также оценки всевозможных вмешательств, будь то косметические, медицинские или связанные с образом жизни. Исследователи также обнаружили, что PhotoAgeClock определял хронологический возраст с более высокой точностью, чем эпигенетические часы Хорвата, основанных на паттерне метилирования ДНК.
Научная статья: https://www.aging-us.com/article/101629/text
В еще одном исследовании, опубликованном в начале ноября, исследователи не нашли корреляции между старением лица и эпигенетическими часами у 235 испытуемых.
На этот раз старение лица участников в возрасте от 79 до 92 лет оценивалось по фотографиям нейтрального выражения лица не алгоритмом, а 12 студентами. Средний возраст, оцененный студентами, составил 74,2 года, что моложе настоящего хронологического возраста испытуемых на момент фотографии, составляющего 83,3 года. Образцы крови для оценки профиля метилирования ДНК были взяты у испытуемых в возрасте 79,1 в среднем. Оказалось, что ускоренное эпигенетическое старение не было ассоциировано с более высоким возрастом, оцененным на основе лица. Одной из причин может быть разница в скорости старения тканей, поэтому необходимо сравнивать воспринимаемое старение лица с профилем метилирования кожи. Исследователи не уточняют, какой предиктор (старение лица или метилирования ДНК) оказался более точным для определения хронологического возраста, но это и не являлось целью исследования.
Тем не менее важно понимать, что хронологический и биологический возраст очень часто не совпадают. По всей видимости, визуальная оценка совпадает как раз с хронологическим возрастом, и это может быть полезным в ряде случаев. Однако, молекулярные биомаркеры старения в отличие от фотографических дают информацию о биологическом возрасте и без их измерения и отслеживания трендов в результате интервенций невозможно точно оценить эффективность последних.
Научная статья: https://clinicalepigeneticsjournal.biomedcentral.com/articles/10.1186/s13148-018-0572-2
Автор обзора Лариса Шелоухова
Перепечатка разрешается при сохранении ссылок на источник публикации: https://rlegroup.net/2018/12/03/biologija-starenija-nojabr-2018/
Источник: m.vk.com