Роль HSP-70 в снижении цитотоксичности бета-амилоида при болезни Альцгеймера
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2018-11-20 21:26

Болезнь Альцгеймера (БА) - заболевание, относящееся к дегенеративным болезням центральной нервной системы (МКБ-10) и связанное с изменением пространственной структуры белков. Белки с поврежденной структурой накапливаются в коре головного мозга, слипаются, образуя крупные белковые агрегаты, и приводят к нарушению работы нейронов и синапсов. При развитии болезни Альцгеймера наблюдаются конформационные изменения двух белков: тау-белка, или microtubule-associated protein tau (MAPT), и предшественника бета-амилоида, или amyloid precursor protein (APP). Причиной, по которой тау-белок, в норме стабилизирующий микротрубочки, начинает вести себя аномально, является его гиперфосфорилирование, в механизме которого главную роль играет GSK3. Гиперфосфорилированный тау-белок способен влиять на неизмененный тау-белок, вызывая тем самым его слипание в агрегаты. Такие соединения уже не способны к стабилизации микротрубочек, которые ответственны за передачу сигналов вдоль аксонов. Бета-амилоидные бляшки образуются из APP под действием протеолитических ферментов, преимущественно ?- и ?-секретазы; они вредны для кальциевого обмена, поскольку такое нарушение приводит к апоптозу.
При исследовании мозга человека, страдавшего от БА было обнаружено повышение уровня содержания молекулярных шаперонов (по-другому их называют белками теплового шока и используют сокращение HSP) и ко-шаперонов: HSP-27, HSP-70, HSP-60, HSP-90 и STl1, ?-Б-кристалина. HSP27 и ?-Б-кристалин поддерживают ?-амилоид в токсичной нефибриллярной форме. В то же время имеются данные, что низкомолекулярные sHSP препятствуют распространению токсичности ?-амилоида. HSP-70 и HSP-90 способствуют правильному скручиванию тау-белка в функциональные микротрубочки, уменьшая его гиперфосфорилирование и предотвращая тем самым образование белковых агрегатов. Также HSP70 и HSP90 повышают деградацию неправильного свернутого тау-белка.
Неправильно свернутые белки называются misfolded proteins. Каков же общий механизм действия шаперонов? После обнаружения подобного нарушения структуры шаперон возвращает белок в исходную ненативную конформацию. В такой конформации белок представляет цепочку аминокислотных остатков. Шапероны связываются с белковыми цепями и тем самым не дают им слипнуться между собой и образовать агрегаты, а затем сворачивают их заново в нативную, правильную конформацию.
Подробнее рассмотрим роль HSP-70.
В ходе исследований, проведенных I. Rivera и ее коллегами, было замечено, что HSP-70 повлиял на процесс сборки in vitro A? олигомера. Более того, присутствие HSP-70 уменьшило A? токсичность культивируемых нейронов (клетки N2A). Как это выяснили? A?-пептиды в мономерной форме инкубировали при температуре 37 градусов по Цельсию, постепенно увеличивая концентрацию HSP-70. Добавление HSP-70 к A?-мономерам привело к уменьшению процесса олигомеризации (рисунок 1), даже когда молекулярное соотношение между HSP-70 и пептидами бета-амилоида составляло 1:150. Хотя добавление HSP-70 к A? приводило к ингибированию комплексов с большой молекулярной массой, он, по-видимому, не влиял на наличие димерных, тримерных и тетрамерных комплексов. Затем клетки N2A инкубировали с HSP-70 (0,2 мкМ), пептидными мономерами A? (10 мкМ) или сочетанием пептидных мономеров A? и HSP-70 (соотношение 1:50) при 37 ° C в течение 48 часов. Снижение клеточной смерти на 50 % наблюдалась в клетках, инкубированных совместно с A? пептидом и HSP-70, по сравнению с клетками, инкубированными только с пептидом A? (рисунок 2).
Второе добавление HSP-70 (0,32 мкг, 0,4 мкМ конечный) спустя 24 ч в инкубированные пептиды A? и HSP-70 приводило к дальнейшему снижению количества погибших клеток (70 %), в отличие от клеток, которые инкубировали только с пептидами A?. При инкубации клеток только с HSP-70 токсического эффекта не наблюдалось.
В конце инкубации (48 ч) клеток, подвергнутых воздействию пептидов A? и HSP-70, во внеклеточной среде было обнаружено присутствие форм A?. Наблюдалась олигомеризация A? в образцах, собранных из клеток, которые были первоначально инкубированы с мономерным A?, что указывает на то, что мономеры образуют олигомеры во время инкубации при 37 ° C. Напротив, присутствие олигомеров A?1-42 было значительно снижено в среде клеток, инкубированных с пептидами A? и HSP-70. Это наблюдение подтверждает, что HSP-70 препятствует олигомеризации пептида A?, следовательно, в результате снижается его токсичность.
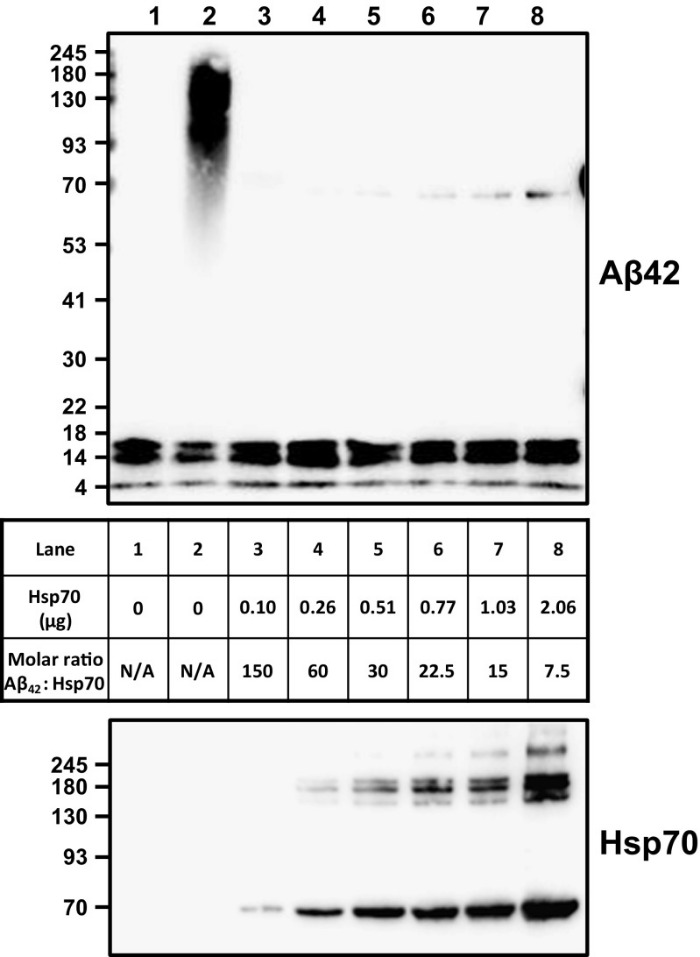
Рисунок 1 | Уменьшение процессов олигомеризации на фоне добавления HSP-70 к A?-мономерам
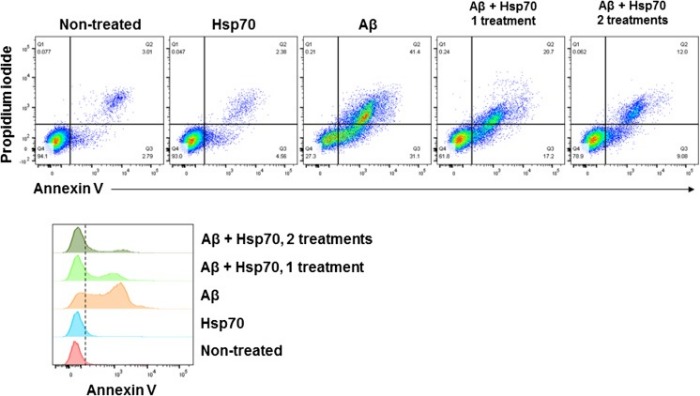
Рисунок 2 | Сравнении жизнеспособности клеток инкубированных совместно с A? пептидом и HSP-70 с клетками, инкубированными только с пептидом A?
На рисунке 3 представлена модель олигомеризации A?-пептида и роль в этом процессе HSP70. A?-пептиды и HSP70s высвобождаются из нейронов, глиальных клеток и астроцитов во внеклеточную среду. Мономеры A? получены ферментативным расщеплением мембранного APP. После высвобождения A? инициирует очень быстрый процесс олигомеризации с образованием димеров, тримеров и тетрамеров с последующей медленной сборкой олигомеров с большой молекулярной массой, которые представляют собой цитотоксические комплексы и волокна. HSP70s являются препятствием для сборки этих олигомеров с большими молекулярными массами - цитотоксичность снижается.
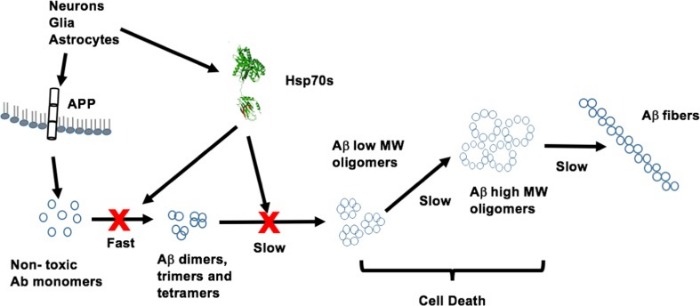
Рисунок 3 | Модель олигомеризации A?-пептида и роль HSP70 в этом процессе
Таким образом, проведенный эксперимент доказал, что HSP-70 снижает степень токсичности бета-амилоидных бляшек, препятствуя их образованию.
Источники
1. Rivera I., Capone1 R., David M. Cauvi1, Nelson Arispe 3, De Maio A. (2018). Modulation of Alzheimer's amyloid ? peptide oligomerization and toxicity by extracellular HSP70. Cell Stress and Chaperones 23:269–279.
2. Sun Y1, Zhang JR1, Chen S1. (2017). Suppression of Alzheimer's disease-related phenotypes by the heat shock protein 70 inducer, geranylgeranylacetone, in APP/PS1 transgenic mice via the ERK/p38 MAPK signaling pathway. Experimental and therapeutic medicine 14: 5267-5274.
Источник: medach.pro