Биология старения. Обзор за сентябрь 2018.
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2018-10-10 02:45

Три апдейта по проектам LEAF.

Недавно были опубликованы хорошие новости по запущенному в 2016 году LEAF (Life Extension Advocacy Foundation) проекту под названием MMTP (Major Mouse Testing Program). Целью этого проекта является проверка сразу шести сенолитиков для увеличения продолжительности жизни (ПЖ) на модели мышей. В наших предыдущих обзорах мы писали об успешных исследованиях таких сенолитиков, как кверцетин и дазатиниб. Также как и дазатиниб, венетоклакс используется как противораковое средство – они оба одобрены для применения на людях. Кверцетин же доступен как БАД. Авторы не называют оставшиеся три сенолитика, но сообщают, что тестирование этих препаратов в различных комбинациях на мышах было одобрено и запущено ранее в этом году в Германии. По-видимому, каждый из тестируемых сенолитиков нацелен на разные виды сенесцентных клеток. Таким образом, коктейли из этих препаратов может оказаться эффективней, чем каждый из них по отдельности. Пожелаем удачи учёным и будем следить за результатами исследований!

Еще один проект под названием Cellage, целью которого является поиск новых промоутеров сенесцентных клеток, предоставил апдейт своей активности. На данный момент Cellage сотрудничает с Circularis, эксперту по нахождению всех активных промоутеров в геноме организма с помощью рибозим (молекул, обладающих ферментативной активностью наподобие белковых ферментов). Напомним, что промоутер – это участок ДНК, ответственный за экспрессию того или иного гена. Если удастся найти новые промоутеры сенесцентных клеток, используя p16 и CMV как положительный контроль (уже известные маркеры сенесцентных клеток), то команда сможет перейти к скринингу синтетических промоутеров для высокоточного детектирования сенесцентных клеток. В будущем это обеспечит возможность нацеливаться на сенесцентные клетки разных органов и уничтожать исключительно их. На данный же момент использование p16, к примеру, не позволяет это сделать, т.к. методы, направленная на экспрессирующие этот белок клетки уничтожает не только сенесцентные, но и спящие стволовые клетки во всем организме. Также промоутер p16 экспрессируется не во всех сенесцентных клетках. Библиотека из 100,000 синтетических промоутеров уже готова для скрининга и ждет успешного завершения первого этапа проекта.
MitoSENS, самый первый проект, сбор средств для которого был запущен на платформе Lifespan.io в 2015 году, также предоставил апдейт своей деятельности в сентябре этого года. С момента запуска команда MitoSENS опубликовала статью об успешных экспериментах по аллотопической экспрессии двух митохондриальных генов – ATP8 и ATP6. Дело в том, что митохондриальная ДНК подвержена постоянным атакам продуктами окислительного фосфорилирования – свободных радикалов, что приводит к мутациям генов, экспрессируемых в митохондриях. Этот процесс, происходящий постоянно в организме, приводит к дисфункции митохондрий – одной из характерных черт старения. Одним из методов борьбы с мутациями митохондриальной ДНК является экспрессия этих генов в ядре (подробнее об аллотопической экспрессии можно почитать здесь).
Сейчас команда MitoSENS работает над улучшением метода аллотопической экспрессии и возможности переноса других генов в дополнение к ATP8 и ATP6. Исследователи также работают над трансгенной линией “мито” мышей, которая, они надеются, покажет, что генная терапия митохондриальных генов – терапия будущего.
Митохондрии: генное редактирование и роль убихинона в старении.

Еще одним способом борьбы с мутациями митохондриальной ДНК является применение различных методов генного редактирования, например, с помощью нуклеаз. В недавно опубликованном исследовании на модели мыши с митохондриальным заболеванием сердечной ткани ввиду гетероплазмии (одновременное присутствие как мутировавшей митохондриальной ДНК, так и без мутации) была показана успешность данного метода. Доставка нуклеаз известных как цинковые пальцы (zinc-finger nucleases, mtZFN) для удаления мутации митохондриальной ДНК в клетках сердца мышей была осуществлена с помощью системного введения адено-ассоциированного вируса (AAV) в вену хвоста мышей. Таким образом, было показано, что успешное генное редактирование митохондриальной ДНК в соматических клеток не только возможно, но и успешно in vivo.
Научная статья:https://www.nature.com/articles/s41591-018-0165-9

Коэнзим Q10 (кофермент Q10, убихинон) стал известен широкой публике благодаря рекламам косметических средств, в составе которых он содержится. Эта молекула является антиоксидантом и, подразумевается, что, проникнув в кожу, она защитит другие молекулы от негативного влияния свободных радикалов. Убихинон играет ключевую роль в цепи переноса электронов и митохондриальном окислительном фосфорилировании. Напомним, что в результате этого непрерывного процесса запасания энергии в виде АТФ в митохондриях образуются свободные радикалы, которые атакуют различные молекулы, дестабилизируя их. Исходя из этого неудивительно, что замедляя митохондриальный метаболизм, учёным удалось продлить ПЖ многочисленным видам животных.
В новом исследовании учёные использовали трансгенную линию червя нематода C. elegans, характеризующуюся делецией в гене clk-1, кодирующем фермент биосинтеза убихинона. Эта модель известна увеличенной ПЖ, сниженной интенсивностью митохондриального дыхания, задержкой развития и меньшим количеством отпрысков. Мыши с этой мутацией также живут дольше и отличаются небольшим размером. На этот раз исследователи показали, что наподобие другим системам с повышенной ПЖ, данная модель нематода характеризуется пониженным биогенезом белков рибосомы и отключением программы синтеза цитоплазматических белков путем изменения эффективности трансляции матричной РНК, кодирующей белки комплекса трансляции.
Таким образом, еще раз подтверждается высокая вероятность успешности исследований, направленных на продление ПЖ людей путем снижения синтеза белков.
Научная статья: https://www.ncbi.nlm.nih.gov/pubmed/30198021
Сенесценция: роль в нейродегенерации и молекула, предупреждающая сенесценцию клеток сердечно-сосудистой системы.

В новом исследовании ученые клиники Мэйо показали, что удаление сенесцентных глиальных клеток мозга в трансгенной линии мышей, используемой как модель Тау-зависимой нейродегенерации, предотвращает развитие когнитивной дисфункции. Трансгенная линия мышей PS19, экспрессирующая высокий уровень мутантного человеческого Тау в нейронах, характеризуется скоплениями нейрофибриллярных клубков, глиозом, нейродегенерацией и потере когнитивных функций. Во-первых, ученые обнаружили, что повышенная экспрессия известного маркера сенесцентных клеток, белка p16, а также других маркеров сенесценции, была повышена у этих мышей еще до образования нейрофибриллярных клубков. Затем, скрестив самцов линии PS19 с самками линии ATTAC (апоптоз путем активации каспазы 8) и применив димеризатор AP (который запускает каскад реакций апоптоза через димеризацию мембрано-ассоциированной каспазы 8), они смогли очистить мозг мышей от сенесцентных клеток. Проанализировав, какой именно вид сенесцентных клеток был удален, исследователи пришли к выводу, что это были именно клетки микроглии и астроциты, а не нейроны, содержащие скопления Тау. Также наблюдалось отсутствие глиоза, нейрофибриллярных клубков и дегенерации серого вещества, что привело к сохранению когнитивных функций (памяти).
Вцелом это исследование показывает эффективность нацеленного удаления сенесцентных клеток для предотвращения нейродегенерации. Стоит отметить, что в этом исследовании рассмотрена только определенная модель нейродегенерации, и до применения выводов в клинической практике еще далеко. Однако, данное исследование – еще один пример успешного применения анти-сенесцентного метода в борьбе со старением. В обзоре за август мы также писали об успешном применении сенолитиков в других моделях Тау-зависимой нейродегенерации, но в ней мишенью выступили нейроны.
Научная статья: https://www.ncbi.nlm.nih.gov/pubmed/30232451
Новостная статья: https://www.leafscience.org/senescent-cell-clearance-ameliorates-neurodegeneration-in-mice/

Эндогенный сенолитик клеток сердечно-сосудистой системы был обнаружен исследователями Университет штата Джорджия (Georgia State University).
Концентрация в крови этой молекулы, известной под названием ?-гидроксибутират, увеличивается после голодания, диеты с ограничением калорий и высокоинтенсивных тренировок. B-гидроксибутират (b-HB) – это кетоновое тело (или кетон), т.е. продукт распада жиров, происходящего для получения энергии в условиях отсутствия углеводов. Считается, что b-гидроксибутират обладает анти-эйджинговыми свойствами и помогает бороться с возраст-зависимой нейродегенерацией.
В своем исследовании учёные показали, что b-HB запускает цепь сигнальных путей клеток эндотелия и гладкомышечных клеток аорты, вводя её в так называемое состояние покоя (спящий режим, quiescence). В отличие от сенесцентного состояния, клетки в спящем режиме не теряют возможность деления, а лишь ставят клеточный цикл “на паузу”. Обычно этот процесс запускается в условиях недостаточного количества питательных веществ. Как только условия улучшаются, клетка входит в свой обычный цикл. Оказалось, что b-HB, связываясь с рибонуклеопротеином А1 (hnRNP A1), повышает экспрессию транскрипционного фактора Oct4 (ранее известный как регулятор плюрипотентности эмбриональных стволовых клеток), что приводит к повышенной экспрессии Ламина B1 (Lamin B1) – ключевого фактора, предупреждающего сенесценцию, вызванную ДНК повреждениями. Данные выводы, сделанные на культуре клеток человека, исследователи подтвердили in vivo, используя мышей.
Примечательно, что анти-сенесцентный эффект b-HB был выражен в большей степени в более молодых клетках. Исследователи предполагают, что на более позднем этапе старения, а также в случае делеции Oct4 подобного эффекта не будет. Вцелом же Oct4 как терапевтическая мишень, а b-HB и подобные ему компоненты могут стать эффективными методами профилактики старения сердечно-сосудистой системы.
Научная статья: https://www.ncbi.nlm.nih.gov/pubmed/30197300
Новостные статьи: https://www.leafscience.org/molecule-appears-to-have-anti-aging-effects-on-the-vascular-system/; https://newatlas.com/molecule-fasting-vascular-system/56360/
Эпигенетика: влияние внешних факторов и витамин Д.
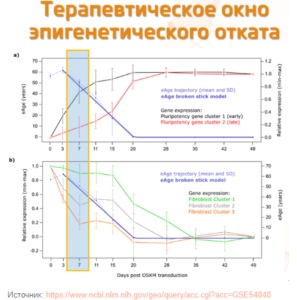
До недавнего времени наблюдалось отсутствие широкомасштабных долгосрочных исследований возраст-ассоциированных изменений ДНК метилирования. В новом исследовании, однако, учёные анализировали эпигенетические изменения близнецов-Шведов (как монозиготных, так и дизиготных) на протяжении 20 лет. Средний возраст участников на момент начала исследования составлял 69 лет (±9.7 лет). В ходе исследования забор крови участников проводился в среднем 2.6 раз (до пяти раз). Были проанализированы как изменения в паттерне метилирования, так и клеточного состава крови с возрастом.
В результате было показано, что достаточно стабильные изменения в метилировании ДНК с возрастом присутствуют в долгосрочной перспективе. Эти изменения обусловлены генетически, но не зависят от возраста. Более того, со временем увеличивается вариативность паттерна метилирования, что указывает на нарастающую роль внешних условий с возрастом. Пока непонятно, что конкретно входит в число таких внешних факторов, для этого нужны дополнительные исследования. Однако, понятно, что и без непосредственного внедрения в геном возможно затормозить эпигенетические часы, возможно, питанием и физическими упражнениями. Предложен и более радикальный метод отката эпигенетических часов – изменение экспрессии гена Oct4 – одного из так называемых факторов Яманаки. На данный момент авторы этого подхода собирают средства на запуск исследования на культуре клеток.
Научная статья: https://www.ncbi.nlm.nih.gov/pubmed/30264654
Некоторую ясность в понимание факторов, влияющих на изменение паттерна метилирования ДНК (DNAm) с возрастом, внесло исследование, опубликованное в конце сентября. На этот раз с использованием модели были выявлены предикторы развития болезней и смертности, основанные на паттерне метилирования ДНК. Вцелом было обнаружено десять новых предикторов, коррелирующих с различными аспектами образа жизни, такими как употребление алкоголя, курение, индекс массы тела, соотношение окружностей талии и бедер, процент жира, четыре показателя холестерина и уровень образования.

Модель сначала была протестирована на когорте из 5087 людей для выявления DNAm предикторов модифицируемых факторов образа жизни. Далее эти предикторы были применены для анализа независимой группы из 895 участников для проверки точности данных предикторов для идентификации образа жизни индивида (курильщик, алкоголик, наличие ожирения, высокий уровень холестерина, наличие высшего образования) и предсказании смертности. Было показано, что, используя выявленные предикторы, можно более точно оценить риски развития болезней и смертность, чем используя самоотчет.
Таким образом, появилось еще одно косвенное доказательство, что образ жизни влияет на наш эпигеном и может либо отсрочить, либо ускорить биологическое старение и смерть.
Научная статья: https://www.ncbi.nlm.nih.gov/pubmed/30257690

В маломасштабном клиническом исследовании с участием 70 афро-американцев с ожирением было показано, что приём витамина Д в качестве добавки снизил эпигенетический возраст участников. Полногеномный анализ метилирования ДНК был проведен на 51 человеке из 70, которые случайныма образом были разбиты на четыре группы для приёма витамина Д (или плацебо) на протяжении 16 недель с разной дозировкой : 600 МЕ/день, 2000 МЕ/день, 4000 МЕ/день и плацебо. В результате анализа оказалось, что дозировка 4000 МЕ/день была связана со снижением эпигенетического возраста на 1,85 лет, а 2000 МЕ/день – на 1,90 лет. Авторы исследования, однако, отмечают, что для более весомых выводов нужны более долгие клинические исследования с большим количеством людей. Пока рано назначать витамин Д как БАД для увеличения ПЖ, однако, не помешает следить за уровнем своего витамина Д во избежания недостатка. Напомним, что в России наблюдается нехватка витамина Д, особенно среди людей, не употребляющих рыбу хотя бы раз в неделю.
Клиническое исследование: https://www.ncbi.nlm.nih.gov/pubmed/30256915
Хотите финансово поддержать исследователей, работающих над проблемой старения? Вам сюда.
Рады сообщить об успешном сборе средств для проведения долгосрочного исследования командой Дэвида Синклера из Гарвардской Медицинской Школы. Цель исследования – оценить эффективность NMN (никотинамида мононуклеотида), метаболического прекурсора NAD+ (никотинамидадениндинуклеотида), в борьбе со старением на двух моделей мышей – диком типе и ICE типе (мышах с индуцированными измененями в эпигеноме, т.е. модели ускоренно стареющих мышей).
Как известно, низкокалорийная диета (ограничение калорий, calorie restriction) – один из самых эффективных на данный момент способов “омолодить” организм, привести в норму биомаркеры старения и продлить ПЖ. Свежий обзор можно прочитать здесь. Под такой диетой имеется в виду режим питания с сокращением употребляемых калорий без допущения нехватки питательных веществ. Данную диету, однако, сложно соблюдать, особенно на протяжении долгого времени. Одним из альтернативных методов достижения результатов такой диеты являются вещества, имитирующие её воздействие.

NAD+ представляет из себя важный кофермент, играющий ключевую роль в энергетическом обмене клетки и других процессах. NAD+ является окисленной формой NADH, т.е. готовой принять электроны. С возрастом происходит значительное снижение количества биодоступной NAD+, что связано со многими возраст-зависимыми заболеваниями. Важно, что низкокалорийная диета способна обратить вспять этот процесс.
Для увеличения уровня биодоступной молекулы NAD+, однако, необходимо использовать её предшественник, т.к. NAD+ не может проникнуть в клетку через мембрану. На краткосрочных исследованиях на мышах было показано, что предшественник NAD+ никотинамид NMN улучшает митохондриальную функцию мышц, кровообращение и ангиогенез (рост сосудов). Для подтверждения этих результатов необходимы более долгосрочные исследования. Учёные планируют проверить эффективность лечения с приемом NMN на 20-месячных мышах (эквивалентно 50 годам возраста человека) для восстановления уровня NAD+ до уровня молодых мышей. Также планируется администрирование NMN быстро стареющей линии мышей для получения результатов в ближайшее время.
Начальная цель в 30 000 долларов была легко достигнута, новая цель – 45 000. Дедлайн – 3 ноября, даже небольшое пожертвование приблизит нас к разработке антиэйджинговых лекарств. Поможем исследователям приблизить нас к победе над старением!
Страница кампании: https://www.lifespan.io/campaigns/can-nmn-increase-longevity/
Не можете проспонсировать исследования для борьбы со старением? Не беда – информируйте!

1 октября были подведены итоги конкурса короткометражных фильмов, посвященных развенчанию мифов о старении. Посмотреть и распространить выигрышные видео вы можете с помощью этой ссылки: https://longevityfilmcompetition.com/ Октябрь – месяц осведомленности проблематики долголетия и всего, что с ним связано, и отличный повод распространить информацию о проводящихся исследованиях и событиях в этой области.
Поздравляем победителей и надеемся на то, что их творения смогут убедить еще больше людей заинтересоваться проблемой старения и финансово поддержать исследования, имеющие своей целью победить старение как корень возраст-зависимых заболеваний!
Автор: Лариса Шелоухова
Источник: www.leafscience.org