Отправить зомби на покой
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2018-09-25 15:05

Отрывок из книги Обри ди Грея «Отменить старение» об использовании иммунной системы в борьбе со старением.
С возрастом в наших тканях накапливается все больше не желающих умирать, но бездействующих клеток. Это часть нашей биохимической программы по профилактике рака: подавления активности потенциально злокачественных клеток еще до того, как они начнут причинять неприятности. К сожалению, они не остаются просто безобидными и незаметными, а умудряются причинять вряд окружающим тканям искаженными химическими сигналами. К счастью, воспользовавшись достижениями новейшей “прицельной” противораковой терапии, можно разработать безопасные и эффективные методы избавления от этих стареющих клеток.
До сих пор обсуждались главным образом специфические формы возрастного повреждения наших клеток и их компонентов на молекулярном уровне – вместе с возможностями восстановления клеточных и тканевых функций путем устранения или обезвреживания таких дефектов. Однако в некоторых случаях стареющее тело накапливает клетки, которые поражены таким образом, что не просто перестают делать свой вклад в жизнеобеспечение организма, но фактически начинают отравлять его, рубя, так сказать, сук, поддерживающий их собственное существование.
<…>
Атака клонов
Один из самых губительных возрастных эффектов – ослабление иммунной системы. Инфекции, которые доставляют лишь мелким неудобства молодым людям, могут убить биологически старого человека. Например, грипп ежегодно укладывает в стационары 114 000 американцев, унося вместе со своими осложнениями около 51 000 их жизней. Однако поражает эта напасть в основном тех, кто уже пострадал от возрастных патологий (см. рис.1). Грипп и вызываемая им пневмония почти никогда не убивают взрослых людей младше семидесяти, после чего смертность возрастает экс-поненциально. В США более 90% погибших от этих двух болезней – люди старше 65.

Конечно, эту смертность можно несколько уменьшить с помощью вакцинации. Однако ненамного: от 30 до 75% стариков не реагируют на прививки от гриппа, тогда как среди молодых взрослых людей эта доля равна всего лишь 10%. Добавьте к этому, что иногда нас вакцинируют не от того штамма вируса, а это ограничивает пользу даже успешной иммунизации. У возрастного ослабления иммунной системы несколько причин. Некоторые из них в конечном итоге вытекают из возрастных патологий в разных частях тела (например, общее усиление свободнорадикального стресса, обусловленное мутантными митохондриями). Однако одним из самых глубинных – и неожиданных – факторов, заставляющим стариков поддаваться инфекциям, от которых без труда избавляются молодые люди, является, как ни трудно в это поверить, своего рода иммунологическое перенасыщение.
Отчет о боеготовности
У нашей иммунной системы два главных части. Одна из них врожденная. Ее задачи настолько общие, что ей не надо “учиться” распознавать специфических противников. Эту часть иммунной системы можно сравнить с солдатами, патрулирующими пограничную зону: они стараются поддерживать порядок, но не знают врага в лицо – просто хватают всех встреченных по пути подозрительных субъектов. С годами эта врожденная система безопасности, по–видимому, почти не меняется, а если с ней что–то и происходит, то, скорее всего, из–за конкретных возрастных патологий (некоторые из них будут рассмотрены ниже) или распространенных в старости факторов (например, витаминно–минеральных недостаточностей), а не в результате собственно биологического старения.
Вторая часть иммунной системы – адаптивная. Она напоминает множество отлично обученных спецподразделений, каждое из которых подготовлено к ведению боевых действий против того или иного вполне конкретного противника. Благодаря этой своей части наша иммунная система учится распознавать врагов, что объясняет эффективность вакцинаций.
В ней различаются два типа клеток – В– и Т–лимфоциты. Первые защищают нас в основном от таких патогенов, как типа бактерии и простейшие, т.е., от посторонних для организма агентов, на которые можно нацелиться непосредственно. В–лимфоциты распознают специфические “чужие” метки (антигены) на поверхности пришельцев и синтезируют соответствующе им антитела. О действии последних уже говорилось в гл.8, когда обсуждалась антиамилоидная вакцинация. Антитела, связываясь с антигенами подлежащего уничтожению чужака, действуют как маяки, направляющие на него атаку других компонентов иммунной системы, или просто блокируют рецепторы и прочие белки, необходимые для выживания патогена.
В противоположность этому цитотоксические Т–лимфоциты (известные также как Т–киллеры, или CD8–киллеры по их характерному рецептору) отвечают за искоренение внутренних врагов, т.е. клеток, порожденных самим организмом, но с некоторого момента действующих ему в ущерб, например раковых или зараженных вирусами. (Существуют и другие типы Т–лимфоцитов, но о них ниже.) Эти лимфоциты тоже нацеливаются на антигены, но только если те сочетаются с определенными белками “родных” клеток–изменниц. Для приобретения специфической цитотоксичности (созревания) им не обязательно контактировать с антигеном, оказавшимся на поверхности непосредственно клетки–хозяина. В случае вирусов, например, такой антиген чаще предъявляется им другими компонентами иммунной системы, играющими роль разведчиков и добывающими опознавательные знаки врага среди остатков разрушенных им клеток. В любом случае зрелый Т–киллер без участия антител уничтожает клетки своего же организма, ставшие по разным причинам предателями.
Потенциальная проблема связана с необходимостью поддержания тонкого баланса между конкурирующими потребностями в условиях далеко не бесконечных ресурсов. С одной стороны, иммунная система должна уметь распознавать и уничтожать врагов, с которыми никогда раньше не встречалась. Для этого ей необходим запас так называемых наивных CD8–клеток, готовых “учиться” реагировать на новые угрозы, созревая в присутствии незнакомых антигенов и лишь после этого бросаясь в атаку. С другой стороны, такая “учеба” требует времени, что дает врагу возможность закрепиться в организме, создавая угрожающую жизни ситуацию. Поэтому у нас всегда
есть контингент CD8–клеток памяти – ветеранов иммунологических битв, помнящих в лицо уже побежденных врагов и сразу же начинающих их уничтожение.
Сбалансированный бюджет
В идеале нам стоило бы располагать неограниченными резервами Т–лим-фоцитов – сколько угодно наивных плюс крупные подразделения клеток памяти для каждого из многочисленных патогенов, с которыми наш организм встречался за долгие годы блужданий по бандитским переулкам жизни. Однако создание и содержание такой огромной армии требует крупных инвестиций, а бюджет иммунной системы (как и любой другой)ограничен. Чтобы “военные расходы” не подрывали общей экономики организма, тот проводит строгую политику согласования своих затрат, ужимая по мере возможности так называемое “иммунологическое пространство” всей популяции Т–лимфоцитов. Иными словами, совокупное количество их наивных форм и клеток памяти не превышает определенного предела, хотя конкретный состав этой группы непрерывно меняется в зависимости от того, на какие угрозы в каждый данный момент нам приходится реагировать.
Когда эта система работает нормально (что типично для молодого человека), перед нами эталон гибкой, недорогой, высокомобильной, отлично подготовленной армии – розовой мечты подавляющего большинства полководцев и мировых лидеров. При попадании в организм любого патогенна происходит стремительное развертывание таких сил быстрого реагирования, которые без особого труда ликвидируют возникающую угрозу. Идет ли речь о клетках памяти, мобилизуемых на борьбу с известным противником, или о наивных лимфоцитах, на ходу обучающихся поражать принципиально нового агрессора, количество необходимых нам в данный момент специализированных Т–киллеров резко возрастает. Это происходит в результате быстрого клеточного деления, называемого клональной экспансией, которое увеличивает субпопуляцию лимфоцитов, опознающих определенные антигенные метки. (Термин “клон” в биологии имеет несколько значений; не стоит их путать с популярным, ненаучным смыслом, вкладываемым в данное слово. В следующей главе я рассмотрю этот вопрос подробнее.)
Когда очередной враг разбит, сохранение большого количества специализированных на его уничтожении Т–киллеров превращается в пустую трату ограниченных ресурсов. Железная бюджетная дисциплина нашего организма позволить этого не может. В результате он начинает быструю демобилизацию, приказывая основной массе выполнивших свою миссию ветеранов приступить к тщательно организованной программе самоуничтожения (апоптоза), ведущей к восстановлению менее специализированной обороноспособности. При этом, как уже говорилось, небольшая часть только что воевавших бойцов сохраняется в виде клеток памяти, продолжающих следить, не появится ли на горизонте хорошо знакомый им противник. Их немного, существенных расходов на подержание такого ограниченного патрульного контингента не требуется, и “бюджет” иммунной системы в результате не страдает. По крайней мере, так запланировано природой.
Старые солдаты не умирают…
К сожалению, такой идеал военной и фискальной дисциплины сохраняется, только когда организм полностью освобождается от инфекции. Если же организм воюет с врагом, пока тот не затаиться, но не уничтожает его полностью, система начинает разлаживаться. Одна из групп таких не до конца истребляемых врагов – вирусы герпеса. Они вызывают не только патологию, известную как собственно герпес (herpes simplex), вызывающий язвочки на губах и гениталиях, но и инфекционный мононуклеоз (вирус Эпштейна – Барр), ветрянку и опоясывающий лишай (вирус varicella zoster) и цитомегаловирусную инфекцию, о которой кроме специалистов мало кто слышал. Все эти вирусы нашим организмом успешно глушатся и в конечном итоге, инактивируясь, прекращают вызывать симптомы болезни. Однако они не уничтожаются полностью: небольшое количество их копий затаивается в потаенных уголках тела и “дремлет” там незаметно для иммунной системы, дожидаясь момента, когда она ослабнет настолько, что можно будет снова атаковать здоровые ткани. Фактически само слово “герпес” происходит от греческого “герпейн”, т.е. “ползать”: речь идет о способности патогена “по–пластунски” ускользать от лимфоцитов, сохраняя способность к реактивации в благоприятных условиях.
Возможно, вы впервые слышите о цитомегаловирусе (ЦМВ), хотя, не исключено, сами являетесь его носителем – как и 85% людей, доживших до пятого десятка. Дело в том, что ЦМВ редко вызывает даже недолгое заметное недомогание. Примерно в половине случаев первичной инфекции или реактивации этого патогена симптомов нет вообще, а в остальных возникают лишь трудные для диагностики неспецифические жалобы типа общего недомогания, повышенной температуры, потливости.
Однако новые исследования показывают, что ЦМВ (и, вероятно, другие вирусы) могут наносить и серьезный долговременный вред людям, не обращающим особого внимания на слабые и скоротечные признаки его исходной активности и реактивации. Поскольку организм от таких патогенов никогда до конца не избавляется, нацеленные на них Т–клетки памяти мобилизуются слишком часто. Постоянные тревоги постепенно ослабляют способность таких лимфоцитов реагировать на апоптозные приказы, т.е. “кончать с собой” после окончания вражеской атаки. По поводу причин этого существует несколько теорий, но, на мой взгляд, тут перед нами одно из проявлений сложной адаптации организма, призванной защитить его от бесконтрольного (злокачественного) клеточного размножения 4. В любом случае невозможность демобилизовать чересчур живучих ветеранов постепенно снижает способность иммунной системы противостоять другим, как известным, так и новым инфекциям. Железная ограниченность “иммунологического пространства” (“военного бюджета”) нашего организма ведет к логичному результату: если сохраняется чересчур много ненужных Т–лимфоцитов, выработанных против ЦМВ и других“ползучих” инфекций, приходится экономить на остальных иммунных солдатах. Соответственно, число наивных Т–клеток, готовых учиться борьбе с новыми врагами, и лимфоцитов, помнящих другие известные патогены, падает до рискованно низкого уровня.
… Они просто уходят в тень
Итак, уже сам отказ борцов с ЦМВ и аналогичными вирусами вовремя “кончать самоубийством” вредит нашему организму, не давая ему вербовать достаточное количество новых рекрутов. Однако фактически ситуация еще печальнее. Прошлые клональные экспансии не только заполняют место, необходимое для других бойцов: безработные Т–клетки памяти – подобно старым, израненным ветеранам – становятся слишком слабыми (иммунологи говорят “анергическими”, т.е. “лишенными энергии”) для выполнения собственных обязанностей.
Одним из важнейших процессов, ведущих к такой их анергичности, по-видимому, является утрата одного из ключевых поверхностных клеточных рецепторов, CD28, что наблюдалось и у человека, и у других животных. Т–лимфоциты оповещаются о присутствии врага антиген–презентирующими клетками (АПК), своего рода разведчиками иммунной системы, которые идентифицируют антигены противника, непосредственно встречаясь с ним или поглощая материал, остающийся на местах сражений (т.е. гибели зараженных вирусами клеток). Если Т–лимфоциты утрачивают CD28, АПК перестают распознавать и предупреждать их о нависшей над организмом угрозе: развед донесения никем не читаются. Особенно быстро теряют свои CD28–рецепторы ЦМВ–специфичные Т–киллеры.
Еще одна порождаемая анергичностью Т–лимфоцитов проблема заключается в том, что, занимая чужое место и снижая объем прочих Т–клеточных субпопуляций, они лишаются способности к размножению. В норме Т–клетки памяти экспрессируют рецептор KLRG1, который удерживает их от пролиферации после подавления инфекции. При этом наличие KLRG1 сохраняет способность этих лимфоцитов к размножению в присутствии соответствующего противника. В принципе, на поверхности анергических клеток KLRG1 сохраняется, но появляется и дополнительная, отсутствующая в норме метка – CD57. А наличие сразу двух таких структур подавляет способность к размножению. В результате резерв этих ветеранов, даже оповещенный о появлении известного им противника, уже не может превратиться в полноценную армию.
Этому клеточному “бесплодию” способствует любопытный факт: у анергических Т–клеток памяти необычно короткие теломеры – бессмысленные(не кодирующие белки) участки ДНК на концах наших хромосом. Причина в том, что у них, в отличие от большинства иммунных клеток, утрачивается активность необходимого для восстановления теломер фермента тело-меразы. Не экспрессируемый и у многих других клеток организма, он необходим функциональным CD8–лимфоцитам, поскольку от них требуется частое и быстрое размножение в ответ на инфекции. Очевидно, инактивация их теломеразы ослабляет иммунную систему в целом. Дополнительная информация об этом ферменте приводится в приводимой ниже врезке, а также в гл.12.
Теломеры и теломераза
Каждое деление клетки требует копирования ее ДНК. За это отвечает фермент ДНК–полимераза. Он несколько напоминает поезд: движется по рельсам в виде двойной спирали ДНК и “буква за буквой” воспроизводит ее нуклеотидную последовательность, изготовляя идентичную молекулу, которая остается рядом с оригиналом.
Однако у ДНК–полимеразы есть существенный недостаток. По причинам, углубляться в которые нет необходимости, вся молекула ДНК этим ферментом никогда не копируется. Иными словами, при каждом клеточном делении небольшой ее участок теряется, и скопированная цепочка оказывается короче исходной. Конец хромосомы постепенно “обгрызается”.
Вторая возникающая с хромосомами проблема – их тенденция часто рваться из–за действия радиации и других неблагоприятных факторов. Клетке приходится сшивать возникающие обрывки. При этом, разумеется, онани в коем случае не должна путать их с концами интактных хромосом, и, следовательно, ей надо каким–то образом различать эти два типа участков ДНК.
Частично такая проблема решается природой с помощью теломер. Эти концевые участки хромосом не содержат генетической информации, представляя собой монотонные повторы короткой последовательности нуклеотидов. Их укорочение при многократных копированиях ДНК и клеточных деления никакого вреда организму не приносит – пока теломеры остаются достаточно длинными. Однако ее полного исчезновения бояться не стоит, поскольку существует фермент теломераза, который удлиняет эту бессмысленную концевую последовательность ДНК. Точнее говоря, он решает сразу две проблемы. С одной стороны, экспрессирующие теломеразу клетки восстанавливают свои укорачивающиеся при каждом делении теломеры и могут делиться неограниченно долго. С другой стороны, сохранение теломер не позволяет механизму, устраняющему разрывы ДНК, сшивать разные хромосомы: бессмысленные концевые повторы распознаются соответствующими ферментами и оставляются в покое.
Люди и некоторые другие виды остроумно используют эту теломерно–теломеразную систему для защиты от рака. Злокачественные клетки убивают организм только после многократного деления. Без теломеразы это невозможно: если теломеры не будут восстанавливаться, они постепенно исчезнут, концы хромосом, перестав отличаться от внутри хромосомных разрывов, в конце концов, соединятся, а в результате раковые клетки как минимум не смогут больше делиться. Поэтому кодирующие теломеразу гены в них по мере возможности отключаются. Для восстановления активности этого фермента и, соответственно, способности раковых клеток к делению потребовалось бы много очень “удачных” мутаций. Хотя этот вопрос изучен меньше, у пожилых носителей ЦМВ наблюдается также избыток дефектныхCD4–лимфоцитов, называемых Т–хелперами, которые помогают другим компонентам иммунной системы организовать контрнаступление на проникшие в организм патогены. Иными словами, у этих внешне здоровых людей происходит такая же клональная экспансия нацеленных на ЦМВ, но лишенных рецептора CD28 CD4–клеток, как и в их CD8–популяции. Результат– аналогичное перенасыщение специализированными лимфоцитами, не реагирующими на активацию антиген–презентирующими клетками.
Не активируясь ими, эти дефектные Т–хелперы не выполняют своей функции, т.е. не обеспечивают мобилизацию на борьбу с врагом CD8–лимфоцитов и других иммунных клеток. Такая ситуация – вместе с упоминавшейся выше неспособностью Т–киллеров эффективно атаковать свои мишени – дает ЦМВ беспрепятственно размножаться. Это ведет к дополнительным клональным экспансиям и дальнейшему усугублению иммунной дисфункции.
Клонально размножившиеся ЦМВ–специфичные CD8–клетки анергичны (неэффективны) и с других точек зрения. При первом заражении мышиным вариантом этого вируса молодые мыши вырабатывают очень активные Т–киллеры, распознающие не менее 24 его антигенов. Однако, когда инфекция становится хронической, их нацеленные на ЦМВ спецподразделения сокращаются до клонов, реагирующих в среднем лишь на пять таких белков. Кроме того, у пожилых людей с ЦМВ анергические CD8–клетки реагируют на вирус слабее, чем у молодых его носителей, вырабатывая значительно меньше гамма–интерферона, одного из важнейших химических усилителей иммунологического ответа.
Плохие полководцы хороших армий
Вероятно, неспособность анергических Т–лимфоцитов бороться с ЦМВ–инфекцией ведет ко многим другим типичным для пожилых людей иммунологическим дисфункциям, которые нельзя объяснить никаким непосредственным эффектом старения этих клеток. Некоторые из таких эффектов можно было бы ожидать в связи с изменением выработки ими цитокинов, влияющих на активность прочих бойцов врожденной и адаптивной частей иммунной системы, однако другие вызывают гораздо более стойкие последствия, чем просто проблемы с химической сигнализацией.
Например, согласно широко распространенному сейчас мнению, старение Т–клеток объясняет возрастное снижение эффективности В–лимфоцитов, синтезирующих антитела к чужим антигенам и метящих таким образом патогены как мишени для разрушения другими клетками. Для созревания и выработки антител В–клеткам необходимы сигналы от Т–хелперов, поэтому доказательство того, что старость Т–клеток вызывает снижение эффективности В–лимфоцитарной системы, независимое от ее собственного старения, было лишь вопросом времени 15,16,17. К сожалению, никто пока(насколько я знаю) не выяснял, обусловлен ли такой эффект индуцированной ЦМВ клональной экспансией Т–лимфоцитов, играющей важнейшую роль в развитии прочих аспектов старения всей их популяции. В результате мы не знаем, насколько сильно влияет на В–клетки такой специфический феномен, как анергизация Т–клеток.
Даже если отвлечься от механистических объяснений и молекулярно–биологических механизмов, реальное влияние ползучего подтачивания всей иммунной системы анергическими CD8–клонами на человеческое здоровье становится очевидным при изучении конкретных результатов этого процесса. Опыты на животных показывают, что возрастная клональная экспансия отдельных CD8–субпопуляций снижает разнообразие присутствующих в организме Т–клеток, а в итоге и их способность обеспечивать эффективную иммунную защиту. Примеры аналогичных этому эффектов у нашего с вами вида – ухудшение CD8–ответа на прививки от гриппа и происходящее несколько позже ослабление Т–клеточного иммунитета против вируса Эпштейна–Барр у людей с клональной экспансией ЦМВ–специфичных клеток памяти.
Подсчет потерь
Даже если бы влияние на организм клонов анергических Т–лимфоцитов ограничивалось повышением заболеваемости и смертности от инфекционных болезней, у нас было достаточно причин желать избавления от этих клеток. Однако есть достаточно веская причина полагать, что они способствуют также возрастному ослаблению организма, которые не находит очевидного иммунологического объяснения.
Прежде всего, у пожилых людей, пострадавших от гриппа или спровоцированной им пневмонии, наблюдаются удивительно долгие их последствия, существенно ускоряющие прочие патологические процессы и движение человека в сторону старческой беспомощности, а в конечном итоге и на кладбище. По многим данным, перенесенный в солидном возрасте грипп повышает риск смерти от неожиданных причин типа инфаркта миокарда и инсульта, а также от как будто не связанных с этой инфекцией респираторных заболеваний; кроме того, обостряется течение застойной сердечной недостаточности.
Далее, такое долгое выздоровление биологически старых людей от гриппа, накладываясь на их общую слабость, обусловленную другими аспек-тами старения, вероятно, способствует серьезной, зачастую пожизненной функциональной деградации и инвалидизации. Грипп нередко укладывает пожилого человека в больницу, порой на целых три недели, а исследования показывают, что каждый день постельного режима означает для него потерю до 5% мышечной силы и 1% аэробической выносливости. Однако, видя, как женщина в возрасте с трудом открывает дверь или, поскользнувшись на льду, ломает себе шейку бедра, никто не думает о перенесенной ею простуде или иммунологическом старении.
Можно вспомнить и о других старческих недугах, в развитии которых, по–видимому, существенную роль играют клоны анергических Т–клеток, но свидетельства этого не настолько очевидны. Одна из таких патологий – остеопороз. У пожилых женщин с остеопорозными переломами обнаружены более высокие уровни анергических CD8–клеток, чем у их сверстниц со здоровыми костями. При этом некоторые молекулярные механизмы наводят на мысль, что обилие таких дефектных лимфоцитов являются именно причиной, а не следствием снижение плотности и прочности костной ткани.
Кроме того, несмотря на сравнительную спекулятивность данного предположения, ползучая “клонализация” Т–клеточной популяции могла бы влиять даже на ход атеросклероза. Она ведет к хроническому воспалительному процессу, который, как известно, портит артерии, способствуя возникновению инфаркта миокарда. В пользу этой гипотезы говорит более высокий, чем у здоровых людей, уровень анергических CD8–клеток у пациентов с ишемической болезнью сердца – как при ЦМВ–инфекции, так ив ее отсутствие 23. Таким образом, ослабление иммунной системы является, по–видимому, как облегчающим фактором, так и результатом инфекционного поражения артерий, которое в свою очередь благоприятствует развитию атеросклероза со всеми его потенциальными последствиями.
Как уже говорилось, точные доказательства связи анергических клонов Т–клеток с этими отдаленными эффектами пока отсутствуют. Однако пара интересных исследований в рамках осуществляемого сейчас Европейским союзом проекта Т–КИС (Т–клеточный иммунитет и старение), уже приблизил нас к более четкой оценке летальной роли этой причины возрастного иммунодефицита – что бы в конечном итоге ни было написано в свидетельстве о смерти.
Эти исследования касались двух когорт “самых старых” жителей Швеции, т.е. тех, кому за 80 24 и за 90 25,26, причем охватывали только людей, практически здоровых по сравнению с большинством своих хронологических сверстников: с отсутствием в анамнезе серьезных заболеваний сердца, головного мозга, печени и почек, без рака, диабета, признаков активных инфекций или химических маркеров воспаления и не принимающих никаких лекарств, заметно действующих на иммунную систему, включая недавние вакцинации. Европейские ученые обнаружили даже среди этих относительно здоровых стариков несколько человек с комплексом скрытых иммунологических дефектов (“фенотипом иммунного риска”), например различными формами возрастного поражения, которые можно объяснить ЦМВ–инфекцией, а значит, в не меньшей степени и клональной экспансией анергических ЦМВ–специфичных CD8–клеток.
Тот факт, что некоторые представители изученной здоровой, несмотря на большую хронологическую старость (по современным стандартам) выборки были свободны от клонов анергических Т–клеток, позволил проследить их “чистый” эффект в подгруппе, где присутствие таких лимфоцитов могло действительно способствовать развивающимся в следующие два года болезням, а не являться их результатом.
Никого не удивил результат наблюдений: фенотип иммунного риска, как и предполагалось, повышал вероятность скорой кончины, однако масштабы такого влияния шокировали. Оно было особенно выражено в группе людей старше 90, где этот дефицит позволял объяснить 57% смертности. Напоминаем: речь идет о возрастном ослаблении иммунной системы, вызываемом вирусом, активность которого многими из нас вообще не замечается, а в прочих случаях обычно ощущается лишь как легкое недомогание с повышением температуры.
Важно правильно понять все значение этого открытия. Фенотип иммунного риска способствовал всем причинам смертности, а не только повышал риск умереть от инфекционной болезни. Хотя внешние патогены, действительно, убивают многих биологически старых людей, микробные атаки объясняют полученные результаты далеко не полностью.
Война против клонов
По мере накопления данных, говорящих о роли клонов ЦМВ–специфичных CD8–клеток в возрастном ослаблении иммунитета, стала приоткрываться и светлая сторона этого феномена. Если иммунологическое старение в такой значительной степени объясняется экспансией Т–лимфоцитов, значит, ее предупреждение, а тем более обращение вспять должно (соответственно) защищать или восстанавливать молодое состояние иммунной системы независимо от нашего хронологического возраста. А значит, вакцины будут действовать на стариков так же эффективно, как и на юношей. И пожилые люди сбросят неподъемный груз инфекций, от которых молодежь избавляется, всего лишь пару ней не походив в школу или на работу.
Один из вариантов профилактики, поддерживаемый многими иммунологами, – вакцинация против ЦМВ. Еще до того, как выяснилась центральная роль ЦМВ–инфекции в возрастном ослаблении иммунной системы, опубликованный в 1999 доклад Медицинского института Национальной академии наук США, отмечая неудовлетворительные темпы разработки новых вакцин, поставил на первое место в списке неотложных задач создание эффективной анти–ЦМВ–вакцины. Подчеркнем, что авторы доклада исходили только из накопленной к тому времени информации о человеческих и финансовых потерях, вызываемых этим вирусом. Позднее Национальное агентство США по программе вакцинации, придя к такому же выводу, запросило у правительства дополнительные средства на исследования в области вакцины против ЦМВ. Сейчас, когда получены четкие доказательства важной роли ЦМВ–инфекции в старении иммунной системы, многие специалисты высказываются за дальнейшее увеличение этих ассигнований.
Хотя польза такого подхода и выглядит бесспорной, стоит напомнить, что речь идет главным образом о профилактической стратегии. Она снизит риск заражения ЦМВ и, возможно, усилит иммунный ответ на него уже инфицированных людей, но не избавит их от вируса полностью и, естественно, не устранит накопленного за долгие годы его присутствия иммунологического ущерба. Следовательно, такая вакцина спасет относительно небольшой процент младенцев от тяжелых врожденных дефектов и предотвратит безвременную кончину многих больных СПИДом и пациентов с пересаженными органами, однако почти не улучшит состояния сотен миллионов людей, уже страдающих от хронических инфекций и повышенной чувствительностью к патогенам из–за ослабления иммунной системы клональной экспансией анергических CD8–клеток.
Другие предложения, хотя бы потенциально устраняющие некоторые аспекты иммунологического старения, связаны с попыткой лечения дефектов уже существующих анергических Т–клеток методами генной терапии. Идея в том, что снабжение этих лимфоцитов генами, кодирующими их утраченные или недостаточно активные белки (например, CD28–рецептор или теломеразу), позволило бы восстановить эффективность выполнения ими своих специфических задач и предупредить угнетение прочих Т–клеточных популяций. Хотя подобный подход и выглядит логичным, польза его представляется слишком ограниченной, а путь клинической разработки – чересчур туманным. Что же касается конкретно теломеразы, последствия ее активизации в любой клетке вызывают еще много вопросов и требуют более серьезного рассмотрения. Эти сомнения связаны с еще одной возрастной патологией – раком. Я подробно остановлюсь на нем в гл.12, а сейчас ограничусь лишь кратким пояснением. Поскольку необходима хотя бы крошечная теломера для продолжения делений, каждое из которых ее укорачивает, клеткам с потенциально канцерогенными мутациями для превращения в злокачественную опухоль требуется механизм восстановления теломеры. Почти все раковые клетки запускают его, срывая собственные тормоза с теломеразных генов. Стоит ли снабжать этими генами дефектные клетки, тем более учитывая риск случайного “заражения” геннотерапевтическими векторами “посторонних” клеток, в которых ни в коем случае нельзя включать теломеразу?
Более правомерным решением выглядит не реабилитация бездействующих лимфоцитов, а их уничтожение. Пожилым носителям ЦМВ, по–видимому, не хватает функциональных Т–киллеров, нацеленных на зараженные этим вирусом клетки. Причина такого дефицита – перенасыщение организма огромными субпопуляциями анергических лимфоцитов. Даже если нам удастся вернуть всем им полную иммунологическую компетентность, они будут создавать проблему, все еще ограничивая ресурсы, необходимые для сохранения наивных лимфоцитов и клеток памяти, необходимых для защиты от других патогенов.
Теоретически все выглядит просто. Избавившись от анергических Т–клонов, мы освободим иммунологические пространство для здоровых клеток других типов и специализаций, а том числе и для активных нацеленных на ЦМВ лимфоцитов.
Остается решить вопрос: как очистить организм от расплодившихся бездельников, оставив в живых всех (или хотя бы почти всех) их заложников, которых мы хотим избавить от угнетателей–тунеядцев. Онкологи уже располагают достаточно эффективными и не слишком вредными для организма в целом лекарственными и радиационными методами уничтожения сравнительно крупных опухолей в конкретных участках тела, однако этот подход неприменим в случае анергических Т–клеток, не сконцентрированных в отдельных местах, а распределенных по различным тканям и органам. По той же причине бесполезно говорить о хирургическом вмешательстве. Опухоль можно вырезать (или как минимум урезать), добившись с определенным иском того или иного клинического улучшения. Однако в ближайшем будущем никаких способов индивидуального хирургического удаления анергических Т–клеток не предвидится.
Тем не менее, несмотря не неприменимость традиционных противораковых методов в качестве образца для разработки необходимой нам биотехнологии, последние впечатляющие успехи онкологов наводят на мысль о принципиальной возможности терапии, обеспечивающей избирательное избавление организма от не желающих умирать клеток.
Аромат Гливека
Даже если никто из ваших знакомых не болен раком, вы вполне могли слышать о гливеке (STI–571, или иматинибе), ирессе (ZD1839, или гефитинибе), герцептине (трастузумабе) и других менее известных или еще прокладывающих путь к больным лекарствах той же группы. Речь идет о так называемой “прицельной противораковой терапии”, которую с полным основанием считают революционным новшеством. Даже формулировки типа “чудесных исцелений”, абсурдно часто используемые в популярной медицинской литературе, не кажутся преувеличением тем, кто лично наблюдал исчезновение злокачественных опухолей в собственном теле или в организме своих близких, не сталкиваясь при этом с тяжелейшими побочными эффектами облучения и химиотерапии. Конечно, эти лекарства тоже дают побочные эффекты – от них не свободно ни одно “нарушающее метаболизм” средство. Например, герцептин нацелен на ростовой рецептор HER–2: связывая его, он препятствует неконтролируемому размножению раковых клеток, которое стимулируется избытком копий этого рецептора на их поверхности. Однако нормальные клетки размножаются “как надо” тоже благодаря HER–2–стимуляции, только сравнительно слабой. А в результате применение герцептина может вызывать смертельно опасную застойную сердечную недостаточность– побочный эффект, который недавние исследования обнаружили также у некоторых пациентов, пользующихся гливеком, который считался в высшей степени безвредным медикаментом – именно потому, что нацелен только на аномальную форму одного из трансдукторов ростовых сигналов.
Аналогичным образом, влияя на устойчивость анергических Т–лимфоцитов к апоптозу, можно было бы стимулировать их “самоубийство”, однако остается вопрос: как не погубить попутно нормальные клетки?
Я уверен, что мы сумеем воспользоваться уже применяемой прицельной противораковой терапией (и, очевидно, будущими ее методами, еще находящимися на разных стадиях клинической разработки), создав на этой основе “умные бомбы”, разрушающие анергические Т–клетки (и другие типы внутренних врагов, которые мы обсудим позже) с минимальными потерями для здоровых компонентов организма 28. Можно, например, было бы соединять тщательно подобранные токсины с молекулами, которые избирательно связывались бы с характерными поверхностными белками анергических клонов, в результате непосредственно убивая таких паразитов, а не просто вызывая в них метаболические нарушения.
Свет убивает вампиров
Один из противораковых методов, который можно было адаптировать для уничтожения наших анергетических Т–клеток, – фотодинамическая терапия (ФДТ). Больной получает лекарство, которое при освещении лазером либо сильно разогревается, либо выделяет массу свободных радикалов. Уже известны вещества, обладающие такими свойствами и избирательно поглощаемые раковыми клетками, в результате фотосенсибилизируя их, но, при этом, практически не изменяя свойств нормальных тканей. Эти средства не дают эффекта, пока на них не действует определенное низкоэнергетическое лазерное облучение, которое со своей стороны никак не сказывается на людях, не получавших таких медикаментов: лучи без всякого вреда проходят сквозь их тело. Однако, когда они проникают в клетки, накопившие фотодинамическое лекарство, его свойства приводят к их резкому разогреванию или насыщению свободными радикалами. В результате эти раковые клетки гибнут, а все остальные (не считая находящихся в непосредственной близости) никак не страдают.
Первое ФДТ–средство, Фотофрин, было допущено в развитых странах для лечения далеко зашедшего рака легких, пищеварительного тракта и мочевыводящих путей еще в начале 1990–х. Сейчас используются или находятся в завершающей стадии разработки более совершенные варианты такой терапии. Самое перспективное из ее средств, Рс–4, избирательно накапливается в определенных типах раковых клеток, поскольку хорошо растворяется в жирах, которыми особенно богаты эти клетки. Проникнув в них, Рс–4 благодаря особенностям своей структуры встраиваются в митохондрии, подробно рассмотренные мною в главах 5 и 6. Последующее лазерное облучение запускает свободнорадикальную бомбежку, которая либо индуцирует апоптоз, либо – в худшем случае – убивает раковые клетки“грязным способом”, сшивая их белки, окисляя липидные мембраны, разрушая ДНК мутациями.
Молекулярный универсальный нож
Сейчас специалисты, работающие на переднем крае медицины, связывают большие надежды с развитием нанотехнологии – молекулярной инженерии, которая позволила бы избирательно уничтожать раковые клетки и могла бы привести к разработке прицельной терапии для борьбы с другими вредными клетками, в том числе с анергическими Т–клонами. Один из подходов в этой области использует дендримеры – древовидные полимеры со сложной ветвящейся структурой, образующей крошечную сферическую частицу (см. Рисунок 2). Ветви дендримеров сконструированы таким образом, что могут присоединять разнообразнейшие молекулы. В результате они аналогичны универсальному складному ножу: множество инструментов в одной компактной упаковке. Дендример может нести одновременно молекулу, нацеливающую его на определенный тип клеток, один или несколько токсинов для уничтожения этих мишеней плюс (если надо) метку, позволяющую ученым или врачам следить за миграцией по организму все-го этого набора.
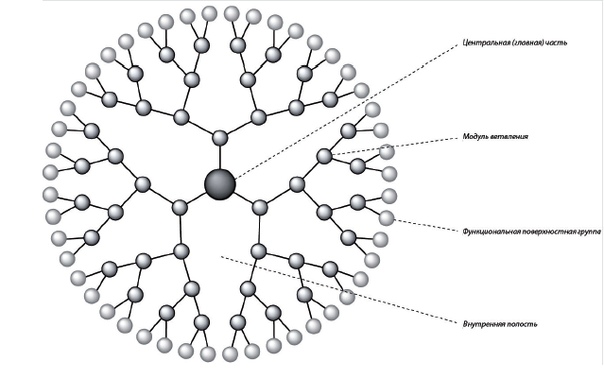
Один из испытываемых сейчас дендримеров загружен фолиевой кислотой (витамином В9), противораковым агентом метотрексатом и флуоресцентным красителем флуоресцеином. Витамин нужен для наведения этой бомбы на раковые клетки. Многие из них жадно поглощают фолат, поскольку он нужен для синтеза ДНК – процесса, особенно интенсивно идущего при злокачественном росте, подразумевающем частые клеточные деления с предшествующим копированием генетического материала. Для удовлетворения своих потребностей в этом витамине многие раковые клетки“обучаются” выращивать на своей поверхности целые леса из связывающих его рецепторов.
Описанный дендример испытывался на мышах, которым привили носоглоточный рак человека. Эти опухоли быстро росли, примерно через 50 суток достигая плато своего увеличения. Когда одной группе таких животных вводили низкие дозы метотрексата, терапевтического эффекта практически не наблюдалось (см. рис.3). Доза, в четыре с лишним раза превышающая первую, существенно замедлила развитие опухолей, однако не принесла особой пользы животным: половина из них в течение 39 дней умерла либо от самого рака, либо от побочных эффектов лечения. Увеличение дозы еще на 50% почти остановило злокачественный рост, но опять же тяжело отразилось на пациентах: мыши быстро потеряли треть массы тела, и половина их за месяц эксперимента погибла.

Совсем иная картина наблюдалась при нацеливании того же самого медикамента с помощью дендримера. Минимальная из испытанных в предыдущем опыте доз метотрексата замедляла в данном случае рост опухоли также, как и средняя, демонстрируя при этом намного более низкую токсичность.
В следующем исследовании та же группа сравнивала эффекты минимальной дозы чистого метотрексата и той же дозы, нацеливаемой дендримером, в течение более длительного периода – 99 суток. Не получавшие лечения мыши начали погибать примерно через 50 суток. Чистый метотрексат улучшил выживаемость незначительно. Зато лекарство, нацеленное дендримером, позволило дожить до конца эксперимента 38% животных. Что особенно впечатляло: одно из них за 39 суток полностью вылечилось от рака. Опять же, дендримерное нацеливание метотрексата делало его нетоксичным.
Замена пилы зубочисткой
Ценность дендримеров, как и универсального ножа, в их легкой адаптации к разнообразным задачам. В экспериментах исследователи присоединяютк ним всевозможные нацеливающие молекулы и противораковые агенты. Один из наиболее остроумных вариантов такого подхода – “дендримеризация” борной нейтрон–захватной терапии (БНЗТ). Принцип такого лечения был впервые предложен более полувека назад, но применить его на практике до сих пор не удавалось.
БНЗТ несколько напоминает фотодинамическую терапию. Сначала пациенту вводят изотоп бора. Когда раковые клетки накапливают достаточные его количества, человека облучают низкоэнергетическим потоком нейтронов. И применяемый бор, и нейтроны сами по себе для нас практически безвредны. Однако когда ядра изотопа сталкиваются с потоком этих частиц, они поглощают их, становясь крайне нестабильными (радиоактивными), и начинают испускать жесткое альфа–излучение. Оно губит содержащие бор клетки и их ближайших соседей, но быстро теряет энергию и становится безопасным для остального организма. Результат – высокоизбирательное воздействие с минимальным побочным эффектом.
Естественно, самым сложный момент БНЗТ – введение бора исключительно в раковые клетки, чтобы после приема его изотопа нейтронное облучение не вредило здоровым тканям. С 1951 ученые пытались использовать такой метод против редкой, крайней агрессивной и плохо поддающейся лечению формы рака головного мозга, так называемой мультиформной глиобластомы. До сих пор достигнутые успехи были невелики и не позволяли превратить БНЗТ в стандартный метод лечения этой болезни.
Однако недавно в опытах на животных с мульформной глиобластомой дендримерное нацеливание бора позволило получить весьма многообещающие результаты. В головной мозг крыс имплантировали человеческие глиобластомные клетки с третьей мутантной версией рецептора эпидер-мального фактора роста (РЭФР), известной как РЭФРвIII, которая встречается в большинстве случаев такого рака. Затем дендримеры загружали бором, прикрепляли к ним нацеливающие агенты – моноклональные тела к РЭФРвIII – и натравливали эти агрегаты на опухоли, т.е. просто вводили больным животным. Для более четкой демонстрации преимуществ нового метода его результаты сравнивали с состоянием целых трех контрольных групп: одна из них не получала никакого лечения, во второй крысам давали п–борфенилаланин (БФА), давший наилучшие результаты в прежних версиях БНЗТ, а в третьей – загруженные бором дендримеры в сочетании (но без химической связи) с БФА. В течение суток около 60% введенной дозы дендримеров, несущих БФА, связалось с мутантными рецепторами раковых клеток. Это обеспечило примерно втрое более высокую противоглиомную концентрацию активного вещества, чем при использовании одного БФА. Захват обоих лекарств нормальными тканями был пренебрежимо слабым. Вдохновленные таким удачным нацеливанием, исследователи стали ждать результатов собственно лечения.
Эти результаты были однозначными (см. рис.4). Не получавшие никакого лечения животные жили в среднем 26 дней. Использование БФА продлевало этот срок до 40 суток: существенное улучшение, но все же грустный прогноз. Крысы, получавшие бор, нацеленный денримерами, жили в среднем 70 дней, причем некоторые из них не умирали полгода и считались “выздоровевшими” (по аналогии с лечением, обеспечивающим пятилетнее выживание раковых людей, поскольку продолжительность жизни здоровых крыс около 30 месяцев). Если же животным вводили нагруженные бором дендримеры вместе с БФА, средняя продолжительность жизни достигла целых 85,5 дней. Это в три с лишним раза превысило показатель, наблюдавшийся без всякого лечения, и более чем вдвое –результат применения лучшего на сегодняшний день экспериментального варианта БНЗТ. Кроме того, 20% крыс, получавших БФА вместе с дендримерами, “выздоровели” в соответствии с указанным выше критерием.

На экспериментальных моделях были успешно испытаны дендримеры с различными нацеливающими и противораковыми агентами. Это первое поколение нанотехнологических лекарств четко продемонстрировало: у нас есть высокоэффективный и гибкий способ точечной бомбардировки злокачественных клеток с известными поверхностными рецепторами, который в принципе применим и для уничтожения анергических Т–лимфоцитов.
Доведение до самоубийства
В наши дни генная терапия широко применяется на подопытных мышах: с ее помощью тестируют аналогичные способы лечения людей, исследуют эффекты включения и выключения отдельных генов, моделируют человеческие болезни, модифицируя мышиные клетки для придания им большего сходства с нашими. Практическое использование генной терапии в обычных больницах, судя по результатам экспериментов, – всего лишь вопрос времени. Ее необходимость для лечения врожденных болезней и потенциальная польза при широком спектре других медицинских проблем, включая СПИД, ревматоидный артрит, травмы и реконструкция зубной ткани(список можно продолжить), – достаточные стимулы, чтобы продолжать фундаментальные и клинические исследования, которые довели бы до ума соответствующие методики.
Один из вариантов такой генной терапии – встраивание в наши Т–клетки нового суицидального (апопотозного) механизма, включающегося с приобретением ими анергичности. Ученые уже научились вводить мышам(и другим лабораторным животным) гены, активируемые только в присутствии определенного фактора – антибиотика, ультрафиолета, сахара или даже повышенного уровня кальция. Фактически это позволяет нам произвольно включать и выключать специфические клеточные функции.
Введение в клетку экспрессируемых по желанию исследователей генов до сих пор было лишь мощным инструментом изучения их эффектов. Однако сейчас всерьез рассматривается применение этого подхода в медицинских целях. Если эти гены будет активироваться не внешними факторами, а определенным белком, внутренний синтез которого характерен для нежелательных нам клеток, фактически мы получим новый способ их избирательного уничтожения.
Как и в случае других, обсуждавшихся выше прицельных методик, первыми разработкой такого подхода занялись онкологи. Уже говорилось, что для роста раковой опухоли ее клеткам необходима способность восстанавливать свои теломеры. Иначе в ходе частых клеточных делений эти структуры быстро исчезнут – задолго до возникновения серьезной угрозы для нашего здоровья. Обычно такая способность возникает в результате активации отключенного гена, кодирующего фермент теломеразу. Этот ген присутствует во всех наших клетках, но рано или поздно инактивируется и уже никогда или большую часть времени никак себя не проявляет. Следовательно, “заражая” клетки пациента “суицидальным геном”, который включался бы при повышении уровня теломеразы, мы снабжали бы их внутренним механизмом самоуничтожения. Это избавило бы нас от необходимости нацеливать на раковые клетки лекарства или иммунную систему. Образно говоря, враг, едва решившись на агрессию, сам накладывал бы на себя руки.
В принципе, создать “суицидальный ген”, разрушающий клетку при наличии в ней определенного белка, вполне возможно. Фактически это уже делалось у лабораторных животных с экспериментальными раковыми опухолями при помощи регулирующих апоптоз генов. Невосприимчивость к апоптозным сигналам анергических Т–лимфоцитов можно преодолеть, упорно бомбардируя их приказами покончить с собой. Однако одна из разрабатываемых сейчас альтернатив намного перспективнее. Она использует легче контролируемый – и, следовательно, более безопасный – способ введения в клетку гена, кодирующего белок, который сам по себе практически без вреден, но активирует так называемое “пролекарство”, т.е. неактивную форму смертельного медикамента.
Пролекарства – это вещества, требующие для своего терапевтического действия определенной формы метаболизации организмом, т.е. химического превращения в фармакологически активное соединение. Большинство пролекарств активируется ферментами нашей печени, выпускающей в кровоток их полезные нам производные. Другие больше похожи на так называемых “спящих агентов”: они незаметно распространяются по всему организму и “залегают на дно” до тех пор, пока не получат заранее оговоренного сигнала, который заставляет их действовать, т.е. прицельно поражать свои мишени.
Примерно так работают некоторые антивирусные средства, например ганцикловир (Цитовен/Цимевен), используемый против герпеса. Он останавливает размножение вируса, не давая тому пользоваться необходимой для этого системой репликации ДНК клетки–хозяина. Говоря более конкретно, лекарство подавляет действие вирусного варианта тимидинкиназы (ТК), участвующего в синтезе ДНК фермента.
ТК готовит азотистое основание тимин (одну из “букв” генетического кода) к встраиванию в цепочку ДНК путем фосфорилирования, т.е. присоединения к его производному, тимидину, фосфатной группы, отделяемой от молекулы АТФ – нашей “энергетической валюты”. Ганцикловир ведет себя как молекулярный двойник ценного сотрудника, внедренный для диверсиина вражеское производство. Благодаря структурному сходству с тимидиномон обманывает вирусную ТК, которая по ошибке фосфорилирует лекарство.
После этого ганцикловир–фосфат продолжает свое черное дело, выдавая себя за тимидин–фосфат на сборочном конвейере ДНК и встраиваясь в ее синтезируемую цепочку. Задача внедренного агента выполнена: оказавшись в составе растущей молекулы, он останавливает ее дальнейшее удлинение. В результате вирус не может копировать свою ДНК, а значит размножаться. Его атака на организм прекращается. Иммунной системе остается лишь обнаружить и уничтожить немногочисленные клетки, в которых он прячется, никак не влияя на наше здоровье.
Если бы ганцикловир умел так же ловко обманывать не только вирусный, но и наш собственный, человеческий вариант ТК, его можно было бы с успехом использовать как противораковое средство. Злокачественные клетки становятся опасными за счет своего быстрого размножения. Значит, нарушив необходимый для клеточного деления синтез ДНК, можно эту опасность ликвидировать. Естественно, такой подход чреват серьезнейшими побочными эффектами, поскольку он одновременно нарушал бы необходимое организму размножение его нормальных клеток. В случае рака с таким ущербом еще можно было бы смириться – пациент оправился бы от него после отмены укротившего опухоль лекарства. Однако при борьбе с вирусом того же герпеса этот вариант абсолютно неприемлем.
В любом случае ганцикловиру редко удается провести человеческую ТК, поэтому он подавляет в основном репликацию вируса, хотя и несколько ухудшает у пациента регенерацию клеток крови и выработку сперматозоидов. Однако недавно группа японских и американских ученых продемонстрировала, что систему вирусная ТК/ганцикловир в принципе можно использовать для подавления рака. Надо лишь научиться с помощью генной терапии вводить этот фермент во все клетки пациента, но включать его только в злокачественных.
Как уже говорилось, одно из характерных отличий раковых клеток от нормальных, которое можно было бы использовать для избирательной активации вирусной ТК – присутствие активной теломеразы. Присоединив ген этой ТК к “пусковому механизму” (промотору), включающему транскрипцию только при наличии теломеразы, мы заставили бы вирусный фермент останавливать деление злокачественных клеток, тогда как почти во всех остальных он вообще не синтезировался бы.
Описанная схема напоминает биотехнологический эквивалент одного из хитроумных многоступенчатых приспособлений, которые используются в настольной игре “мышеловка”. Ученые ставят свою “ловушку”, сначала засевая все клетки пациента копиями гена, кодирующего вирусную ТК, в совокупности с реагирующим на теломеразу промотором. После этого пациент глотает таблетки ганцикловира, который опять же неизбирательно проникает во все его клетки.
В подавляющем большинстве из них лекарство никак себя не проявляет, поскольку почти по всему человеческому организму теломераза отсутствует. Однако, когда ганцикловир попадает в раковую клетку, ловушка срабатывает. Присутствующая там теломераза запускает образование вирусной ТК; та фосфорилирует ганцикловир, делая его пригодным для присоединения к растущей копии клеточной ДНК; синтезирующий ее фермент (ДНК–полимераза), принимая ганцикловир–фосфат за тимидин–фосфат (нормальную “букву” генетического кода), встраивает лекарство в незавершенную цепочку ДНК. В этот момент пора кричать: “Мышеловка!”, поскольку дальнейший синтез ДНК становится невозможным, клеточное деление – тоже, и рост раковой опухоли прекращается (см. Рисунок 5).

Схема сложная, но она действовала в пробирочных экспериментах на раковые клетки печени, почек, поджелудочной и щитовидной желез. Более того, была доказана ее практическая безопасность для нормальных клеток крысиной щитовидки и человеческой кожи 34. В результате ученые перешли к следующему этапу ее реализации – клиническому испытанию на лабораторных животных.
Сначала они изготовили две партии гена вирусной ТК: у одной промотор активировался теломеразой, а у другой должен был “включаться” как в раковых, так и в нормальных клетках. Потом они ввели такие молекулярные конструкции в вирусы того же семейства, что и возбудители обычной простуды, позволив им буквально заразить животных генетическими “ловушками”. Первыми получили их здоровые особи – для проверки потенциальных побочных эффектов. Как и ожидалось, вирусная ТК, синтезируемая с участием неизбирательного промотора, после инъекции ганцикловира привела к тяжелому поражению печени. Если же ее ген был связан с промотором, активируемым теломеразой, отрицательных последствий практически не наблюдалось – впрочем, как и положительных, поскольку раковые клетки, экспрессирующие теломеразу, тоже отсутствовали.
После этого ученые перешли к следующей стадии испытаний: тестированию этой терапии на животных с имплантированными клетками человеческой карциномы щитовидки. Когда им ввели ген вирусной ТК с промотором, активация которого не зависит от присутствия теломеразы, рост опухоли полностью остановился, но, как и ожидалось, это одновременно не дало размножаться нормальным клеткам, что привело к тяжелому поражению печени.
Однако при избирательном нацеливании вирусной ТК на раковые клетки с помощью зависимого от теломеразы промотора ганцикловир прекратил рост опухоли так же эффективно, как и в предыдущем случае, но без наблюдавшегося при этом токсичного эффекта. Безопасность такого высокоселективного подхода становится еще более убедительной, если вспомнить, что вирусную ТК можно включать и выключать, соответственно вводя ганцикловир и прекращая его применение.
Знать врага в лицо
Очевидно, в поисках новых способов избирательного (т.е. безвредного для организма в целом) нацеливания на раковые клетки и их уничтожения биологи бывают такими же изобретательными, как и конструкторские бюро оружейных компаний. Следовательно, вполне можно ожидать, что уже применяемые или разрабатываемые противораковые методы удастся адаптировать для борьбы с анергическими Т–лимфоцитами. В данном случае враг, можно сказать, ходит с нарисованной прямо на груди мишенью. Аномальные рецепторные свойства, лишающие эти клетки способности распознавать целевые антигены (отсутствие CD28) и размножаться в ответ на инфекцию (присутствие одновременно KLRG1 и CD57), а, возможно, и некоторые другие метки (например, пониженный уровень CD154, связанный с недостаточной поддержкой старыми Т–лимфоцитами развития В–клеток) позволяют ученым легко распознавать этих вредителей и, следовательно, пригодны для нацеливания на них разрушающих агентов.
Обрушить гнев иммунной системы на ее угнетателей – цель заманчивая, однако иммунизация (и активная, и пассивная) против анергических лимфоцитов связана с существенными проблемами. Прежде всего, их самая характерная антигенная особенность – отсутствие поверхностного белка CD28. Можно, конечно, использовать для нацеливания сочетание рецепторов KLRG1 и CD57, но еще не ясно, все ли нежелательные лимфоциты экспрессируют эти два белка и не несут ли такие же метки другие, нужные нам, клетки. Правда, иммунологи уже идентифицируют анергические лимфоциты с помощью наборов антител, однако применять их для иммунизации затруднительно. Не стоит также забывать, что проблему придется решать в условиях слабого действия вакцинаций,мт.е. “уколы” против анергических Т–клеток, возможно, хорошо помогут только сравнительно “молодым” иммунологически индивидам. Следовательно, хотя такой подход и перспективен в отношении многих типов токсичных клеток, в случае CD8–клонов его достаточная эффективность вызывает сомнения.
Тем не менее, у нас в запасе остается еще много вариантов. Простейшим представляется применение дендримеров, позволяющих нацеливаться на клетки с помощью множества идентификационных меток, а заодно и воздействовать на мишени различными ядами – от явных токсинов до бора (при использовании БНЗТ).
В то время как вакцинация против анергических Т–лимфоцитов представляется проблематичной, существует и другой путь использования иммунной системы в качестве пятой колонны, помогающей восстановить власть правительства в изгнании. Если помните, анергические CD8–лимфоциты становятся проблемой, когда перестают подчиняться апоптозным приказам, ведущим в норме к демобилизации этих клеток после отражения атаки патогена, против которого они развертывались. Их строптивость объясняется выработкой избыточных количеств белка bcl–2: его высокий уровень блокирует апоптозные сигналы.
Это подразумевает возможность снятия такой блокады путем введения в не желающие умирать клетки “антисмысловой РНК” – отрезков генетического материала, комплементарных к транскрибируемым с ДНК матрицам для синтеза bcl, а в результате их инактивирующих. В результате выработка bcl–2 как минимум ослабляется. Когда его уровень падает до нормы, а то и практически до нуля, анергические CD8–клетки снова начинают “слышать” приказы самоуничтожиться – и подчиняться им.
Приведет ли очистка “иммунологического пространства” от анергических Т–клеток к полному омоложению иммунной системы? Не могу утверждать этого с уверенностью, поскольку на практике такой вариант еще не проверялся, а наш организм – невероятно сложная машина, у которой известны еще далеко не все части, не говоря уже об их функциях и взаимодействиях. Проведенные на сегодняшний день исследования четко указывают на достаточно сильное прямое и косвенное иммуносупрессивное действие этих лимфоцитов. Следовательно, избавление от них должно существенно усилить Т–клеточный иммунитет и, вполне вероятно, улучшить работу других, зависящих от Т–клеток компонентов иммунной системы. Однако насколько выраженными будут эти положительные эффекты, мы узнаем, только когда изучим их непосредственно.
Сейчас же мне ясно, что ликвидация анергических Т–клонов не отразится как минимум на одном аспекте иммунологического старения – возрастной инволюции тимуса. Тимус, или вилочковая железа, находится непосредственно за грудиной. Здесь созревают, превращаясь в Т–лимфоциты, иммунные клетки, вырабатываемые костным мозгом. С возрастом ткани тимуса постепенно отмирают, его размеры сокращаются, и он дает нам все меньше наивных Т–лимфоцитов. Естественно, это ограничивает возможности организма реагировать на новые угрозы.
В принципе, существует достаточно очевидный способ решения этой проблемы: стволовоклеточная терапия – весьма перспективная уже в ближайшем будущем методика, на которой я остановлюсь в следующей главе (см. там врезку “Реконструкция тимуса”). Речь идет о превращении недифференцированных эмбриональных (стволовых) клеток в специализированные клетки практически любых тканей, что позволило бы лечить, восстанавливать и омолаживать различные органы. Эти проблемы уже достаточно быстро решаются в экспериментах со всевозможными тканями по всему нашему телу, так что есть веский повод для оптимизма.
Источник: m.vk.com