Нерешаемые проблемы биологии: нельзя создать два одинаковых организма, нельзя победить рак, нельзя картировать организм на геном
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2018-06-02 09:00
Технологии галопируют впереди концепций.
Мы уходим от изучения сложности организмов,
от процессов и организации к составным частям
Джеймс Блэк, Нобелевский лауреат, 1988 год
Введение
«Одним из самых ярких аспектов физики является простота ее законов. Уравнения Максвелла, уравнение Шрёдингера и гамильтонова механика могут быть выражены в нескольких строках. Идеи, составляющие основу нашего мировоззрения, также очень просты: мир подчиняется законам, и все основные законы соблюдаются повсюду. Все просто, аккуратно и выразительно с точки зрения повседневной математики, либо дифференциальных уравнений с частными производными, либо обыкновенных дифференциальных уравнений. Все просто и аккуратно — за исключением, конечно, мира. Всюду, куда бы вы не взглянули, — конечно, вне стен класса физики — человек видит мир удивительной сложности» [1].
Каданов и Гольденфельд [1] дают некоторые рекомендации, как исследовать сложный мир. Эти рекомендации так же просты, как физические законы: «Чтобы извлечь физические знания из сложной системы, нужно сосредоточиться на правильном уровне описания... Используйте правильный уровень описания, чтобы уловить явления, представляющие интерес. Не моделируйте бульдозеры кварками... нужно осознать, что сложность требует установок, совершенно отличающихся от тех, которые до сих пор были распространены в физике. До сих пор физики искали фундаментальные законы, справедливые для всех времен и во всех местах. Но каждая сложная система отличается от другой. По-видимому, нет общих законов для сложности. Вместо этого нужно извлекать „уроки“, которые, с проницательностью и пониманием, могут быть изучены в одной системе и применены к другой».
Такой выдающийся физик, как Нильс Бор, формулировал непознаваемость жизни, поскольку «мы, без сомнения, убили бы животное, если бы попытались довести исследование его органов до того, чтобы можно было сказать, какую роль играют в его жизненных отправлениях отдельные атомы... Минимальная свобода, которую мы вынуждены предоставлять организму, как раз достаточна, чтобы позволить ему, так сказать, скрыть от нас свои последние тайны» [2]. Это принцип неопределенности в биологии, который похож на принцип неопределенности в физике.
Если даже не убивать живое, то, вторгаясь с прибором для исследования внутрь живой системы, мы так искажаем ее свойства, что исследуем не ее, а продукт ее взаимодействия с прибором в месте этого взаимодействия. Поскольку принципиально невозможно исключить взаимодействие электрона с прибором, с помощью которого мы исследуем свойства электрона, мы не можем определить его скорость и координату одновременно. (Взаимодействие прибора с объектом, которое искажает свойства этого объекта, называют эффектом наблюдателя.)
Но принцип неопределенности и есть один из фундаментальных законов физики. Возможно, не будучи в состоянии сформулировать такие позитивные фундаментальные законы, как уравнение Шредингера или законы Ньютона, мы можем все-таки сформулировать запретительные законы для биологии.
Замечательный советский астрофизик Шкловский высказал такую точку зрения: «Наука — это сумма запретов. Нельзя создать вечный двигатель. Нельзя передать сигнал со скоростью, большей, чем скорость света в пустоте, нельзя одновременно измерить координату и скорость электрона» [3]. Это очень изящное определение дает возможный путь определения некоторых основных фундаментальных законов не только для физики. Законов запретительных. Законов «Нельзя».
И тогда можно спросить: существуют ли запреты биологии? Осознание таких запретов позволило бы не выполнять исследований, которые подпадают под действие запрета. На принципиально нерешаемые проблемы не следует тратить время и деньги. Также как на создание вечного двигателя.
Я пытался ответить на этот вопрос в своем обзоре «Фундаментальные запреты биологии», опубликованном в журнале «Биохимия» в 2009 г. [4].
Часть высказываемых здесь положений я публиковал ранее [5], [6]. Полная же версия этого обзора опубликована в «Биохимии» в 2018 г. [7].
Категории нерешаемых проблем
I. Нерешаемые проблемы вследствие стохастических мутаций при репликации ДНК
- Нельзя создать две идентичные особи. В том числе две одинаковые сложные клетки [4].
- Нельзя победить рак.
Мне также очень хотелось бы сформулировать и такой запрет: нельзя победить старость и естественную смерть, но на этой проблеме я не смогу остановиться ввиду ограниченности объема статьи и сложности проблемы и отсылаю читателей к недавним обзорам [8–10], оставляя проблему на их суд.
II. Нерешаемые проблемы вследствие взаимодействий в сложных системах, приводящих к непредсказуемым «эмерджентным» свойствам
- Нельзя на основании свойств признака установить его причины (обратная задача).
- Нельзя на основании известных причин, если они взаимодействуют между собой, установить однозначно свойства признака, вследствие возникающих свойств (прямая задача).
- Нельзя с определенностью предсказать реакцию сложной системы на внешнее воздействие.
III. Нерешаемые проблемы вследствие существования принципа неопределенности и эффекта наблюдателя в биологии
- Нельзя получить адекватную информацию о клетках в их тканевом микроокружении путем выделения и анализа single cells — транскриптома, протеома и т.д. В частности, нельзя на основании культур стволовых клеток делать выводы о свойствах стволовых клеток в их нишах.
- Нужно помнить, что зонд, введенный в систему для наблюдения, меняет ее свойства, по крайней мере в месте положения зонда (эффект наблюдателя).
Эту проблему я упомянул во введении. Ее, по-видимому, первым сформулировал Нильс Бор. Ее я также не смогу обсудить и также отсылаю читателя к обзорам [11], [12].
Эта система запретов, в частности запрет на идентичность организмов вследствие неизбежных стохастических мутаций, приводящих к чрезвычайной внутриорганизменной и межорганизменной гетерогенности, призывает к осторожности, точнее ставит пределы надеждам на персонализированную медицину [13], [14].

Иногда исследователю приходится проводить научный поиск в сложной системе запретов
рисунок Алёны Беляковой
На проблемах, которые я уже обсуждал в недавних обзорах, остановлюсь очень кратко, оперируя в основном самыми последними данными и отсылая читателей к ним и к цитированной в них литературе. Основной фокус этой статьи сосредоточится на проблеме II «Нельзя победить рак». Она в полной мере иллюстрирует все сложности, с которыми приходится сталкиваться биологическим наукам, и всю недостаточность аппарата исследований, которым они сейчас пользуются.
Остальные проблемы рассмотрю конспективно.
I.1. Нельзя создать две идентичные особи, в том числе две одинаковые сложные клетки
Эти запреты связаны с постоянно происходящими при репликации ДНК разного рода мутациями — в разных тканях разная скорость, но в среднем около трех мутаций на каждое деление клетки.
Взрослый человеческий организм состоит приблизительно из 1014 клеток. Игнорируя, что разные ткани могут достигать полной дифференциации в разное время и что клетки могут погибать, оценка числа клеточных делений N, в результате которых образуется конечная дифференцированная клетка, дает величину N?46. Если мы примем на основании имеющихся данных скорость мутаций 10?9 и длину генома 3?109 нуклеотидов, то конечная соматическая клетка в результате получит примерно 120 мутаций, отличающих ее от исходной. Соседняя клетка получит столько же, но они будут расположены в других местах (стохастика!). Итак, каждые две клетки взрослого организма будут отличать друг от друга более чем 200 мутационных замен. Вероятность, что найдется две клетки, у которых положения всех 100 мутаций будут совпадать, очень низка. Таким образом, индивидуум представляет собой мозаику разных клеток .
«Биомолекула» уже недавно публиковала обзор по генетическому мозаицизму: «Геномная головоломка: открой в себе мозаика» [15]. — Ред.
Такой теоретический вывод с приходом эры полногеномного секвенирования получает практические подтверждения [16–18]. Добавим к этому еще стохастику эпигенетических изменений [19], и мы придем к выводу, что нет двух генетически и эпигенетически одинаковых индивидуумов. Каждый человек с точки зрения строения генома и эпигенома уникален. Даже идентичные (гомозиготные) близнецы не идентичны [20–22].
I.2. Нельзя победить рак. Пока гены продолжают спонтанно мутировать, рак никогда не будет искоренен полностью. Он постоянно будет возникать. Лечение рака проблематично
Есть две стороны в этой проблеме: неизбежность возникновения рака в популяции и проблемы с его прогностической диагностикой и лечением.
Немного истории. В победу над раком вкладываются большие деньги
В декабре 2016 года Конгресс США принял закон о лекарствах (Cures Act) 21 века, выделив $1,8 млрд на 7 лет для финансирования «лунного выстрела» по раку (Cancer Moonshot). Вице-президент США Джо Байден по этому поводу выразил надежду, что к 2030 году мы будем жить в мире, где рак как таковой не будет существовать.
Когда Джон Ф. Кеннеди пообещал в президентской речи 1961 года посадить человека на Луну и благополучно вернуть его на Землю, он создал метафору «выстрел по Луне». Сегодня эту метафору используют для характеристики начала грандиозных амбициозных проектов, призванных поднять общество на новую ступень развития.
Обещание вылечить рак, которое дал президент Никсон в 1971 году, объявив войну раку и вложив в этот проект $100 млн — пример такого выстрела. Он закончился формальной неудачей. Рак не был побежден.

В победу над раком вкладывают большие деньги
рисунок Алёны Беляковой
Неудачей закончилась и вторая война против рака, хотя и менее амбициозная, объявленная в 2005 году Эндрю фон Эшенбахом, тогдашним главой Национального института онкологии США. Целью ее было победить рак к 2015 году.
Идея, что один миллиард долларов может ликвидировать рак, вводит общество в заблуждение. Каждый год новых исследований все более отчетливо показывает, насколько проблема рака сложна, и делает все менее реальной мысль о полной его ликвидации. Несомненно, потрясающим является прорыв в иммунотерапии рака , когда новые фундаментальных знания о механизмах иммунной организации организма привели к разработке методики, дающей небольшому числу пациентов такие длительные ремиссии, что речь может идти даже об излечении. Исследование рака находится в середине революции, и может быть на грани еще б?льшего успеха. Тем не менее в целом мы весьма далеки от победы над раком.
«Биомолекула» неоднократно писала о взаимодействии иммунной системы с раковыми клетками и об успехах иммунотерапии онкологических заболеваний: «Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль» [23], «Иммуностимулирующие вакцины» [24], «Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак» [25]. — Ред.
Научный лунный выстрел — это грандиозное, оптимистичное и достойное риска предприятие. Но проект не должен вводить общественность в заблуждение и наносить ущерб ее доверию науке. В этом отношении конечная цель проекта, как ее формулировал бывший вице-президент Байден, нереальна.
Неизбежность возникновения рака в популяции
В 1996 г. вышло широко известное интервью с выдающимся онкологом Альфредом Кнудсоном (Alfred G. Knudson), где он сказал: «Пока гены продолжают спонтанно мутировать, рак никогда не будет искоренен полностью. Думать иначе нереалистично... Но можно надеяться, что через четверть века мы минимизируем смертность от рака» [26].
На чем основывал Кнудсон свое утверждение?
Организм человека играет с огнем эволюции. Эволюционная неизбежность возникновения раковых опухолей
Раковая опухоль является результатом выработанного эволюцией процесса развития организма, требующего обновления тканей в процессе жизнедеятельности многоклеточного организма [27].
В эволюции выработался механизм, который заключается в отмирании старых клеток и замене их новыми. Этот процесс требует постоянного деления клеток на протяжении жизни организма. Но делятся не все клетки. После завершения процесса развития многоклеточного животного (человек — не исключение) почти в каждой ткани остаются способные к делению и не до конца дифференцированные клетки — так называемые взрослые стволовые клетки (ВСК) [28]. Когда старые клетки ткани отмирают, ВСК делятся и дифференцируются, превращаясь в конечные взрослые клетки. Так на смену умершим приходят свежие, и так продолжается всю жизнь. Но каждое деление клетки приводит к появлению мутаций в дочерних клетках [29]. Некоторые из мутаций в ВСК могут инициировать внутриорганизменные эволюционные события, приводящие к фатальной злокачественности. Таким образом, рак является платой за многоклеточность [29–31]. Можно думать, что вероятность заболеть раком увеличивается с количеством деления клеток в организме. В свою очередь из этого следует, что с увеличением продолжительности жизни увеличивается вероятность заболевания раком. Вот как это сформулировал норвежский ученый Ярл Брейвик (Jarle Breivik): «Рак — это естественное последствие старения, и чем лучше медицинская наука помогает продлению жизни людей, тем выше будет число больных раком в популяции» [32].
Теперь аксиоматично, что первопричиной рака являются повреждения генов, которые далее приводят к последующей эволюции сложной системы, представляющей собой раковую опухоль [33]. Ряд экспериментальных фактов надежно обосновывает этот вывод. В самое последнее время блестящие работы Кристиана Томасетти и Берта Фогельштейна показали, что вероятность возникновения рака определенной ткани практически пропорционально зависит от частоты делений стволовых клеток (см. ниже) этой ткани, то есть от частоты возникновения мутаций в ней [34].
Томасетти и Фогельштейн пришли к выводу, что ошибки копирования ДНК ответственны за 66% мутаций, тогда как 29% связаны с факторами окружающей среды и 5% — с наследственностью. В этих 66% рак — это стохастическая неудача индивидуума. Bad luck. Он не виноват. Он хорошо себя вел, не пил, не курил. Просто клетки мутировали, и случайно он получил неудачную мутацию.
Отсюда следует важнейший стратегический вывод, что главной стратегией борьбы должна быть ранняя диагностика. На ранних стадиях рак вылечить значительно легче, он еще не успевает обрасти защитными механизмами.
Заболеваемость можно снизить и за счет внешних факторов. Но изменения условий окружающей среды снижают заболеваемость только до уровня, определяемого стохастическими мутациями. В 2008 г. в США затраты на лечение рака составляли $93 млрд. Менее 15% финансирования исследований идет на раннее обнаружение, хотя раннее вмешательство гораздо более эффективно, чем лечение на поздней стадии. Наибольших успехов можно достичь путем переориентации исследований на профилактику и раннее обнаружение .
О молекулярных биомаркерах для ранней диагностики рака, об их поиске и значении для медицины рассказал Сергей Мошковский в недавней статье на «Биомолекуле» — «Омикс-биомаркеры и ранняя диагностика: когда счастье возможно» [35]. Также он дал комментарий и к этому обзору, с которым вы можете ознакомиться в самом конце. — Ред.
Лечение рака проблематично
Опухолевая клетка в своем геноме может содержать к моменту выявления опухоли (109 клеток, 1 г.) 10 000 мутаций. Доктор Глейзир (Glazier) (см. цитату в [29]) оценил возможное число различных клеток с таким количеством случайно распределенных мутаций как ~1068000! Таким образом, нет двух одинаковых клеток в одной опухоли, нет двух одинаковых клеток в разных опухолях. Кроме того, опухоли одного и того же типа отличаются у генетически разных пациентов [36]. Опухоль гетерогенна генетически и эпигенетически [37]. Все клетки в ней различны по генетической структуре. Среди них есть устойчивые к практически любым воздействиям [38]. При терапевтическом воздействии чувствительные клетки погибают, устойчивые остаются и дают начало новой опухоли — устойчивой к использованному терапевтическому воздействию. Так называемая молекулярная таргетная терапия, основанная на использовании в качестве мишени отдельных молекул или групп молекул, измененных в раковых клетках по сравнению с нормальными, неадекватна многослойной сложности рака.

Нет двух одинаковых клеток в одной опухоли, нет двух одинаковых клеток в разных опухолях
рисунок Алёны Беляковой
Впечатление такое, что чем глубже мы проникаем в интимные молекулярные детали, чем более фокусируемся на конкретных мишенях, тем более методы лечения становятся неадекватными комплексности проблемы. Исчерпывающее геномное генотипирование, вероятно, поможет только малой доле пациентов [39].
Развитие внутриопухолевой неоднородности создает также серьезные ограничения для выявления мутировавших молекул или сигнальных путей на основе молекулярного анализа биопсии опухоли. Результат молекулярного анализа одного образца биопсии из опухоли не обязан воспроизводиться в других ее частях. Поэтому лечение, основанное на этом анализе, вряд ли будет иметь большую пользу, поскольку в других частях активны другие клетки с другими молекулярными характеристиками, не поддающиеся данному воздействию [13].
Для понимания дальнейшего изложения мне представляется полезным дать краткое описание сложных систем, которые я уже упоминал и к которым относится любой живой организм и большинство его патологий.
II. Краткий экскурс в нерешаемые проблемы, вызванные сложностью систем
Детально рассмотрены проблемы сложных систем в недавних обзорах [5], [6], [40]. Здесь я даю только весьма краткое изложение основных моментов.
Сложная система — это многокомпонентная система, состоящая из взаимодействующих субъединиц, в результате взаимодействия которых появляются так называемые возникающие (emergent) свойства, присущие целой системе и не предсказуемые на основании свойств исходных субъединиц (см. ниже). Возникающие свойства являются важнейшим качеством сложных систем. Они не могут быть приписаны отдельным взаимодействующим компонентам, это свойства целой системы. При этом система может состоять из иерархических уровней, каждый из которых имеет свои возникающие свойства [41–45].
Сложные системы нелинейны и предельно чувствительны к начальным условиям [46]. Это означает, что траектория системы [41], определяемая как изменение ее состояния, например, во времени, непредсказуема. Две системы, состояния которых очень близки в начальный период, и которые функционируют согласно одинаковым правилам, будут иметь различные траектории с течением времени. Иммунная система, например, состоит из различных элементов (макрофагов, Т- и В-клеток и т.д.), которые взаимодействуют друг с другом путем обмена сигналами (в частности цитокинами). Даже при воздействии совершенно одинаковых стимулов иммунная система, как и другие сложные системы, в том числе раковая опухоль, может откликаться абсолютно различно.
Небольшие изменения воздействий на сложные системы необязательно дают небольшие же отклики системы. Нередко большой неожиданный эффект возникает в ответ на малое воздействие.
В сложных системах невозможно точно предсказать влияние факторов окружающей среды. В организме оно (так же как и влияние стохастических факторов) начинаются in utero и продолжаются на протяжении всей жизни индивидуума [22].
Наконец, сложные системы, как целое, не поддаются компьютерной симуляции [46], [47].
Редакция возьмет на себя смелость отметить, что, хотя абсолютно точное моделирование сложных систем и правда невозможно, во множестве практических случаев такие «симуляции» не только осуществимы, но и могут быть весьма полезны: «Пространственно-временное моделирование в биологии» [48], «12 методов в картинках: „сухая“ биология» [49]. — Ред.
II.1. Рак — это сложная система с большим количеством взаимодействий с окружающей средой, порождающей непредсказуемые возникающие свойства
Раковая опухоль сочетает в себе сложное, меняющееся во времени и пространстве многообразие клеток, каждая из которых имеет собственные сигнальные каскады, репликацию, транскрипцию и т.д. и претерпевает многочисленные изменения на пути превращения в раковую клетку. Ей присуща сложность растущей развивающейся системы со всеми ее признаками и свойствами, позволяющими ей противостоять антираковым агентам и индуцировать ту внутриопухолевую клеточную гетерогенность, которая делает опухоль уникальной для каждого пациента [36]. В этом отношении рак отличается от всех других болезней [50].
Однако сложность опухоли далеко не ограничивается наборами раковых генов и клеток, в той или иной степени влияющих на прогрессию опухоли. В своей последней версии отличительных особенностей (hallmarks) рака Дуглас Ханахан и Роберт Вайнберг [51] указывают, что опухоли проявляют еще и другое измерение сложности (tumors exhibit another dimension of complexity): опухоли, привлекают к своей эволюции широкий репертуар нормальных клеток, которые они приспосабливают для своих нужд, и которые способствуют приобретению отличительных критериев, создавая то, что называют микроокружением опухоли (tumor microenvironment), ее экологической нишей, и что играет важнейшую роль как в эволюции сам?й первичной опухоли, так и в ее метастазировании [52], [53]. Сегодня можно с уверенностью полагать, что, возможно, главная сложность опухоли — громадное количество взаимодействий между собственно раковыми (обычно эпителиальными) клетками и разнообразными стромальными клетками, составляющими микроокружение опухоли [54]. Раковая опухоль осуществляет симбиоз со своим окружением.
Терапевтические подходы можно направлять не на раковые клетки, а на разрушение взаимодействий внутри эволюционирующей раковой опухоли
В последние годы большой резонанс получил принципиально новый подход. Вместо того чтобы лечить мутации в раковых клетках, новая терапия сфокусирована на разрушении сложных взаимодействий раковых клеток с иммунными компонентами стромы, определяющих успех эволюции рака в организме. Эти взаимодействия позволяют раковым клеткам ингибировать иммунные клетки в своем окружении и, таким образом, избегать уничтожения иммунной системой.

Терапевтические подходы направляют на разрушение взаимодействий внутри эволюционирующей раковой опухоли
рисунок Алёны Беляковой
Успешное использование ингибиторов этих взаимодействий в клинике за последние пять лет [55–57] продемонстрировали, что рак может быть распознан иммунной системой, а иммунная система может регулировать и даже устранять опухоли [24].
Хотя эти методы лечения неизмеримо увеличили продолжительность жизни многих онкологических больных, большое количество пациентов со злокачественными заболеваниями не реагируют на терапию [58–60]. Кроме того, успехи сопровождаются многочисленными неблагоприятными аутоиммунными эффектами [61], [62]. В целом эффект терапии на конкретного пациента непредсказуем. Будущие исследования, вероятно, откроют новые перспективные иммунологические мишени или старые мишени в сочетании с другими иммунотерапевтическими подходами, химио- и радиотерапией, терапией онколитическими вирусами и малыми молекулами.
Полученные результаты лишний раз демонстрируют, что сложность остается сложностью. Ее отклик на воздействия непредсказуем.
II.2. Нерешаемые проблемы в исследовании взаимосвязей генотипа с фенотипом и расшифровке функциональной архитектуры генома
Теперь я хотел бы рассмотреть проблему нерешаемости определения точной карты геномных элементов, определяющих фенотипы организма, в частности определения функциональности некодирующих и нерегулирующих геномных элементов (так называемый мусор, junk) [63].
Сообщество исследователей функциональных элементов генома разделилось на два почти равных непримиримых лагеря, подобно лилипутам Джонатана Свифта в дебатах между «остроконечниками» и «тупоконечниками» относительно правильной практики разбивания яиц. Многие считают, что, например, транскрипты очень низкого уровня представляют собой огромный мир функциональных РНК только потому, что они существуют. Их противники думают, что есть основания подвергать сомнению этот взгляд. Несомненно, среди таких транскриптов могут быть обнаружены многие функциональные кодирующие и некодирующие РНК, но еще более вероятно, что подавляющее большинство этих транскриптов — просто junk.
Так кто же прав? Для ответа на этот вопрос нам нужно, прежде всего, определить смысл термина «функция».
В 2012 году авторы консорциума ENCODE [64] приписали «биохимические функции» 80% человеческого генома [65] на том основании, что они транскрибируются.
Цифра 80% противоречила представлению о том, что до 90% генома представляет собой junk. Но она была с энтузиазмом принята «детерминистами» (и верующими в разумное конструирование генома (Intelligent design)), потому что она, как казалось, свидетельствовала об отсутствии нефункциональных элементов в геноме.
Но эту трактовку остро критиковали сторонники эволюционного происхождения организмов и их геномов: если у элемента есть какая-то биохимическая активность, это не обязательно означает, что она имеет какое-либо значение для функционирования клетки и, особенно, всего многоклеточного организма. Согласно [66] и другим авторам, функциональный элемент должен отличаться тем, что он селектируется в процессе эволюции и поэтому сохраняется в геноме. Я в своем комментарии в BioEssays определил это так: транскрибируемый junk остается junk, если не приобретает селектируемую в эволюции функцию [67].
Такая функциональность защищена естественным отбором; если эта защита перестает работать, функциональный элемент будет накапливать вредные мутации и со временем потеряет свою функциональную активность [66].
Дэн Граур (Dan Graur) [68] предположил, что только функциональные части генома могут быть повреждены вредными мутациями, тогда как мутации в нефункциональных частях должны быть нейтральными. Из-за вредных мутаций каждая супружеская пара каждого поколения должна производить более двух детей, чтобы поддерживать постоянный размер популяции. Чем больше доля функционально важной части генома, тем больше потомков должно рождаться каждой парой, чтобы поддерживать размер популяции. Граур обнаружил, что, если 80% генома будут функционировать, потребуется неприемлемо высокая рождаемость. По его расчетам максимальная доля функциональных элементов в геноме человека не превышает 25%. Его выводы подтверждаются недавними данными, что 8,2% (7,1–9,2%) генома человека в настоящее время подвержены отрицательному отбору и, следовательно, вероятно, являются функциональными [69].
Граур размышляет: «Нет необходимости секвенировать всё под солнцем. Нам нужно секвенировать только те участки, которые, как мы знаем, функциональны».
Определение положения и функций всех функциональных элементов генома проблематично
Оценки Граура чрезвычайно ценны, особенно с эволюционной точки зрения, однако они не дают указаний на конкретные элементы генома, которые функциональны, и на конкретные функции, которые они выполняют.
Ответ на этот вопрос не может быть дан на основании анализа фенотипов, поскольку это потребовало бы решения так называемой обратной проблемы (inverse problem), которую в общем случае решить невозможно [70]. В случае сложных систем, особенно таких сложных, как организм, невозможно решить и прямую задачу — вывод свойств фенотипа из структур генома и других молекулярных компонентов, участвующих в формировании фенотипа. Эта невозможность обусловлена, взаимодействиями этих компонентов, порождающими непредсказуемые возникающие свойства.
Простейший парадигматический пример — прямая задача: из свойств молекул водорода и кислорода невозможно предсказать все свойства воды — ее температуру кипения, поверхностное натяжение, свойства как растворителя, удельный вес, способность замерзать, давая снежинки разнообразных форм и т.д. Это «фенотип» воды. Он возникает вследствие взаимодействий водорода и кислорода. Обратная задача: просто из свойств («фенотипа») воды невозможно вывести, какие компоненты ее составляют, и предсказать их свойства.
Для перехода к связям генома и организма я буду цитировать [текст в квадратных скобках — прим. автора] одного из самых уважаемых современных ученых и философов науки Сиднея Бреннера, Нобелевского лауреата, внедрившего в науку замечательную модель — нематоду.
«Последовательность генома человека когда-то была уподоблена отправке человека на Луну. Сравнение оказывается буквально правильным, потому что отправить человека на Луну легко; его возвращение, вот что сложно и дорого. Сегодня последовательность генома человека, так сказать, застряла на метафорической луне, и наша задача — вернуть ее на Землю и дать ей жизнь, которой она заслуживает. Все понимали, что получить последовательность будет очень просто, это проблема 3M Science — достаточности денег, машин и управления (Money, Machines and Management). Интерпретация последовательности для выявления функций, кодируемых ею, и регуляторных элементов и понимания того, как они интегрированы в сложную физиологию человека, всегда считалась сложной задачей, но поскольку легче продолжать коллекционировать данные, этой задачей [интерпретацией] на самом деле не были серьезно заняты» [70].
«Нет простого способа „картировать“ организмы на их геномы, если они достигли определенного уровня сложности. ...Предложения основывать все на последовательности генома, аннотируя его дополнительными данными [прямая задача], будут приводить только к увеличению его непонятности» [70].
Таким образом, мы попадаем в «ножницы невозможности». Предлагаю читателем самим сделать выводы, прочтя очень интересную статью Бреннера [70].
Чтобы убедить скептиков, я решил дать такую иллюстрацию. Посмотрите на рисунок. Может ли кто-либо представить себе, как выглядят хромосомы Эйнштейна, глядя на этого человека? Это обратная проблема. А с другой стороны — можно ли, глядя на хромосомы Эйнштейна, представить себе его внешний вид или умственные способности?
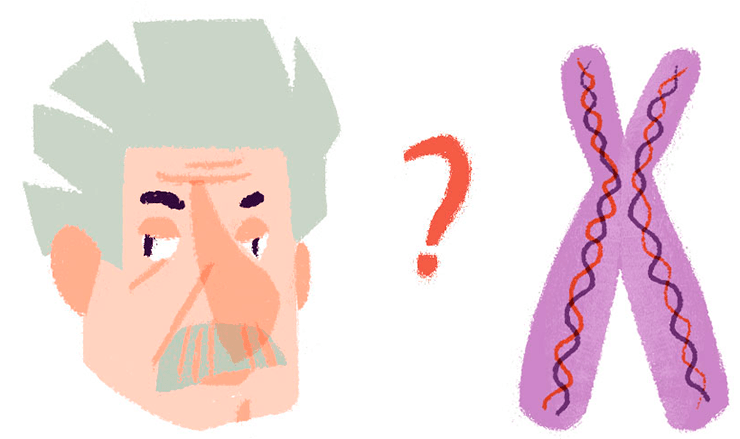
Нерешаемость прямой и обратной задач. Нельзя, глядя на Эйнштейна, узнать, какие у него хромосомы (обратная задача). Нельзя, глядя на хромосомы и даже зная их полную последовательность, предсказать свойства Эйнштейна (прямая задача).
рисунок Алёны Беляковой
Утешительное заключение
Эрика Чек [71] опубликовала интервью с Бертом Фогельштейном: «Берт Фогельштейн, иследователь геномики рака, один из первых, кто сам столкнулся со сложностью, убивающей одну из самых больших надежд геномной эры: что знание последовательности здорового и больного геномов позволит исследователям выявить генетические причины, вызывающие болезнь и проложат путь к лечению. Рак, подобно другим обычным заболеваниям, значительно более сложен, чем надеялись исследователи. ...[Но при этом] Берт Фогельштейн говорит, что даже если мы никогда не поймем биологию полностью, наше понимание достаточно, чтобы бороться с болезнью (он, естественно, имеет в виду рак). „Люди, — говорит он, — приспособлены к тому, чтобы, имея маленькую информацию, использовать ее с большим успехом. Вовсе не обязательно знать всё — это займет слишком много времени. ...Так что взрыв сложности не означает конец прогресса“».
Оригинал статьи опубликован в «Биохимии», том 83, № 4 [7].
Литература
- N. Goldenfeld. (1999). Simple Lessons from Complexity. Science. 284, 87-89;
- Бор Н. Атомная физика и человеческое познание. М.: Издательство иностранной литературы, 1961. — с. 22–23;
- Шкловский И. Эшелон. М.: «Новости». — с. 109;
- E. D. Sverdlov. (2009). Fundamental taboos of biology. Biochemistry Moscow. 74, 939-944;
- E. D. Sverdlov. (2016). Multidimensional complexity of cancer. Simple solutions are needed. Biochemistry Moscow. 81, 731-738;
- Свердлов Е.Д. (2014). Системная биология и персонализированная медицина: быть или не быть? Российский физиологический журнал им. И.М. Сеченова. 100, 505–541;
- Свердлов Е.Д. (2018). Нерешаемые проблемы биологии: нельзя создать два одинаковых организма, нельзя победить рак, нельзя картировать организм на геном. Биохимия. 4, 515–527;
- Anne Granger, Rosalind Mott, Nikla Emambokus. (2016). Is Aging as Inevitable as Death and Taxes?. Cell Metabolism. 23, 947-948;
- Jan Vijg, Eric Le Bourg. (2017). Aging and the Inevitable Limit to Human Life Span. Gerontology. 63, 432-434;
- Eric Le Bourg, Jan Vijg. (2017). The Future of Human Longevity: Time for a Reality Check. Gerontology. 63, 527-528;
- Joseph P. Zbilut, Alessandro Giuliani. (2008). Biological uncertainty. Theory Biosci.. 127, 223-227;
- Pierluigi Strippoli, Silvia Canaider, Francesco Noferini, Pietro D'Addabbo, Lorenza Vitale, et. al.. (2005). . Theor Biol Med Model. 2, 40;
- Ian F. Tannock, John A. Hickman. (2016). Limits to Personalized Cancer Medicine. N Engl J Med. 375, 1289-1294;
- От медицины для всех — к медицине для каждого!;
- Геномная головоломка: открой в себе мозаика;
- Donald Freed, Eric Stevens, Jonathan Pevsner. (2014). Somatic Mosaicism in the Human Genome. Genes. 5, 1064-1094;
- Ian M. Campbell, Chad A. Shaw, Pawel Stankiewicz, James R. Lupski. (2016). Erratum to: Somatic Mosaicism: Implications for Disease and Transmission Genetics. Trends in Genetics. 32, 138;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Na Zhang, Shumin Zhao, Su-Hua Zhang, Jinzhong Chen, Daru Lu, et. al.. (2015). Intra-Monozygotic Twin Pair Discordance and Longitudinal Variation of Whole-Genome Scale DNA Methylation in Adults. PLoS ONE. 10, e0135022;
- Alan G Baxter, Philip D Hodgkin. (2015). No luck replicating the immune response in twins. Genome Med. 7;
- Ray Greek, Mark J. Rice. (2013). Monozygotic Twins. Anesthesiology. 118, 230;
- Jenny van Dongen, P. Eline Slagboom, Harmen H. M. Draisma, Nicholas G. Martin, Dorret I. Boomsma. (2012). The continuing value of twin studies in the omics era. Nat Rev Genet. 13, 640-653;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Иммуностимулирующие вакцины;
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак;
- H. McIntosh. (1996). 25 Years Ahead: Will Cancer Be a "Background-Noise Kind of Disease"?. JNCI Journal of the National Cancer Institute. 88, 1794-1798;
- Robert A. Gatenby, Robert J. Gillies, Joel S. Brown. (2010). The evolutionary dynamics of cancer prevention. Nat Rev Cancer. 10, 526-527;
- Ствол и ветки: стволовые клетки;
- Eugene D. Sverdlov. (2011). Genetic Surgery - A Right Strategy to Attack Cancer. CGT. 11, 501-531;
- Старение — плата за подавление раковых опухолей?;
- Зачем клетки стареют;
- Jarle Breivik. (2016). Reframing the “Cancer Moonshot”. EMBO Rep.. 17, 1685-1687;
- Andrii I. Rozhok, James DeGregori. (2016). The Evolution of Lifespan and Age-Dependent Cancer Risk. Trends in Cancer. 2, 552-560;
- C. Tomasetti, B. Vogelstein. (2015). Variation in cancer risk among tissues can be explained by the number of stem cell divisions. Science. 347, 78-81;
- Омикс-биомаркеры и ранняя диагностика: когда счастье возможно;
- L. D. Wood, D. W. Parsons, S. Jones, J. Lin, T. Sjoblom, et. al.. (2007). The Genomic Landscapes of Human Breast and Colorectal Cancers. Science. 318, 1108-1113;
- Hariharan Easwaran, Hsing-Chen Tsai, Stephen B. Baylin. (2014). Cancer Epigenetics: Tumor Heterogeneity, Plasticity of Stem-like States, and Drug Resistance. Molecular Cell. 54, 716-727;
- A. Pribluda, C. C. de la Cruz, E. L. Jackson. (2015). Intratumoral Heterogeneity: From Diversity Comes Resistance. Clinical Cancer Research. 21, 2916-2923;
- J. Kaiser. (2009). Looking for a Target On Every Tumor. Science. 326, 218-220;
- Parag Mallick. (2016). Complexity and Information: Cancer as a Multi-Scale Complex Adaptive System. Physical Sciences and Engineering Advances in Life Sciences and Oncology. 5-29;
- D. Rickles, P. Hawe, A. Shiell. (2007). A simple guide to chaos and complexity. Journal of Epidemiology & Community Health. 61, 933-937;
- B?la Suki, Jason H.T. Bates, Urs Frey. (2011) Complexity and Emergent Phenomena;
- Denis Noble. (2013). A biological relativity view of the relationships between genomes and phenotypes. Progress in Biophysics and Molecular Biology. 111, 59-65;
- Robert W. Korn. (2005). The Emergence Principle in Biological Hierarchies. Biol Philos. 20, 137-151;
- Marc H.V. Van Regenmortel. (2004). Reductionism and complexity in molecular biology. EMBO Rep. 5, 1016-1020;
- Ray Greek, Lawrence A. Hansen. (2013). Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113, 231-253;
- Ray Greek, Andre Menache. (2013). Systematic Reviews of Animal Models: Methodology versus Epistemology. Int. J. Med. Sci.. 10, 206-221;
- Пространственно-временное моделирование в биологии;
- 12 методов в картинках: «сухая» биология;
- Lauren M.F. Merlo, John W. Pepper, Brian J. Reid, Carlo C. Maley. (2006). Cancer as an evolutionary and ecological process. Nat Rev Cancer. 6, 924-935;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Метастазирование опухолей;
- Mina J Bissell, William C Hines. (2011). Why don't we get more cancer? A proposed role of the microenvironment in restraining cancer progression. Nat Med. 17, 320-329;
- Yvonne Bordon. (2015). Checkpoint parley. Nat Rev Cancer. 15, 3-3;
- Mark J. Smyth, Shin Foong Ngiow, Antoni Ribas, Michele W. L. Teng. (2016). Combination cancer immunotherapies tailored to the tumour microenvironment. Nat Rev Clin Oncol. 13, 143-158;
- Nadiah Abu, M. Nadeem Akhtar, Swee Keong Yeap, Kian Lam Lim, Wan Yong Ho, et. al.. (2016). Flavokawain B induced cytotoxicity in two breast cancer cell lines, MCF-7 and MDA-MB231 and inhibited the metastatic potential of MDA-MB231 via the regulation of several tyrosine kinases In vitro. BMC Complement Altern Med. 16;
- Margaret K. Callahan, Michael A. Postow, Jedd D. Wolchok. (2015). CTLA-4 and PD-1 Pathway Blockade: Combinations in the Clinic. Front. Oncol.. 4;
- Yael Diesendruck, Itai Benhar. (2017). Novel immune check point inhibiting antibodies in cancer therapy—Opportunities and challenges. Drug Resistance Updates. 30, 39-47;
- T. J. Vreeland, G. T. Clifton, G. S. Herbert, D. F. Hale, D. O. Jackson, et. al.. (2016). Gaining ground on a cure through synergy: combining checkpoint inhibitors with cancer vaccines. Expert Review of Clinical Immunology. 12, 1347-1357;
- Leonard Calabrese, Vamsidhar Velcheti. (2017). Checkpoint immunotherapy: good for cancer therapy, bad for rheumatic diseases. Ann Rheum Dis. 76, 1-3;
- Claire F. Friedman, Tracy A. Proverbs-Singh, Michael A. Postow. (2016). Treatment of the Immune-Related Adverse Effects of Immune Checkpoint Inhibitors. JAMA Oncol. 2, 1346;
- Сколько сора в нашей ДНК;
- Мечту вызывали?;
- The ENCODE Project Consortium. (2012). An integrated encyclopedia of DNA elements in the human genome. Nature. 489, 57-74;
- Graur D. (2016). Rubbish DNA: the functionless fraction of the human genome. Cornell University library;
- Eugene Sverdlov. (2017). Transcribed Junk Remains Junk If It Does Not Acquire A Selected Function in Evolution. BioEssays. 39, 1700164;
- Dan Graur. (2017). An Upper Limit on the Functional Fraction of the Human Genome. Genome Biology and Evolution. 9, 1880-1885;
- Chris M. Rands, Stephen Meader, Chris P. Ponting, Gerton Lunter. (2014). 8.2% of the Human Genome Is Constrained: Variation in Rates of Turnover across Functional Element Classes in the Human Lineage. PLoS Genet. 10, e1004525;
- S. Brenner. (2010). Sequences and consequences. Philosophical Transactions of the Royal Society B: Biological Sciences. 365, 207-212;
- Erika Check Hayden. (2010). Human genome at ten: Life is complicated. Nature. 464, 664-667;
- John H. Doonan, Robert Sablowski. (2010). Walls around tumours — why plants do not develop cancer. Nat Rev Cancer. 10, 794-802.
Источник: biomolecula.ru