А что же окружает нейроны?
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2017-11-06 09:25
Предыстория, или немного о себе
Я учусь в Казанском федеральном университете в Институте фундаментальной медицины и биологии на 5 курсе. А занимаюсь наукой с 1 курса. Попала в научную группу совершенно случайно, считаю это счастливым стечением обстоятельств. Я год отучилась на биологическом направлении, потому что после подачи заявления в университеты не могла понять, чего действительно хочу. Поэтому оставила все документы там, где прошла в первую волну, и это оказался КФУ. Отучилась на биофаке — тогда еще не было медицинских специальностей, открылись они только через год. За этот единственный свой биологический год я сдружилась с одногруппником — Никитой Арнстом. Мне хотелось переплюнуть его в чем-то на тот момент, потому что он очень умный, и шел на биофак осознанно, в отличие от меня. Ему нравилась наука — он много читал, и ему было легко учиться. Я вся такая пубертатная девочка, очень бесилась, когда у него что-то получалось лучше, чем у меня. Но в целом, отношения у нас с ним неплохие, дружеские. И вот, когда я на следующий год отчислилась, и поступила опять-таки в КФУ, только уже на медицинскую биохимию — получать специальность врача, — некоторые предметы зачли, так что свободного времени было побольше. В итоге Никита предложил мне заниматься наукой, а я подумала: «Почему бы и нет, не понравиться — уйду».
Мой научный руководитель — Михаил Николаевич Павельев — тогда работал в Центре нейронаук в Хельсинки и, в основном, общался со мной по скайпу. Провел собеседование, посмотрел мои оценки (я закончила школу с серебряной медалью, в университете экзамены сдавала и сдаю на «отлично»), задавал много вопросов, но на некоторые из них я ответа не знала, и отвечала неуверенно. Сейчас вспоминать это все забавно. Но спустя эти все годы обучения, я поняла, как выросла.
Наша научная группа тогда занималась травмой спинного мозга — в частности, моей темой было наблюдение за поведением животных при восстановлении после операции: контузионная травма спинного мозга. Затем мы переключились на перинейрональные сети. Моя роль в проекте была — съемка на конфокальном микроскопе и анализ изображений. Ну а потом Никите захотелось сменить тему, и мне пришлось взять всю работу на себя, долго учиться окрашиванию тканей головного мозга. Очень тяжело было. Еще Михаил Николаевич поставил задачу найти новых членов группы и обучить их. Теперь в нашей группе Арсений Расческов — студент уже 3 курса лечебного дела, и Анастасия Кочнева — студентка 2 курса биологического направления. Все вместе мы трудимся на благо нашего научного коллектива и университета.
С чего же все началось, или откуда взялись ПНС?
Все началось с итальянского ученого Камилло Гольджи [1]. Он впервые описал перинейрональные сети (ПНС) на поверхности нейронов коры головного мозга кролика. Он предположил, что это «своего рода корсет из нейрокератина, который препятствует прохождению тока от клетки к клетке». Как обычно бывает в науке, никто его находку особо не воспринял. Сантьяго Рамон-и-Кахаль вообще утверждал, что это всего лишь артефакт, полученный от коагуляции внеклеточной жидкости [2], [3]. В то время это был очень влиятельный ученый, и его мнение, прямо скажем, подавило интерес к этой структуре, и постепенно про нее забыли. Но биология развивалась, совершенствовались методики визуализации и окрашивания. Спустя годы интерес вновь вернулся. За несколько десятилетий накоплено внушительное количество данных о молекулах — компонентах ПНС, и их функциях. Но микроструктура остается неизученной [4].
Почему это важно — изучать микроструктуру ПНС?
Макроскопическая картина дает мало информации, и даже под большим увеличением можно лишь понять, стало ПНС больше или меньше, но более тонкие структурные эффекты, увы, увидеть не получается. Наша научная группа занимается анализом изображений, полученных после иммунофлуоресценции и конфокальной микроскопии [5], [6]. И такие изображения, особенно если сделаны на большом увеличении, дают очень много информации, главное — это извлечь ее и сделать выводы.
Итак, мы смотрим пространственную структуру ПНС. Уже известно, что она регулирует ряд функций синапса, и ее структура меняется при:
- Эпилепсии: разрушаются перинейрональные сети [7], [8].
- Посттравматическом синдроме: увеличивается экспрессия (синтез белка, считанного с ДНК) компонентов ПНС [9].
- Психиатрических заболеваниях (например, при шизофрении): возможно, уменьшается количество перинейрональных сетей в зонах, которые связаны с патофизиологией заболевания, и изменяется экспрессия компонентов ПНС [10], [11].
Итак, изучение структуры ПНС поможет понять механизмы этих патологий. Так что область эта очень перспективна и актуальна.
Что такое ПНС и «с чем их едят»
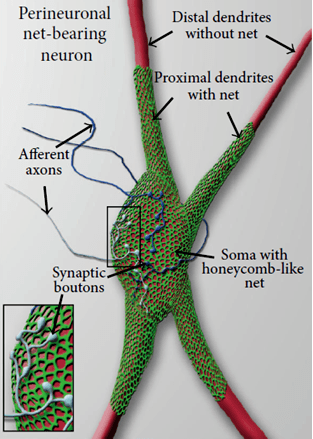
Рисунок 1. Схематическое изображение ПНС, окружающей тело нейрона, а также начальные сегменты дендритов и аксона.
ПНС — это сетчатая структура, окружающая определенные нейроны в головном и спинном мозгах, плотно переплетенная с синаптическими контактами на теле и проксимальных дендритах нейронов [3] (рис. 1).
Перинейрональные сети находят в зрительной коре, соматосенсорной коре, в глубоких ядрах мозжечка, черной субстанции, гиппокампе, а также в спинном мозге [13], [14]. Почему именно там? Потому что ПНС, в основном, окружают тормозные ГАМК-ергические (ГАМК — ?-аминомасляная кислота, тормозной медиатор [15]) интернейроны, а они как раз содержатся в этих зонах. Но исследования по поводу того, какие именно нейроны, помимо ГАМК-ергических, окружены перинейрональными сетями, и в каких пропорциях они окружают нейроны во всех зонах мозга, еще ведутся.
Формируются эти сети во время раннего постнатального развития (период после рождения) ближе к концу критического периода (период, когда нервная система особенно чувствительна к определенным стимулам окружающей среды). Самый интересный факт про ПНС — это то, что они ограничивают синаптическую пластичность.
Синаптическая пластичность — способность нейронных связей перестраиваться в ответ на стимулы окружающей среды и сенсорный опыт (информация, воспринятая через органы чувств). Пластичность играет важную роль в уточнении связей во время развития. Во взрослом состоянии пластичность снижается, но способность не пропадает полностью, нейронные связи продолжают реагировать на опыт, возраст или травмы.
Есть такой фермент — хондроитиназа ABC, — который разрушает ПНС. Так вот, обнаружено, что такое ферментативное разрушение приводит к облегчению синаптической пластичности у взрослых животных [13]. К примеру, проводили исследования на линии мышей с болезнью Альцгеймера [16], у которых была стойкая потеря памяти об объекте в течение трех месяцев. Но после введения им этого фермента, память восстановилась до нормального уровня. А вот если генетически ослабить у таких мышей перинейрональные сети, то начало потери памяти задерживается на несколько недель [11].
Из чего же сделаны ПНС, или много страшных непонятных слов
Вообще, ПНС — это всего лишь сочетание белков и протеогликанов, которые секретируются и нейронами, и глией (вспомогательными клетками нервной ткани) на протяжении раннего постнатального развития. И состоят они из четырех компонентов (рис. 2) [17]:
- гиалуроновая кислота — коровая часть;
- хондроитинсульфат протеогликаны (нейрокан, версикан, бревикан, аггрекан — коровые белки, к которым присоединяются цепочки полисахаридов, называемые хондроитинсульфатами) присоединены к коровой части;
- связывающие белки стабилизируют эти соединения;
- тенасцин-R формирует перекрестные связи между этими структурами [18].
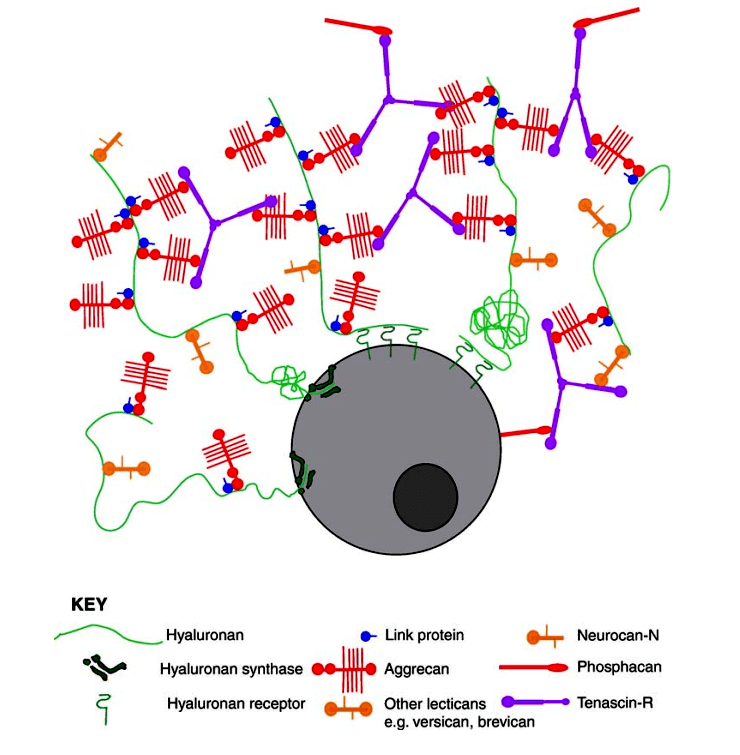
Рисунок 2. Модель строения ПНС. Hyaluronan — гиалуроновая кислота (ГК) — каркас. Фермент гиалуронсинтаза (hyaluronan synthase) синтезирует ГК и, вероятно, заякоривает ее в клеточной мембране. С ГК взаимодействуют связывающие белки (link protein), а с ними связываются хондроитинсульфат протеогликаны (ХСПГ) (обозначены красным и оранжевым цветами). С ХСПГ связывается тенасцин-R (tenascin-R), что завершает формирование структуры.
Что же делала наша группа
На самом деле все довольно просто: нужно подготовить материал (в нашем случае головной мозг мыши), сделать срезы, покрасить их, отснять всё, что получилось, на конфокальном микроскопе и проанализировать снимки с помощью компьютера. Все просто, сделай — и сиди отдыхай. :-)
Но если отбросить шутки в сторону, процедура довольно длительная, сложная, требует концентрации внимания и сноровки. В случае провала на любом этапе нужно искать причину ошибки: что же могло пойти не так? Когда я только начала осваивать гистологическую часть работы, мне это жутко не нравилось. Я очень люблю животных, а тут нужно их забить, извлечь мозг и на все это смотреть беспристрастно... Смотреть было жутко даже со стороны, а уж когда делаешь всё это самостоятельно... Руки дрожат, и ты думаешь только о том, как это ужасно и как бы сделать так, чтобы животное ничего не почувствовало. Приходилось преодолевать страх, чтобы можно было продолжать работу. Сейчас я отношусь к этому более спокойно — рука набилась, все движения отточены. Процедуру забоя нужно проводить как можно быстрее, чтобы животное не успело очнуться и почувствовать невыносимую боль. А ведь оно может умереть раньше, чем нужно, от болевого шока, к тому же выпустив кучу медиаторов стресса типа адреналина, что может повлиять на конечный результат и дать нежелательные микроизменения в мозге. Вот почему всё нужно делать предельно быстро.

Рисунок 3. Вот так выглядит процедура нарезки
Затем нужно извлечь головной мозг из черепной коробки, не повредив его. Конечно, если фиксация прошла хорошо, то делать это намного проще, но все равно тут надо быть крайне внимательным. После подготовительных этапов — фиксации, криопротекции (это нужно для того, чтобы мозг «пережил» дальнейшее замораживание), заключения в среду и замораживания — можно приступать к нарезке материала.
Порезка на криотоме — еще один ужасно трудоемкий этап, где необходимы внимательность и сноровка в кубе, иначе всё насмарку. Нужно сделать очень тонкие срезы (18 мкм) очень острым лезвием (рис. 3). Казалось бы, что сложного? Но в процессе срезы скручиваются и рвутся, что, безусловно, портит препарат. Поэтому тут больше имеет значение опыт.
Очень нужный нам инструмент — беличья кисть, чтобы удерживать срез за край и сделать его ровным. А еще в состав криотома входит так называемая anti-roll plate — по сути, всего лишь прямоугольное стекло, предотвращающее скручивание срезов (рис. 4).

Рисунок 4. Anti-roll plate
И нет ничего лучше, когда процесс нарезки проходит быстро, и срезы получаются ровными, не порванными и просто шикарными. И ты такой радостный на подъеме идешь красить.
Но окрашивание (в нашем случае иммунофлюоресценция [6]) — это еще один этап, и один из самых важных, на котором можно всё испортить. Плохо покрасишь — ничего не увидишь, а значит, все твои старания получить суперкрутые ровные срезы пошли прахом. Этап этот длительный, и здесь тоже очень важны опыт, точное следование протоколу, проверка всех буферов на pH... В общем, очень много тонкостей, чтобы получить качественное окрашивание без высокого фона. Это значит, что те структуры, которые вы покрасили, будут хорошо и четко видны.
Здесь я лишь оговорюсь, что для окрашивания перинейрональных сетей используют биотинилированный лектин (лектин — это углеводсвязывающий белок [19], а слово «биотинилированный» говорит о том, что к этому лектину присоединен биотин) Wisteria floribunda (WFA) (глицинии обильноцветущей), который связывается с углеводным компонентом ПНС. А затем для визуализации применяют флуоресцентный краситель: стрептавидин-меченный AlexaFluor 633.
И вот после этого можно наконец смотреть в микроскоп, делать снимки и их анализировать. Как вы поняли, проще сказать, чем сделать. Поэтому квалифицированный гистолог в научном коллективе на вес золота. Ведь в такого рода исследованиях без гистологии никуда. За дополнительными подробностями о микроскопических методиках можно обратиться к статье «12 методов в картинках: микроскопия» [6].
Итог: мы анализировали изображения гистологических срезов соматосенсорной коры взрослых мышей, окрашенных WFA. Получив эти изображения, с помощью специальной программы мы обводили ячейки как многоугольники. Далее у них определяли площадь, периметр и количество вершин. Этот анализ мы провели на телах 34 нейронов из коры мозга мыши (1274 ячейки, 3 мыши) (рис. 5).
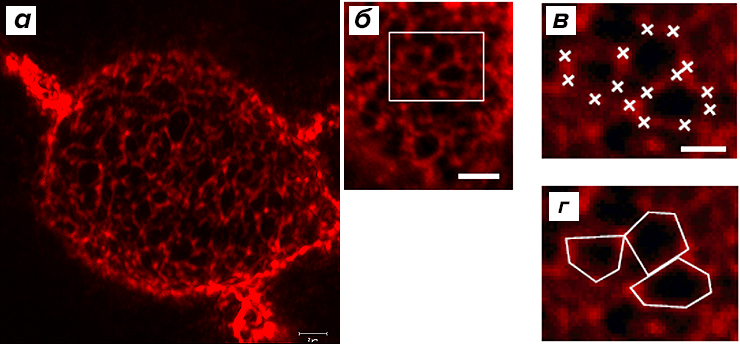
Рисунок 5. Структура ПНС кортикальных нейронов взрослых мышей. а — WFA-позитивные ПНС, конфокальный снимок. б — Ячеистая структура ПНС на поверхности тел нейронов. в — Выбор координат вершин ячеек с помощью программы FIJI в области, отмеченной на б. Вершины каждой ячейки метились вручную. г — Результат мечения ячеек на в. Контуры каждой ячейки прорисованы программой, основываясь на координатах вершин.
Всё это мы делаем для того, чтобы копнуть глубже в структуру перинейрональных сетей. Некоторые ячейки окрасились ярче, что означает, что там отложилось больше углеводного компонента — ходроитинсульфат протеогликанов, про которые говорилось выше. Значит синапсы, которые находятся в тех ячейках, окружены более плотно, и им сложнее перестраиваться. Возможно, это является одним из механизмов долговременной памяти.
Обычно все останавливаются на количественном анализе ПНС, а качественно смотрят по компонентам на молекулярном уровне. Но такой анализ изображений поможет другим группам исследователей, занимающихся ПНС, более детально понять данные структуры, посмотреть на то, что происходит при влияниях различных веществ на мозг, при заболеваниях.
Ячейки, ячейки и еще раз ячейки
В основном, все ячейки имеют 4-, 5- (самая часто встречающаяся, 44%) или 6-угольную форму. В сумме они составляют 93% проанализированных нами ячеек. Площадь ячеек также варьирует в интервале 0,24–5,48 мкм2 (в среднем 1,29 ± 0,67 мкм2). Это предполагает возможный механизм для регуляции функции синапсов через морфологические ограничения размера ячейки (рис. 6).
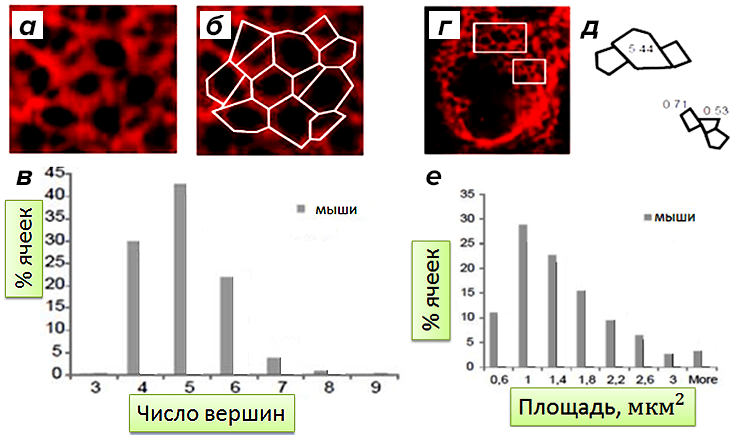
Рисунок 6. Параметры ячеек перинейрональных сетей. а и б — Ячейки имеют треугольную, четырехугольную, пятиугольную, шестиугольную и многоугольную форму. в — Гистограмма распределения ячеек с различным числом углов для мышиных нейронов. г — Размер ячеек широко варьирует у отдельных нейронов. д — Контуры ячеек ПНС в двух зонах, отмеченных на г. Крайние значения площадей ячеек показаны в мкм2. е — Гистограмма распределения площадей ячеек для мышиных нейронов.
Еще мы обнаружили два варианта распределения интенсивности красителя по периметру ячеек. Первый мы назвали полярным: интенсивность сигнала выше в вершинах, чем в серединах ребер. Второй — неполярный — паттерн характеризуется относительно равномерным распределением интенсивности WFA по периметру ячейки. Все это наглядно показано на рисунке 7.
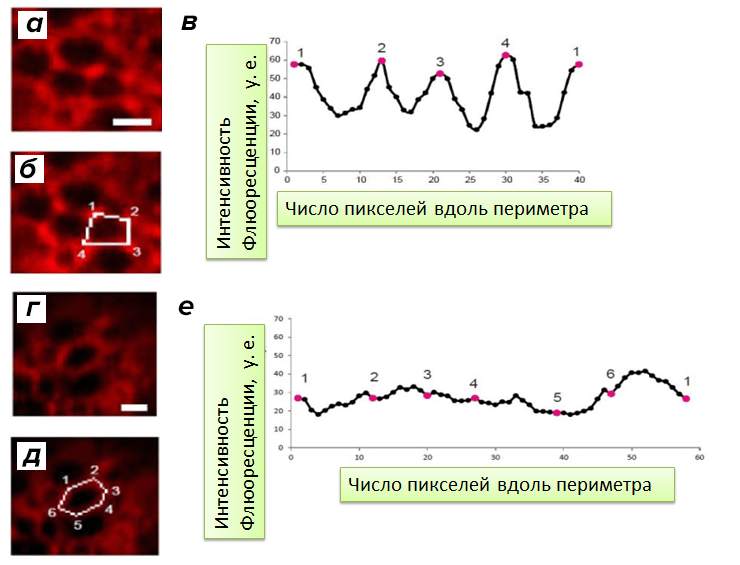
Рисунок 7. Паттерны распределения WFA вдоль периметра ячейки. а — Полярные ячейки. б — Показан контур ячейки и углы. в — Распределение интенсивности вдоль периметра ячейки, отмеченной на б. г — Неполярная ячейка. д — Контур неполярной ячейки и углы. е — Распределение интенсивности вдоль границы ячейки, отмеченной на д.
Чем важен этот уникальный результат — еще предстоит понять. Возможно, полярные и неполярные ячейки по-разному «окутывают» нейроны, что по-разному действует на синаптическую пластичность и процессы памяти и обучения...
Планы на будущее
Накопилось много данных о том, что же происходит в перинейрональных сетях при различных патологиях: посттравматический синдром, эпилепсия, шизофрения, а также при физиологических состояниях (например, при старении). И здесь очень важно понять, что же происходит на микроструктурном уровне, чтобы применить эти наблюдения при разгадке патогенеза заболеваний и разработке новых видов лечения.
Литература
- Окрасивший нейроны;
- Сотворивший нейробиологию: Сантьяго Рамон-и-Кахаль;
- Marco R Celio, Roberto Spreafico, Silvia De Biasi, Laura Vitellaro-Zuccarello. (1998). Perineuronal nets: past and present. Trends in Neurosciences. 21, 510-515;
- Nikita Arnst, Svetlana Kuznetsova, Nikita Lipachev, Nurislam Shaikhutdinov, Anastasiya Melnikova, et. al.. (2016). Spatial patterns and cell surface clusters in perineuronal nets. Brain Research. 1648, 214-223;
- Флуоресцентные репортеры и их молекулярные репортажи;
- 12 методов в картинках: микроскопия;
- Наука из первых рук: как гомеостаз хлора влияет на возникновение эпилепсии;
- Elyse K. Rankin-Gee, Paulette A. McRae, Esther Baranov, Stephanie Rogers, Luke Wandrey, Brenda E. Porter. (2015). Perineuronal net degradation in epilepsy. Epilepsia. 56, 1124-1133;
- Jessica C.F. Kwok, Gunnar Dick, Difei Wang, James W. Fawcett. (2011). Extracellular matrix and perineuronal nets in CNS repair. Devel Neurobio. 71, 1073-1089;
- Болезнь потерянных связей;
- Barbara A. Sorg, Sabina Berretta, Jordan M. Blacktop, James W. Fawcett, Hiroshi Kitagawa, et. al.. (2016). Casting a Wide Net: Role of Perineuronal Nets in Neural Plasticity. J. Neurosci.. 36, 11459-11468;
- F. de Winter, J. C. F. Kwok, J. W. Fawcett, T. T. Vo, D. Carulli, J. Verhaagen. (2016). The Chemorepulsive Protein Semaphorin 3A and Perineuronal Net-Mediated Plasticity. Neural Plasticity. 2016, 1-14;
- T. Pizzorusso. (2002). Reactivation of Ocular Dominance Plasticity in the Adult Visual Cortex. Unknown journal title.. 298, 1248-1251;
- P. A. McRae, M. M. Rocco, G. Kelly, J. C. Brumberg, R. T. Matthews. (2007). Sensory Deprivation Alters Aggrecan and Perineuronal Net Expression in the Mouse Barrel Cortex. Journal of Neuroscience. 27, 5405-5413;
- Спокоен как GABA;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Clare M. Galtrey, James W. Fawcett. (2007). The role of chondroitin sulfate proteoglycans in regeneration and plasticity in the central nervous system. Brain Research Reviews. 54, 1-18;
- Adrienne L. Mueller, Adam Davis, Samantha Sovich, Steven S. Carlson, Farrel R. Robinson. (2016). Distribution of N-Acetylgalactosamine-Positive Perineuronal Nets in the Macaque Brain: Anatomy and Implications. Neural Plasticity. 2016, 1-19;
- Лектины — новые инструменты в диагностике и терапии злокачественных опухолей.
Источник: biomolecula.ru