Нейрогенез: физиологические основы и перспективы регуляции в терапевтических целях
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2017-07-31 12:07

Нейрогенез — это многоступенчатый процесс образования новых нервных клеток в зрелой центральной нервной системе (ЦНС), являющийся ее адаптивной функцией.
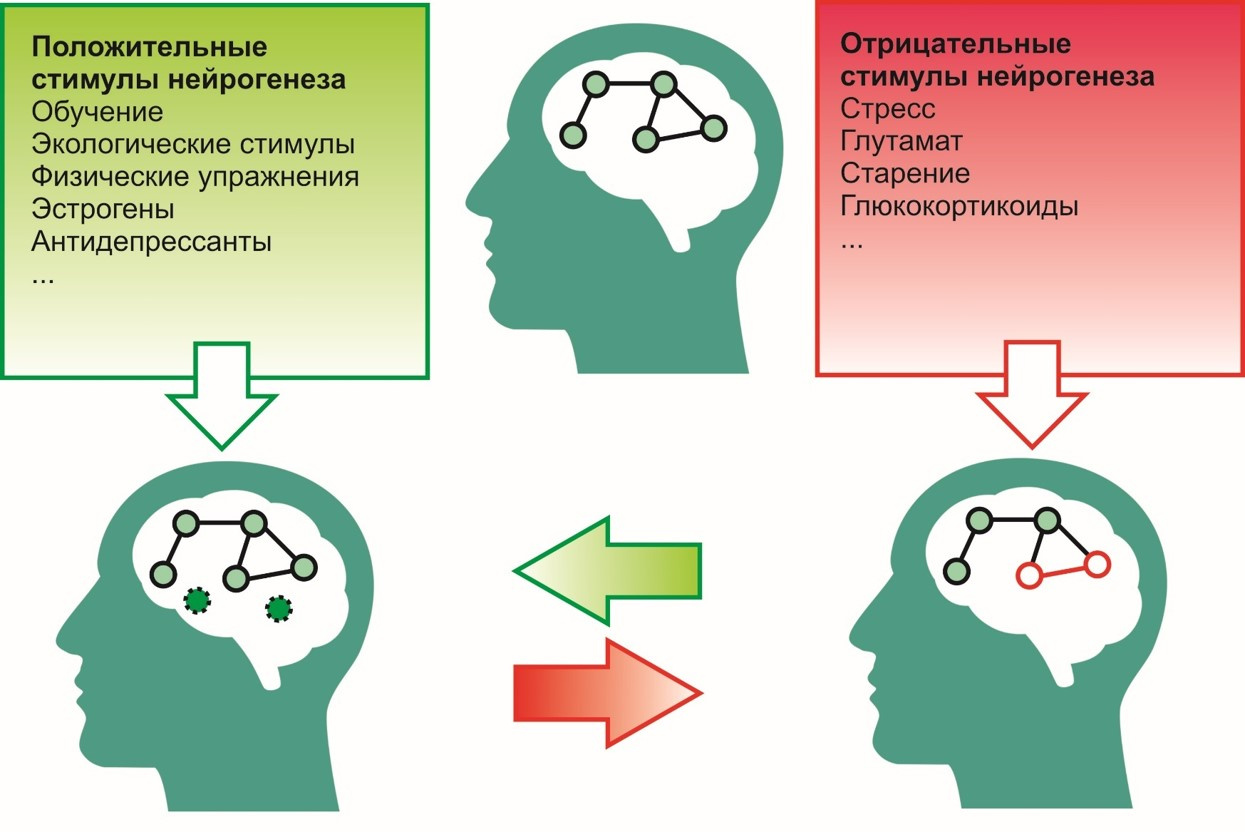 К положительным стимулам, т.е. стимулам, способствующим процессу нейрогенеза, можно отнести:
К положительным стимулам, т.е. стимулам, способствующим процессу нейрогенеза, можно отнести:
- процесс обучения,
- экологическое окружение (благоприятная среда),
- физические упражнения (например, бег),
- антидепрессанты,
- эстрогены и т.д.
К отрицательным —
- стресс,
- чрезмерную активность глутамата в ЦНС,
- воздействие глюкортикоидов (кортизол — гормон стресса),
- старение и другие.
На протяжении многих лет в нейробиологии существовали центральные догмы, которые не допускали самой возможности нейрогенеза.

Представления об отсутствии нейрогенеза в головном мозге зрелых позвоночных основывались на четырех принципах:
- Клинический. Больные, страдающие неврологическими патологиями с преимущественным поражением ЦНС, не испытывают функционального восстановления. Цереброваскулярные расстройства, травматические поражения и нейродегенеративные заболевания, как, например, болезнь Паркинсона и Альцгеймера, являются патологиями ЦНС с прогрессивным и ухудшением клинического состояния больного. В целом, различные методы лечения способны лишь устранить симптомы, но не остановить развитие болезни.
- Функциональный. Основывается на том, что ЦНС управляет множеством сложных процессов: регуляцией эмоций, движений, рефлексов и т.д. Управление столь сложными процессами требует предельно точной и тонкой «настройки». Считалось, что образование новых нервных клеток, их дифференцировка и миграция могли нарушить структурно-функциональную организацию существующих нейронных путей и нарушить работу ЦНС.
- Связанный с теорией памяти и обучения. На протяжении долгого времени считалось, что «воспоминания» — это извлечение информации из сформировавшихся в процессе обучения нейронных сетей. В этом контексте образование новых нервных клеток рассматривалось как событие, несовместимое с памятью.
- Технический и экспериментальный. Отсутствие технической возможности для открытия нейрогенеза и нервных стволовых клеток в зрелой ЦНС.
Этапы формирования представлений о нейрогенезе зрелого мозга
- 60-е — Джозеф Альтман и соавторы. Клетки зубчатой извилины гиппокампа могут включать радиоактивный тимидин, который встраивается в ДНК делящихся клеток, позволяя их визуализировать. Из-за отсутствия молекулярных маркеров было невозможным доказать, что маркировались именно нейроны.
DOI: 10.1126/science.135.3509.1127 - 70-е — Михаэль Каплан и Джеймс Хиндс. Воспроизвели опыт Альтмана и с помощью электронной микроскопии подтвердили, что маркируются именно нейроны (зубчатой извилины и обонятельной луковицы).
DOI: 10.1126/science.887941 - 80-е — Фернандо Ноттебоум. Показал, что в сезон спаривания в ядрах мозга канареек, ответственных за вокализацию и обучение, резко возрастает число нейронов.
DOI: 10.1038/scientificamerican0289-74 - 90-е — Питер Эрикссон и соавторы. Впервые показали образование новых нейронов в гиппокампе человека.
DOI:10.1038/3305
Основными нейрогенными зонами взрослого (или зрелого) мозга являются зубчатая извилина гиппокампа и субвентрикулярная зона латеральных желудочков. Зоны показаны на рисунке.
Стадии нейрогенеза в зубчатой извилине гиппокампа зрелого мозга
Пролиферация — активный процесс самовозобновления, возможность увеличения пула стволовых клеток.
Дифференцировка — преобразование в нейрон с конкретной функцией, размером, метаболизмом. По сути, «профориентация» будущих нервных клеток.
Выживание — отбор вновь образовавшихся нейронов, после чего происходит их миграция и интеграция в нейронную сеть. Отбор нервных клеток представляет из себя апоптоз (запрограммированная гибель) части образовавшихся нейронов. Оставшиеся клетки мигрируют в соответствующую область мозга и встраиваются в нейронную сеть.
С термином «нейрогенез» неразрывно связано понятие «нейрогенной ниши». Сама по себе «нейрогенная ниши» представляет собой «микросферу», в которой и происходит сам процесс нейрогенеза. Нейрогенная ниша включается в себя:
- сосудистое микроокружение, которое, во-первых, снабжает кровью саму нишу и обеспечивает доставку различных регуляторных молекул (образование и трансформация стволовых клеток происходит в непосредственной близости от кровеносных сосудов, во-вторых, фактор роста эндотелия сосудов (VEGF) является важным регуляторным фактором не только в процессе ангиогенеза (рост новых сосудов в уже существующей сосудистой системе) и васкулогенеза (образование эмбриональной сосудистой системы), но и непосредственным регулятором нейрогенеза;
- клеточное микроокружение, которое включает в себя формирующиеся нервные клетки на различных этапах развития и глиальные клетки, выполняющие трофическую функцию (продуцируют ростовые факторы, например, мозговой нейротрофический фактор — BDNF и фактор роста нервов — NGF);
- экспрессию в самой нише ростовых и регуляторных факторов. Помимо глиальных клеток и других зрелых структур ниши, к продукции регуляторных и ростовых факторов способны стволовые клетки, осуществляющие таким образом саморегуляцию (аутокринную регуляцию).
Оценка процессов нейрогенеза с помощью специфических маркеров
Важным и интересным вопросом, который достоин отдельного внимания, является вопрос о способах обнаружения нейрогенеза в тканях мозга зрелых млекопитающих.Бромдезоксиуридин (BrdU) является структурным аналогом тимидина — компонентом молекулы ДНК. При введении в организм, BrdU встраивается в ДНК делящихся клеток вместо тимидина, предоставляя возможность для обнаружения вновь образовавшихся клеток и отделения их от «старых». После получения образца тканей мозга их обрабатывают антителами к BrdU (антитела содержат флуоресцирующую метку), которые связываются с BrdU по механизму иммунохимической реакции «антиген-антитело» и дают возможность для колориметрического определения BrdU. Таким образом, на микропрепарате возможно количественно оценить клетки, меченные BrdU, так называемые, BrdU позитивные клетки.
Даблкортин — это белок, который почти всегда обнаруживается в незрелых нейронах и позволяет детектировать их.
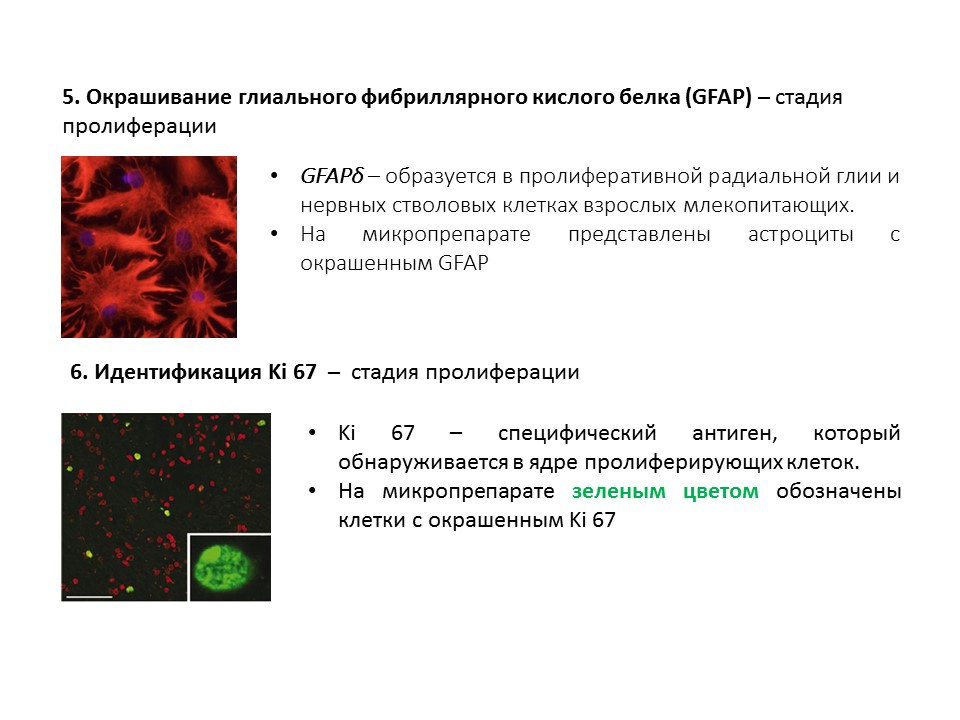
Сводная схема по основным методам обнаружения различных этапов нейрогенеза, которая обобщается представленную раннее информацию.
Регуляция процессов нейрогенеза в зрелом мозге
С экологическими факторами регуляции процессов нейрогенеза связана концепция «обогащенной среды». Сам термин «обогащенная среда» включает в себя благоприятную среду обитания, а именно наличие достаточного количества пищи, комфортно устроенное пространство и возможность для свободной поисковой активности.DOI: 10.1002/hipo.22218
DOI: 10.1038/386493a0
DOI: 10.1016/j.brainres.2011.08.007
DOI: 10.1016/j.neuroscience.2011.10.040
PMID: 9547229
В экспериментах на животных установлено, что пребывание в условиях «обогащенной среды» оказывает положительное влияние на нейрогенез: повышается продукция ростовых факторов и нейротрофинов, количество пролиферирующих клеток и их выживание. Усиление нейрогенеза коррелируют с улучшением когнитивной функции у животных (главным образом, с процессами обучения и памяти).
Подопытных мышей линии С57BL/6J в течение 2 месяцев содержали в защищенном пространстве в условиях биологической станции (на лесной поляне), контрольная группа содержалась в стандартных лабораторных условиях. У животных экспериментальной группы было отмечено увеличение числа возбуждающих и тормозных синапсов по сравнению с контрольной группой. Этот эксперимент показывает, что условиях окружающей среды способны благоприятно влиять на морфологию и функцию ЦНС грызунов, помещенных в обогащенную среду.
Содержание животных в условиях социальной изоляции в лабораторных условиях, напротив, выступало в качестве отрицательного регулятора нейрогенеза.
Более того, помещение животных в условиях «обогащенной среды» после ишемии мозга способствовало усилению регенеративных процессов в нейрогенных зонах мозга.
Результаты подобных исследований не являются чем-то экстраординарным, поскольку в современной медицине используются реабилитационные курсы и оздоровительный отдых.
Важную роль в регуляции нейрогенеза играют нейромедиаторы ЦНС. На картинке представлена сводная схема такой регуляции.
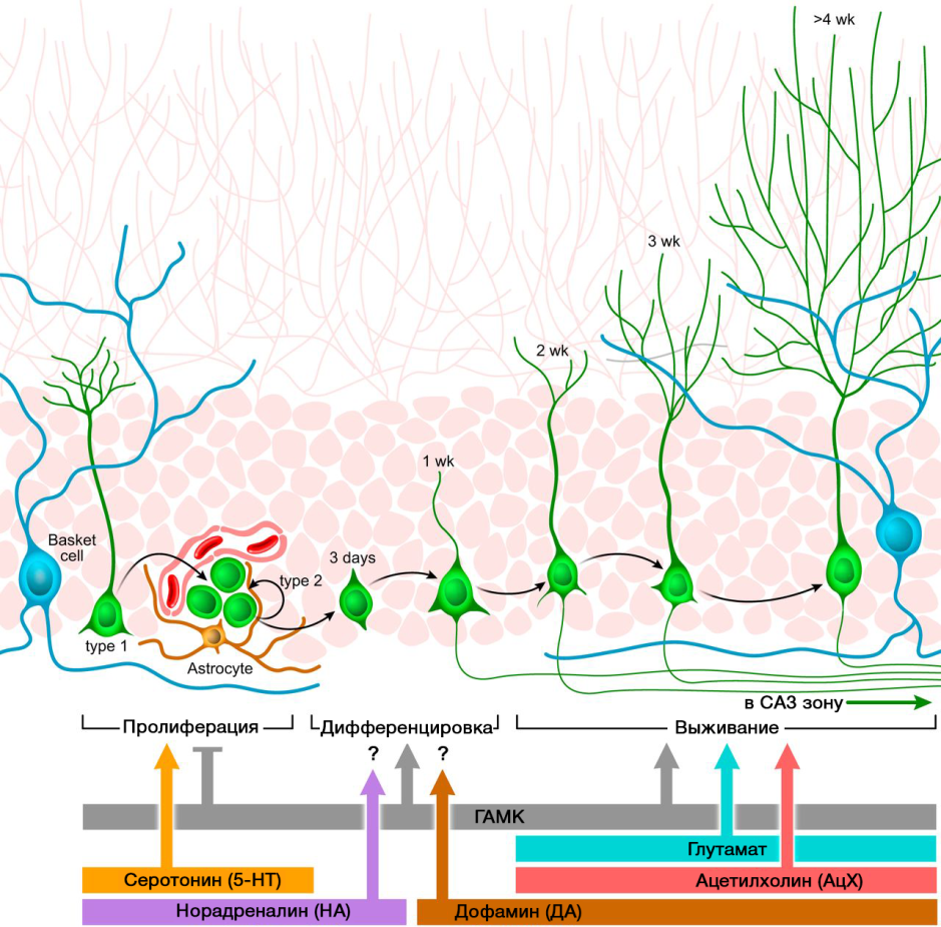
DOI: 10.1152/physrev.00004.2014
Регуляторная роль представленных нейромедиаторов ЦНС в процессах нейрогенеза коррелируют с дефицитом или избытком указанных молекул в различных заболеваниях ЦНС, сопряженных с изменением уровня нейрогенеза.
Благодаря возможности фармакологической манипуляции с нейромедиаторными системы ЦНС мы можем оценить вклад того или иного нейромедиатора в различные этапы нейрогенеза зрелого мозга.
Установлено, что флуоксетин (антидепрессант из группы селективных ингибиторов обратного захвата серотонина), способный повышать концентрацию серотонина в ЦНС, усиливает пролиферацию нервных стволовых клеток в зубчатой извилине гиппокампа грызунов и приматов. Позже на самих стволовых клетках были обнаружены серотониновые рецепторы 1А подтипа (5-НТ1А-рецепторы) и это согласуется со способностью вещества 8-OH-DPAT (избирательного активатора этих рецепторов) стимулировать пролиферацию и выживание новых нейронов в зубчатой извилине гиппокампа экспериментальных животных (мышей и крыс).
Приматов подвергали воздействию хронического стресса (социальной изоляции) после чего оценивали депрессивно-подобное и тревожное поведение, а также гиппокампальный нейрогенез (постмортально). Хронический стресс приводил к снижению нейрогенеза в сочетании с поведенческими дефицитами (усиление депрессивно-подобного и тревожного поведения). Лечение флуоксетином (антидепрессантом, который повышает концентрацию серотонина в ЦНС за счет подавления его обратного захвата) стимулировало нейрогенез и предотвращало депрессивно-подобное и тревожное поведение.
DOI: 10.1371/journal.pone.0017600
Еще один эксперимент подтверждает роль серотонина в регуляции взрослого нейрогенеза. Хроническая стимуляция серотониновых рецепторов 5-НТ1А с помощью вещества 8-OH-DPAT у крыс приводила к усилению пролиферации нервных стволовых клеток и выживанию дифференцирующихся нейронов в зубчатой извилине гиппокампа и субвентрикулярной зоне, а также к усилению глиогенеза.
DOI: 10.1016/j.euroneuro.2009.11.007
Представленные эксперименты подтверждают важную регуляторную роль серотонина в процессах нейрогенеза во взрослом мозге.
DOI: 10.4161/cc.8.18.9512
DOI: 10.1016/j.neuropharm.2011.01.026
Дофамин также принимает активное участие в регуляции нейрогенеза. Было показано, что активация дофаминовых рецепторов 1 и 2 типа (D1 и D2) бромокриптином приводит к усилению процесса дифференцировки нервных стволовых клеток, в то время как стимуляция D3-рецепторов прамипексолом — к усилению пролиферации.
Прамипексол — агонист дофаминовых рецепторов, обладающий большим сродством к рецепторам D3, чем D2, применяется при болезни Паркинсона, эффективно устраняя симптоматику данного заболевания. Кроме того, препарат обладает нейропротективной активностью. В эксперименте проводили оценку влияния прамипексола на нейрогенез в клеточной культуре мышей. Было показано, что обработка культуры клеток прамипексолом приводила к увеличению размеров нейросфер (скопления вновь образовавшихся стволовых клеток) и клеток, содержащих даблкортин (незрелых нейронов). Стимулирующий эффект прамипексола на нейрогенез устранялся блокаторами дофаминовых рецепторов — U99194A и сульпиридом. Кроме того, было показано, что прамипексол усиливает высвобождение BDNF. Представленные результаты позволяют сделать предположение, что эффективность прамипексола при болезни Паркинсона связана не только с восполнением функционального дефицита дофамина, но и стимулирующим действием на нейрогенез, а также свидетельствуют о важной регуляторной роли дофамина на стадии пролиферации нервных стволовых клеток.
DOI: 10.1016/j.neuropharm.2011.01.026
Экспериментально было подтверждено наличие дофаминовых рецепторов 1 и 2 подтипов на нервных стволовых клетках, а также показана важная регуляторная роль дофамина в пролиферации и дифференцировки на культуре нервных клеток. В частности, обработка культуры клеток субвентрикулярной зоны бромокриптином (стимулятор дофаминовых рецепторов Д1 и Д2 подтипов) в условиях их повреждения нейротоксином МФТП (моделирование болезни Паркинсона на культуре клеток) приводила к усилению клеточной пролиферации и дифференцировки.
DOI: 10.4161/cc.8.18.9512
Норадреналин способен увеличивать число предшественников нервных стволовых клеток через активацию бета-3-адренорецепторов. Этот эффект был показан с помощью избирательного агониста (активатора) бета-3-адренорецепторов — вещества BRL37344.
Регуляторная роль норадреналина в процессах зрелого нейрогенеза была оценена в комплексном исследовании in vitro (на культуре клеток) in vivo (на мышах). Добавление норадреналина в культуру клеток приводило к увеличению размера нейросфер (скопления нервных стволовых клеток). Системное введение селективного агониста бета-3-адренорецепторов приводила к усилению пролиферации нервных стволовых клеток в гиппокампе мышей. Эти исследования подтверждают данные о наличие адренорецепторов на незрелых нервных клетках, а также свидетельствуют о регуляторной роли норадреналина, которая, по-видимому, реализуется через бета-3-адренорецепторы.
DOI: 10.1523/JNEUROSCI.3780-09.2010
Нервные стволовые клетки, как упоминалось ранее, способны сами вырабатывать факторы регуляции. Одним из таких факторов является гамма-аминомасляная кислота (ГАМК) — основной тормозной медиатор ЦНС. В частности, на культуре мышиных предшественников нервных клеток было показано, что нервные стволовые клетки усиливают синтез ГАМК, которая в свою очередь усиливает пролиферацию, активируя радиальную глию (дает начало стволовым клеткам) и способствует увеличению размером нейросфер (скоплению стволовых клеток) в эксперименте.
Было установлено, что данный эффект ГАМК реализуется через ГАМК-В рецепторы. В исследованиях использовали селективный агонист ГАМК-В рецептора — баклофен.
DOI: 10.1002/jcp.21422
Nakamichi N, Takarada T, Yoneda Y. Neurogenesis mediated by gamma-aminobutyric acid and glutamatesignaling. J. Pharmacol Sci. 2009;110(2):133-49
Роль основного возбуждающего медиатора в ЦНС двояка. С одной стороны, глутамат подавляет пролиферацию недифференцированных стволовых клеток. С другой, стимулирует дифференцировку предшественников в глиальную линию. Полагают, что определенные соотношения глутамата и ГАМК необходимы для регуляции дифференцировки нервных стволовых клеток в определённые типы нейронов. Например, глутамат, как уже говорилось, способствует образованию глиальных клеток (астроцитов), а ГАМК способствует образование нейронов, которые синтезируют саму ГАМК (ГАМКергические нейроны).
Kotani S et al. H. Donepezil, an acetylcholinesterase inhibitor, enhances adult hippocampal neurogenesis.Chem Biol Interact. 2008;175(1-3):227-30
Kita Y et al. Galantamine promotes adult hippocampal neurogenesis via M? muscarinic and ?7 nicotinic receptors in mice. Int J Neuropsychopharmacol.2014;17(12):1957-68.
Регуляторная роль ацетилхолина (АцХ) показана на крысах с помощью веществ, препятствующих его разрушению (ингибиторов ацетилхолинэстеразы — фермента, расщепляющего АцХ). Донепезил и галантамин повышают концентрацию АцХ в ЦНС (донепезил также повышает экспрессию белка CREB — транскрипционный фактор, тем самым усиливая защиту незрелых нейронов от апоптоза) и повышают выживаемость незрелых нейронов. Положительный эффект галантамина на нейрогенез устраняется скополамином (блокатор всех подтипов мускариновых холинорецепторов) и телензепином (блокатором 1 подтипа мускариновых холинорецепторов), что позволяет предположить реализацию эффектов АцХ на нейрогенез через активацию мускариновых рецепторов 1 типа (Kotani S et al. H. Donepezil, an acetylcholinesterase inhibitor, enhances adult hippocampal neurogenesis. Chem Biol Interact. 2008;175(1-3):227-30; Kita Y et al. Galantamine promotes adult hippocampal neurogenesis via M? muscarinic and ?7 nicotinic receptors in mice. Int J Neuropsychopharmacol.2014;17(12):1957-68.).
Shetty AK. Progenitor cells from the CA3 region of the embryonic day 19 rat hippocampus generate region-specific neuronal phenotypes in vitro. Hippocampus. 2004; 14(5): 595-614
G?mez-Lira G et al. Programmed and induced phenotype of the hippocampal granule cells. J Neurosci. 2005;25(30):6939-46
Nakamichi N, Takarada T, Yoneda Y. Neurogenesis mediated by gamma-aminobutyric acid and glutamate signaling. J.Pharmacol Sci. 2009;110(2):133-49
Arenas E. Engineering a dopaminergic phenotype in stem/precursor cells: role of Nurr1, glia-derived signals, and Wnts. Ann N Y Acad Sci. 2005;1049:51-66
В условиях эксперимента (на животных или в культуре клеток) показано, что изменяя соотношение регуляторных факторов и добавление самих нейромедиаторов к нервным стволовым клеткам позволяет «программировать» нейромедиаторный фенотип (т.е. функцию будущей клетки) вновь образовавшихся нейронов. Так, например, культивирование стволовых клеток с астроцитами позволяет получить популяцию глутаматергических нейронов (нейронов, которые вырабатывают глутамат), а с дофамином — дофаминергических.
Возможно, что такое направленное воздействие в будущем можно будет использовать для избирательного образования нервных клеток определенного фенотипа. Например, если мы знаем, какой тип утрачен при конкретном заболевании (при болезни Паркинсона — гибнут дофаминергические, при болезни Альцгеймера — холинергические). Но в настоящее время, данный аспект нейрогенеза остается до конца неизученным, и говорить о программируемой регуляции нейрогенеза еще рано (имеются единичные исследования).
Pencea V et al. Infusion of BDNF into the lateral ventricle of the adult rat leads to new neurons in the parenchyma of the striatum, septum, thalamus, and hypothalamus. J.Neurosci. 2001;21:6706–6717
Bath KG et al. Variant brain-derived neurotrophic factor (Val66Met) alters adult olfactory bulb neurogenesis and spontaneous olfactory discrimination. J Neurosci. 2008; 28:2383–2393
Gascon E, Vutskits L, Zhang H, et al. Sequential activation of p75 and TrkB is involved in dendritic development of subventricular zone-derived neuronal progenitors in vitro. Eur J Neurosci. 2005;21:69–80
Kahn MA, Kumar S, Liebl D, et al. Mice lacking NT-3, and its receptor TrkC, exhibit profound deficiencies in CNS glial cells. Glia. 1999;26:153–165
Shimazu K, Zhao M, Sakata K, et al. NT-facilitates hippocampal plasticity and learning and memory by regulating neurogenesis. Learn Mem. 2006; 13(3):307-15)
Zhao M, Li D, Shimazu K, et al. Fibroblast growth factor receptor-1 is required for long-term potentiation, memory consolidation, and neurogenesis. Biol Psychiatry. 2007;62:381–390
Важную роль в регуляции нейрогенеза, как упоминалось ранее, играют ростовые и нейротрофические факторы, в числе которых можно выделить:
- мозговой нейротрофический фактор (BDNF)
- фактор роста нервов (NGF)
- нейротрофин-3 (NT-3)
- фактор роста эндотелия сосудов (VEGF)
- фактор роста тромбоцитов (PGF)
- фактор роста фибробластов-2 (FGF-2)
- эпидермальный фактор роста (EGF)
В экспериментах на животных (крысы и мыши) было показано, что внутримозговое введение перечисленных факторов способствует усилению всех стадий нейрогенеза. Врожденный дефицит (трансгенные мыши с нокаутированным генами соответствующих факторов) приводит к нарушению нейрогенеза, а также поведенческому и когнитивному дефицитам. Эти данные подтверждают важную регуляторную роль перечисленных факторов в нейрогенезе.
Ma DK, Marchetto MC, Guo JU, Ming GL, Gage FH, Song H. Epigenetic choreographers of neurogenesis in the adult mammalian brain. Nat Neurosci.2010;13(11):1338-44.
Для всех этапов нейрогенеза установлены эпигенетические факторы регуляции, например:
- гистоновые деацетилазы (HDACs)
- метилтрансферазы ДНК (DNMTs)
- микро РНК
- и другие.
Coras R, Siebzehnrubl FA, Pauli E, et al. Low proliferation capacities of adult hippocampal stem cells correlate with memory dysfunction in humans. Brain. 2010;133(11):3359-72
Cheyne JE, Grant L, Butler-Munro C, et al. Synaptic integration of newly generated neurons in rat dissociated hippocampal cultures. Mol Cell Neurosci. 2011;47(3):203-14
Hern?ndez-Rabaza V, et al. Neuroscience. 2009;159(1):59-68).
Mochizuki N, Moriyama Y, Takagi N, et al. Intravenous injection of neural progenitor cells improves cerebral ischemia-induced learning dysfunction. Biol Pharm Bull. 2011;34(2):260-5
Sahay A., Hen R. Hippocampal neurogenesis and depression. Novartis Found Symp. 2008;289:152-60
Toni N, Laplagne DA, Zhao C, et al. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nat Neurosci. 2008; 11:901–7
Нейрогенез выполняет важную адаптационную функцию в ЦНС, которая заключается в образовании новых синаптических связей (с участием новых нервных клеток), ремоделировании (перестройке) существующих нейронных сетей в зависимости от воздействия внешних факторов (обучение, физическая активность, стресс и т.д.), «реконструкции» утраченных синаптических связей (под воздействием внешних и внутренних факторов).
Все перечисленные адаптационные изменения оказывают прямое влияние на эмоциональную реакцию, процессы обучения и памяти. Нейрогенез помогает нервной системе сохранять «пластичность», изменяться и перестраиваться под новые условия и задачи.
Lichtenwalner RJ et al. Neuroscienc 2001;107, 603–613
Luo J, et al. Aging Cell. 2006;5(2):139-52
Cuppini R et al. Hippocampus. 2006;16(2):141-8;
Shetty AK, Hattiangady B, Shetty GA. Glia 2005; 51, 173–186
Drapeau E, Nora Abrous D. Aging Cell. 2008;7(4): 569-89
Hattiangady B, Shetty AK. Neurobiol. Aging.2008; 29: 129–177
С возрастом процессы нейрогенеза начинают угасать. На молекулярном уровне старение сопровождается следующими изменениями нейрогенеза:
- дефицит ростовых факторов и нейротрофином — одних из основных регуляторов;
- изменяется нейромедиаторные баланс мозга (количество одних медиаторов уменьшается, других наоборот увеличивается);
- снижается интенсивность всех фаз нейрогенеза;
- снижается кровоснабжение нейрогенной ниши (редуцируется ангиогенез, уменьшается экспрессия фактор роста эндотелия сосудов — VEGF), что уменьшает доступность регуляторных факторов для стволовых клеток;
- увеличивается дистанция между нервными стволовыми клетками и эндотелиальными клетками сосудов (в норме, стволовые клетки трансформируются вблизи сосудов).
Однако возрастные изменения нейрогенеза не являются необратимыми, и адаптивная функция мозга может быть простимулирована.
- В экспериментальных исследованиях на крысах было показано, что нейрональное воспаление может способствовать интеграции вновь образовавшихся нервных клеток в нейронную сеть, т.е. стимулировало конечную фазу нейрогенеза (Jakubs K et al. Inflammation regulates functional integration of neurons born in adult brain. J Neurosci. 2008 Nov 19;28(47):12477-88).
- У пожилых организмов наблюдается дефицит регуляторных молекул, что в числе прочего приводит к ослаблению нейрогенеза. Одной из таких молекул является белок фракталин. Введение этого белка старым крысам приводит к стимуляции гиппокампального нейрогенеза (Bachstetter AD et al. Fractalkine and CX3CR1 regulate hippocampal neurogenesis in adult and aged rats. Neurobiol Aging. 2011;32(11):2030-44).
На картинке представлена информация о стимуляции нейрогенеза у старых крыс индукцией нейровоспаления и введением белка фракталина. Эти данные демонстрируют тот факт, что мозг сохраняется адаптивную функцию, которую несет нейрогенез.
Для естественной стимуляции нейрогенеза в пожилом возрасте у людей эти стратегии представляются чрезмерно агрессивными, поэтому следует рассмотреть естественные позитивные стимулы в качестве «тренировочных» и «поддерживающих» нейрогенез факторов: благоприятная среда, умственная активность, физическая активность, сбалансированное питание.
Medvedeva, E.V., Dmitrieva, V.G., Stavchansky, V.V. et al. Int J Pept Res Ther (2016) 22: 197.
Jakubs K et al. Inflammation regulates functional integration of neurons born in adult brain. J Neurosci. 2008 Nov 19;28(47):12477-88
Taupin P. Nootropic agents stimulate neurogenesis. Expert Opin Ther Pat. 2009 May;19(5):727-30.
Как уже говорилось ранее, не смотря на возрастные изменения, которые претерпевает нейрогенная ниша, функция нейрогенеза может быть восстановлена при наличие определенных стимулов. Следует отметить, что темпы старения и сопряженных с этим процессом возрастных изменений нейрогенеза неоднородны и определяются индивидуальными особенностями организма. В частности, полагают, что у лиц с исходно более высоким уровнем нейрогенеза обладают более высоким уровнем нейропластичности мозга и, следовательно, более устойчивы к возрастным изменениям ЦНС. Однако, способов комплексного воздействия на всю нейрогенную нишу в настоящее время не существует. Как уже упоминалось ранее, сама нейрогенная ниша — некая микросреда, которая включает множество элементов (сосудистое и клеточное микроокружение, набор ростовых и нейротрофических факторов). С одной стороны, имеется достаточно солидный фармакологический опыт регуляции нейрогенеза за счет воздействия на отдельные компоненты этой «микросреды» (введение или индукция эндогенных регуляторных молекул; стимуляция препаратами пролиферации, дифференцировки и выживания вновь образовавшихся нейронов; улучшение мозгового кровообращения и энергетического обмена в ЦНС). С другой, известным фактом является выработка самими стволовыми нервными клетками ростовых и нейротрофических факторов — BDNF, NGF, VEGF и др. (Guzman R. Cellular stroke therapy: from cell replacement to trophic support. Expert Review of Cardiovascular Therapy.2009;7(10):1187-1190). Из этого может следовать вывод, что для восстановления функции нейрогенной ниши можно использовать, например, терапию самими стволовыми клетками или средствами, которые способны стимулировать пролиферацию нервных стволовых клеток. К таким средствам, как уже говорилось ранее, являются антидепрессанты различных фармакологических групп. Косвенным подтверждением подобных выводом могут являться клинические данные о снижении риска старческой деменции после курса (частого осложнения после перенесенной в более раннем возрасте депрессии) лечения антидепрессантами. Следует отметить, что данные о влиянии антидепрессантов на риск развития деменции противоречивы. Так, установлено, что применение трициклических антидепрессантов сопряжено со снижением риска развития деменции, в то время как ингибиторы МАО (моноаминоксидазы), гетероциклические антидепрессанты и СИОЗС (селективные ингибиторы обратного захвата серотонина) напротив могут повышать риск или не оказывать какого-либо эффекта на развитие деменции (Kessing LV, Forman JL, Andersen PK. Do continued antidepressants protect against dementia in patients with severe depressive disorder? Int Clin Psychopharmacol. 2011;26(6):316-22; Lee CW et al. Antidepressant treatment and risk of dementia: a population-based, retrospective case-control study. J Clin Psychiatry. 2016 Jan;77(1):117-22; quiz 122). Тем не менее, эти клинические данные требует осторожности при трактовании, поскольку данные клинические обзоры не учитывают ряд факторов (курение в анамнезе больных, употребление алкоголя, тяжесть и формы депрессивных расстройств, сопутствующие патологии и т.д.).
Другой интересной группой препаратов, которые можно рассматривать в качестве потенциальных нейрогенных агентов, являются ноотропы. Ноотропные средства обладают целом рядом специфических особенностей: 1) действуют только на фоне патологии мнестических функций; 2) обладают накопительным характером действия; 3) разнообразны по механизмам действия и химическому строению; 4) действуют подобно психостимуляторам, но не обладают присущими им побочными эффектами; 5) на сегодняшний день нет убедительных данных о клинической эффективности ноотропов. Считается, что ноотропные препараты обладают комплексным действием на ЦНС: улучшают мозговое кровообращение, энергетический обмен, взаимодействуют с рецепторами большинства нейромедиаторов (ГАМК, глутамат, ацетилхолин). В экспериментальных исследованиях было показана потенциальная способность некоторых ноотропов стимулировать нейрогенез. В частности, пирацетам усиливал процесс дифференцировки в культуре нервных стволовых клеток человека (Taupin P. Nootropic agents stimulate neurogenesis. Expert Opin Ther Pat. 2009 May;19(5):727-30), другой ноотропный препарат семакс усиливал экспрессию генов более 20 ростовых и нейротрофических факторов в мозге крыс после внутрибрюшинного введения в условиях моделирования ишемического инсульта (Medvedeva, E.V., Dmitrieva, V.G., Stavchansky, V.V. et al. Int J Pept Res Ther (2016) 22: 197), что также говорит о потенциальном пронейрогенном эффекте препарата. Ввиду слабой изученности ноотропов сложно говорить о конкретном механизме их нейрогенной активности, в которой может принимать участие как их комплексное действие на ЦНС, так и какой-то конкретный компонент. Очевидно, что данный вопрос требует дальнейших более детальных изучений.
Еще одной группой препаратов, которые могли бы стимулировать нейрогенез, являются корректоры мозгового кровообращения (например, нимодипин или пентоксифиллин). Однако, данные по влиянию этих препаратов на нейрогенез достаточно скудные. В экспериментах на крысах было показано, что обработка пентоксифиллином улучшала кратковременную память и снижало апоптоз нейронов гиппокампа в условиях ишемии головного мозга, что может свидетельствовать о его нейропротективных свойствах (Park J.H. et al. Pentoxifylline Alleviates Perinatal Hypoxic-Ischemia-Induced Short-term Memory Impairment by Suppressing Apoptosis in the Hippocampus of Rat Pups. Int Neurourol J 2016; 20(2): 107-113). Нимодипин, напротив, показал способность подавлять стимулированный ишемией нейрогенез в гиппокампе мышей (Luo C.X. et al. Blockade of L-type voltage-gated Ca channel inhibits ischemia-induced neurogenesis by down-regulating iNOS expression in adult mouse. Journal of neurochemistry, 2005), что, по-видимому, связано с его непосредственным механизмом действия — блокадой кальциевых каналов L-типа.
Для получения полной картины фармакологической манипуляции нейрогенной ниши в условиях возрастных изменений требуются более детальные исследования, которые расширят представления об активности нейрогенных препаратов в релевантных условиях и позволят сделать вывод о перспективных направлениях в создании препаратов, которые бы предупреждали и корректировали возрастных спады нейрогенной активности головного мозга.
Роль нейрогенеза при различных патологиях ЦНС
Bordt, E. A., Polster, B. M. (2014). NADPH Oxidase- and Mitochondria-derived Reactive Oxygen Species in Proinflammatory Microglial Activation: A Bipartisan Affair? Free Radic Biol Med, 34–46
Liu J, Solway K, Messing RO, Sharp FR. Increased neurogenesis in the dentate gyrus after transient global ischemia in gerbils. J Neurosci. 1998;18(19):7768-78
Zhang ZG, Zhang L, Jiang Q, et al. VEGF enhances angiogenesis and promotes blood-brain barrier leakage in the ischemic brain. J Clin Invest. 2000;106:829–38
Nakayama D, Matsuyama T, Ishibashi-Ueda H, et al. Injury-induced neural stem/progenitor cells in post-stroke human cerebral cortex. Eur J Neurosci. 2010;31(1):90-8)
Minger SL, Ekonomou A, Carta EM, et al. Endogenous neurogenesis in the human brain following cerebral infarction. Regen Med. 2007;2(1):69-74).
Нейрогенез выполняет адаптивную функцию и на фоне патологий ЦНС. В частности, ишемический инсульт приводит к гибели нервных клеток (упрощенная схема патогенеза представлена на слайде). Однако, при ишемии быстро (минуты) гибнет небольшое число нейронов — это, так называемое, ядро ишемии. Большая часть нейронов испытывает дефицит глюкозы и кислорода, но сохраняется жизнеспособность в течение нескольких часов (терапевтическое окно для оказания помощи) — это так называемая пенумбра или зона полутени ишемии. В условиях ишемического повреждения мозга происходит активация нейрогенеза в субвентрикулярной зоне латеральных желудочков и вновь образующиеся нейроны мигрируют в зону пенумбры.
Zhang, R. L., Zhang, Z. G., & Chopp, M. (2013). Targeting nitric oxide in the subacute restorative treatment of ischemic stroke. Expert Opinion on Investigational Drugs, 22(7), 843–851.
Chern CM, Liao JF, Wang YH, Shen YC. Melatonin ameliorates neural function by promoting endogenous neurogenesis through the MT2 melatonin receptor in ischemic-stroke mice. Free Radic Biol Med. 2012;52(9):1634-47
Zhang X, Huang G, Liu H, et al. Folic acid enhances Notch signaling, hippocampal neurogenesis, and cognitive function in a rat model of cerebral ischemia. Nutr Neurosci. 2012;15(2):55-61
Zhang C, Chopp M, Cui Y, et al. Cerebrolysin enhances neurogenesis in the ischemic brain and improves functional outcome after stroke. J Neurosci Res. 2010 Nov 15;88(15):3275-81
Zhang RL, Zhang Z, Zhang L, et al. Delayed treatment with sildenafil enhances neurogenesis and improves functional recovery in aged rats after focal cerebral ischemia. J Neurosci Res. 2006;83(7):1213-9
Zheng Z, Chen B. Effects of Pravastatin on neuroprotection and neurogenesis after cerebral ischemia in rats. Neurosci Bull. 2000;23(4):189-97
В экспериментах на животных, при моделировании нарушения мозгового кровотока, наблюдаются неврологические нарушения (когнитивные и поведенческий дефициты), а также большой процент смертности животных. Введение таким животным препаратов с различным механизмом действия, но общей особенностью — способностью стимулировать нейрогенез (фолиевая кислота, церебролизин, правастатин, мелатонин, силденафил, тадалафил) — улучшая неврологические показатели животных и значительно снижает смертность.
Какие перспективы манипуляции нейрогенезом при ишемических повреждениях мозга?
- Возможность применения отдельных препаратов из группы нейропротекторов (церебролизин) в составе комплексной терапии острого ишемического инсульта для предотвращения гибели нейронов в области пенумбры.
- Для многих препаратов, которые показали способность стимулировать нейрогенез и улучшать неврологическое состояние животных после моделирования ишемического инсульта, данный эффект не является основным, следовательно, их клиническое применение затруднено наличием собственных эффектов, которые могут быть нежелательными.
- С другой стороны, изучение механизмов, лежащих в основе нейропротективных эффектов, является важной задачей, поскольку может дать основу для разработки принципиально новых высокоэффективных препаратов для ресторативной терапии ишемического инсульта.
- Фармакологическая регуляция нейрогенеза, на фоне ишемического повреждения мозга, открывает возможности для создания новой группы лекарственных средств, снижающих смертность и улучшающих качество жизни больных после перенесенного ишемического инсульта.
Yu Y et al. Increased hippocampal neurogenesis in the progressive stage of Alzheimer's disease phenotype in an APP/PS1 double transgenic mouse model. Hippocampus. 2009;19(12):1247-53
Ghosal K, Stathopoulos A, Pimplikar SW. APP intracellular domain impairs adult neurogenesis in transgenic mice by inducing neuroinflammation. PLoS One. 2010;5(7):e11866
Mu Y, Gage FH. Adult hippocampal neurogenesis and its role in Alzheimer's disease. Mol Neurodegener. 2011;6:85
Jin K, Peel AL, Mao XO, et al. Increased hippocampal neurogenesis in Alzheimer's disease. Proc Natl Acad Sci USA. 2004; 101(1): 343–347
Болезнь Альцгеймера (БА) — нейродегенеративное заболевание, сопровождающееся гибель холинергических нейронов (нейроны, вырабатывающие ацетилхолин). Причины болезни Альцгеймера в настоящее время точно не установлены, болезнь считается мультифакторной. В основе патогенеза БА лежит нарушение метаболизма белка бета-амилоида, отдельные фракции которого откладываются в нейронах ЦНС и приводят к их гибели. Фракции амилоида по-разному влияют на процессы нейрогенеза, так растворимый предшественник амилоида-альфа (sAPP?) стимулирует все стадии нейрогенеза, в то время как внутриклеточный домен предшественника амилоида (AICD) и бета-амилоид-42 вызывают апоптоз нервных стволовых клеток, снижая пролиферацию и выживаемость. Активация нейрогенеза регистрируется уже на ранних стадиях БА, когда еще нет выраженной нейродегенерации и деменции. По-видимому, нейрогенез на фоне БА также играет адаптивную функцию. На большинстве животных моделей БА (трансгенные мыши с нарушенным метаболизмом бета-амилоида) и посмертном материале больных БА регистрировали увеличение числа BrdU-позитивных клеток. Однако, есть данные об отсутствии изменений в нейрогенезе в некоторых животных моделях БА и посмертном материале некоторых больных с БА. Наконец, остается открытым вопрос о самой способности вновь образовавшихся клеток заменить нейроны, погибшие при БА.
DOI: 10.3233/JAD-2011-110914
DOI: 10.1016/j.ejphar.2011.11.007
DOI: 10.1371/journal.pone.0024293
Экспериментальные исследования, посвященные новым подходам к фармакологической коррекции болезни Альцгеймера, продемонстрировали способность ряда веществ стимулировать нейрогенез у трансгенных мышей (у мышей нарушен нормальный метаболизм бета-амилоида — животная модель болезни Альцгеймера) в сочетании с улучшением поведенческих реакций (ориентировочно-исследовательской реакции, обучения и памяти):
- Введение функциональных фрагментов цилиарного нейротрофина CNTF — пептидов 6 и 6А стимулировало образование новых стволовых клеток и выживание вновь образовавшихся нейронов в субвентрикулярной зоне, зубчатой извилине гиппокампа и обонятельной луковиц (Rockenstein E, Ubhi K, Doppler E, et al. Regional comparison of the neurogenic effects of CNTF-derived peptides and cerebrolysin in A?PP transgenic mice. J Alzheimers Dis. 2011;27(4):743-52)
- Введение глюкозозависимого инсулинотропного пептида (GIF), обладающего свойствами ростового фактора, приводило к усилению пролиферации нервных стволовых клеток в зубчатой извилине гиппокампа (Faivre E, Hamilton A, H?lscher C. Effects of acute and chronic administration of GIP analogues on cognition, synaptic plasticity and neurogenesis in mice. Eur J Pharmacol. 2012;674(2-3):294-306)
- Хроническое и субхроническое введение нейроактивного стероида аллопрегнанолона способствовало повышению выживаемости вновь образующихся нейронов (Chen S, Wang JM, Irwin RW, et al. Allopregnanolone promotes regeneration and reduces ?-amyloid burden in a preclinical model of Alzheimer's disease. PLoS One.2011;6(8):e24293;Singh C, Liu L, Wang JM, et al. Neurobiol Aging. 2012; 33(8): 1493-506)
Полученные результаты указывают на перспективы применения веществ, стимулирующих нейрогенез, для облегчения симптоматики болезни Альцгеймера, а также снижения скорости прогрессирования нейродегенерации, что представляет собой принципиально новый подход к лекарственной коррекции этого заболевания.
Перспективы манипуляции нейрогенезом при болезни Альцгеймера
- Точная этиология болезни Альцгеймера на сегодняшний день остается неизвестной, что затрудняет поиск новых лекарственных средств, направленных на причину заболевания.
- Данные, полученные в ходе генетического моделирования болезни Альцгеймера на животных и изучения постмортального материала людей, страдавших БА, противоречивы.
- В то же время, на животных моделях болезни Альцгеймера было показано, что усиление нейрогенеза отмечается уже на ранних этапах заболевания (до нарушения когнитивной функции). Полагают, что данное усиление можно расценивать как адаптивно-защитную реакцию ЦНС.
- На животных моделях болезни Альцгеймера было показано, что ряд веществ (активные фрагменты цилиарного нейтротрофина — CNTF, глюкозозависимого инсулинотропного пептида — GIP, а также аллопрегнанолон) способны стимулировать нейрогенез и улучшать поведенческий паттерн грызунов.
- Существенным недостатком этих манипуляций является тот факт, что нарушение нейрогенеза, по-видимому, является не причиной болезни Альцгеймера, а лишь симптомом. Однако, перспективы такой терапии могут быть в замедлении прогрессирования заболевания и отсрочке развития деменции.
DOI: 10.1016/j.pharma.2013.02.006
PMID: 11124987
DOI: 10.1186/s13045-017-0499-7
На фоне клинической депрессии (большое депрессивное расстройство) также фиксируют снижение нейрогенеза и уменьшение объема гиппокампа, которое восстанавливается после курса антидепрессантов. Полагают, что в основе патогенеза депрессивных расстройств роль пускового фактора играет хронический стресс, который запускает каскад стресс-зависимых реакций, завершающихся гиперпродукцией кортизола и увеличением концентрации глутамата в ЦНС. Эти фактор нарушают пластичность мозга (и нейрогенез в частности) и способствуют развитию депрессивной симптоматики). Хроническое применение антидепрессантов, напротив, стимулирует нейрогенез, повышая концентрацию в ЦНС моноаминов (серотонина и норадреналина), мозгового нейротрофического фактора. Некоторые антидепрессанты имеют и дополнительные механизмы регуляции нейрогенеза. Например, амитриптилин способен ингибировать гистоновые деацетилазы, которые играют роль эпигенетических регуляторов нейрогенеза, и тем самым стимулирует пролиферацию нервный стволовых клеток.
Перспективы манипуляции нейрогенезом при депрессии
- Большинство антидепрессантов, независимо от группы и механизма действия, способны стимулировать нейрогенез в условиях моделирования депрессии на животных моделях.
- У людей, страдающих депрессией, хроническое применение антидепрессантов восстанавливает объем гиппокампа, снижение которого обычно отмечается при депрессивных расстройствах.
- Общий механизм действия всех антидепрессантов — влияние на моноаминовую систему, в частности, способность повышать концентрации серотонина и норадреналина в ЦНС.
- В многочисленных экспериментальных работах показана важная роль моноаминов (серотонина и норадреналина) в регуляции гиппокампального нейрогенеза во взрослом мозге.
- Перспективным направлением представляется дальнейшее детальное изучение механизмов регуляции нейрогенеза серотонином и норадреналином, понимание которых может помочь в разработке более новых средств фармакологической коррекции депрессий.
- Однако не все антидепрессанты способны стимулировать нейрогенез сами по себе, некоторые лишь восстанавливают исходный уровень нейрогенеза, сниженный хроническим стрессом.
- Поэтому другим важным направлением является изучение механизмов антидепрессантов, не связанных с моноаминовой системой. Например, влияние антидепрессантов на эпигенетические регуляторы нейрогенеза.
- Отдельное направление представлено разработкой препаратов на основе мозгового нейротрофического фактора (BDNF) и снижением действия глутамата на ЦНС (блокаторы глутаматных NMDA-рецепторов).
Общие перспективы и подходы к изучению нейрогенеза
1. Изучение молекулярных механизмов регуляции нейрогенеза в зрелом мозге.
- Какие системы вовлечены в процесс регуляции нейрогенеза во взрослом мозге и какие нарушения ведут к торможению нейрогенеза?
- Рассмотрение этих систем и их отдельных компонентов в качестве потенциальных мишеней для лекарственной коррекции нейрогенеза.
- Поиск новых «формул» лекарственных средств, способных регулировать процессы нейрогенеза во взрослом мозге.
2. Дальнейшие исследования должны ответить на вопрос: в какой мере новообразованные нейроны могут заместить потерянные ЦНС в ходе конкретной патологии?
3. Необходимо оценить возможные последствия долгосрочного экзогенного стимулирования взрослого нейрогенеза.
4. Необходимо вырабатывать комплексную стратегию коррекции нарушений нейрогенеза, которая бы учитывала все основные факторы:
- Необходимость ангиогенеза
- Самого нейрогенеза
- Синаптогенеза
- Аксонального ремоделирования
- Создания благоприятных внешних условий
Источник: geektimes.ru