Нейронную сеть научили моделировать потенциальные противораковые лекарства
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2017-02-10 16:04

Разработчики из Mail.Ru Group, Insilico Medicine и МФТИ впервые применили нейронную сеть к созданию новых лекарственных препаратов. Использование технологий генеративных нейронных состязательных сетей, обученных «придумывать» молекулярные структуры, может в разы сокращать время и стоимость поиска веществ, обладающих потенциально лечебными свойствами.
Исследователи предполагают возможное применение этих технологий для поиска новых препаратов в самых разных областях от онкологии до сердечно-сосудистых заболеваний. Результаты опубликованы в рецензируемом журнале Оncotarget.
На данный момент в базе неорганических молекул несколько сотен миллионов веществ, и только доля процента из них применяется в медицине. Фармакологические методы создания лекарств носят, в основном, наследственный характер. Например, фармакологи продолжают исследовать аспирин, который применяется уже много лет, что-то добавляют к молекуле, чтобы снизить побочные эффекты или повысить эффективность, но это всё то же вещество. Как выбрать из сотен миллионов принципиально новую молекулу, обладающую лечебными свойствами? Эту задачу исследователи из МФТИ и Insilico Medicine решили с помощью нейронной сети еще в начале 2016 года, опубликовав статью в журнале Molecular Pharmaceuticals. В этот раз исследователи решили пойти дальше и поставили себе иную цель — создать новые молекулы с заранее заданными свойствами и заставить глубокие нейронные сети "вообразить" новые структуры молекул, которые могли бы убивать раковые клетки при определенной концентрации.
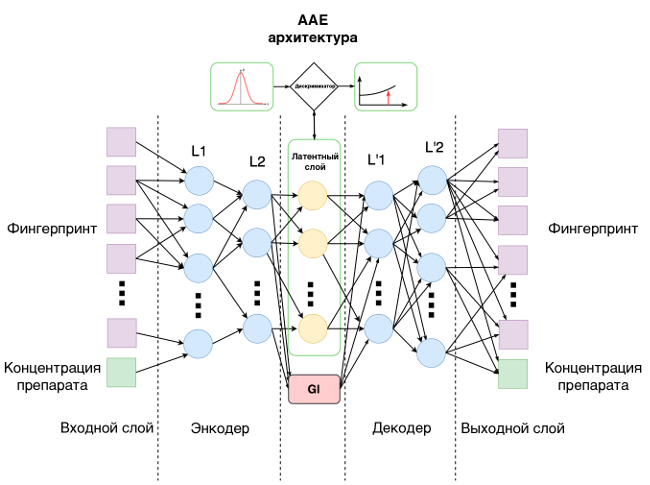
За основу была взята архитектура состязательных автокодировщиков, являющаяся расширением принципиально нового подхода в глубоком обучении, генеративных состязательных сетей. Для обучения использовались молекулы с известными лечебными свойствами и эффективной концентрацией. Информацию о такой молекуле подавали на вход сети. Сеть настраивали так, чтобы на выходе получить точно такие же данные. Она была составлена из трёх структурных элементов — кодировщика, декодера и дискриминатора, — каждый из которых выполнял свою специфическую роль, «сотрудничая» с двумя другими. Кодировщик совместно с декодером обучался сжимать и затем восстанавливать информацию об исходной молекуле, а дискриминатор помогал сделать сжатое представление более подходящим для последующего восстановления. После того как сеть обучалась на множестве известных молекул, кодировщик вместе с дискриминатором «выключались», и сеть, используя декодер, генерировала описание молекул уже сама.
Обучение нейронных сетей зависит от количества входных данных и от размеров самой сети. В среднем наша нейронная сетка обучается в течение недели [зависит как от сети, так и от данных и железа]. То, насколько хорошо идёт воспроизведение, влияет конфигурация слоев. Поиск наиболее оптимального решения архитектуры сети может занять от нескольких дней до нескольких месяцев. Настройка нейронной сети — это целое искусство.
Все молекулы имеют представление в виде "смайлзов" — буквенных аннотаций химического вещества, которые позволяют восстановить его структуру. Стандартная запись, которой обучали в школе, не подходит для обработки сетью, но и смайлз не очень подходит — он имеет произвольную длину от одной буквы до 200. Для обучения нейронной сети требуется одинаковая длина описания (вектора). Решает эту задачу фингерпринт, в переводе «отпечаток пальца» молекулы. Фингерпринт содержит в себе всю информацию о молекуле. Существует множество способов построения «отпечатка», исследователи использовали самый простой бинарный из 166 цифр. Они конвертировали смайлзы в фингерпринты и на них уже обучали сеть.
На вход нейронной сети подавались «отпечатки» известных лекарственных молекул. Сеть должна была распределить веса параметров внутренних нейронов так, чтобы при заданном входе получился заданный же выход. Эта операция повторялась много раз — так происходит обучение на большом количестве данных. В результате получается «чёрный ящик», который умеет при заданном входе давать заданный выход. Затем разработчики убрали первые слои, и сеть генерировала фингерпринты при обратном прогоне уже сама. Учёные построили «отпечатки» для всех 72 млн молекул и далее сравнивали сгенерированные сетью фингерпринты с базой. Отобранные молекулы должны потенциально обладать заданными качествами.
Комментирует один из авторов, аспирант МФТИ Андрей Казеннов: «Мы разработали нейронную сеть генеративного типа, то есть умеющую создавать новые объекты по заданным параметрам, используя "накопленные знания" о миллионах объектах на которых она обучалась. Мы разработали и обучили модель сети, которая способна создавать новые молекулярные структуры с заданными свойствами».
Для проверки сети использовали базу известных противораковых лекарств. Исследовали сверили сгенерированные сетью соединения с общей базой. Из полученных 69 молекул многие являются активно используемыми противораковыми препаратами. А вот остальные потенциально могут стать основой новых лекарственных препаратов.
Рассказывает один из авторов исследования Александр Жаворонков, глава Insilico Medicine и международный адъюнкт-профессор МФТИ: «Генеративные состязательные сети с применением обучения с подкреплением — это будущее фармакологии. В этой статье мы показали первое применение генеративных состязательных автокодировщиков, GAN'ов, для создания новых молекулярных структур противоопухолевых препаратов по определённым параметрам. Эта работа была сделана ещё летом, и с тех пор мы значительно продвинулись в этом направлении. Я очень надеюсь, что в скором времени мы сможем разрабатывать индивидуальные лекарства для лечения редких заболеваний и даже для лечения отдельных пациентов. Уже в этом году искусственный интеллект начнёт трансформировать фармацевтическую индустрию».
«GAN'ы находятся сейчас на переднем крае нейронауки. Совершенно очевидно, что они могут быть использованы на более широком спектре задач, чем генерация картинок и музыки. Мы попробовали применить этот подход в биоинформатике и получили прекрасный результат», — подводит итог Артур Кадурин, ведущий программист группы оптимизации поиска Mail.Ru Group, независимый научный консультант Insilico Medicine.
Источник: www.robogeek.ru