Следующая после болезни Альцгеймера: описана новая форма деменции
МЕНЮ
Главная страница
Поиск
Регистрация на сайте
Помощь проекту
Архив новостей
ТЕМЫ
Новости ИИ
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Искусственный интеллект
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Психология ИИ
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Творчество ИИ
Техническое зрение
Чат-боты
Авторизация
2021-01-21 17:20
Что такое LATE-энцефалопатия?
LATE-энцефалопатия (limbic-predominant age-related TDP-43 encephalopathy, LATE; связанная с возрастом TDP-43-энцефалопатия с преимущественным поражением гиппокампа) — это поражение головного мозга, связанное с накоплением белка TDP-43 в нейронах и глиальных клетках. В норме этот белок расположен в ядрах клеток. Он регулирует трансляцию и транскрипцию многих белков в центральной нервной системе, в частности, тех, которые вовлечены в процессы аутофагии и очистки клеток от поврежденных элементов. Кроме этого, TDP-43 участвует в организации движения молекул внутри аксона. При LATE-энцефалопатии TDP-43 фосфорилируется, что приводит к образованию агрегатов белка [1]. Массивы измененного белка накапливаются в цитоплазме клеток и начинают нарушать их работу. Кроме этого, скопления протеина обнаруживают при болезни Альцгеймера (БА) [2] и лобно-височной деменции (ЛВД).
Выделение учеными LATE-энцефалопатии в отдельное заболевание стало ответом на сложности, возникшие с БА. Существует доказанная корреляция между когнитивным снижением у пожилых людей и нейродегенеративными изменениями по альцгеймеровскому типу (накоплением бета-амилоида [3] и тау-белка в нервных клетках). Чем сильнее были эти изменения, тем выраженнее нарушались когнитивные функции. При более внимательном взгляде на проблему оказалось, что у людей в возрасте старше 80 лет такая связь прослеживается не настолько явно, и это требовало объяснения. «Альцгемейровские» изменения не соответствовали когнитивному снижению: они оказались менее выраженными, чем ожидалось при таких когнитивных нарушениях. В итоге сложилось впечатление, что параллельно с «альцгеймеровскими» процессами в нервной ткани проходят еще какие-то, но ученые не могли их зафиксировать.
Ответ на вопрос пришел из исследований уже известных неврологических заболеваний — бокового амиотрофического склероза (БАС — заболевания, которым страдал Стивен Хокинг) и ЛВД. В 2006 году описали белок TDP-43, который в фосфорилированном виде играет большую роль в патогенезе этих расстройств [4]. Через год обнаружили, что фосфорилированный TDP-43 накапливается в клетках головного мозга у людей старше 80 лет, которые не страдают ни БАС, ни ЛВД, но при этом обнаруживают клиническую картину деменции, схожую с БА [5]. У таких пациентов значительно ухудшалась память: в первую очередь эпизодическая (кратковременная). Научные наблюдения следующих лет позволили выделить когнитивное снижение при накоплении TDP-43 в отдельное заболевание с рядом специфических черт.
Биология новой деменции
В ходе исследований обнаружили пять генов, которые связаны с возникновением LATE-энцефалопатии. При этом нейродегенеративном заболевании зафиксированы мутации в генах GRN (на 17-й хромосоме) и TMEM106B (на 7-й хромосоме) [6]. Мутации в этих же генах сопровождают лобно-височную деменцию и склероз гиппокампа. О последнем состоянии мы еще поговорим, но сейчас важно обратить внимание на то, что на генетическом уровне существует пересечение между ЛВД и LATE-энцефалопатией. Мы уже знаем, что между ними есть общность в виде отложений фосфорилированного TDP-43, но теперь мы видим и генетическую связь этих заболеваний. Кроме упомянутых двух генов с развитием LATE-энцефалопатии связаны гены ABCC9 (на 12-й хромосоме), KCNMB2 (на 3-й хромосоме) и APOE (на 19-й хромосоме) [6]. Последний хорошо известен тем, что увеличивает риск развития БА.
Основной морфологический субстрат новой деменции — это накопление фосфорилированного TDP-43. Отложение протеина происходит во многих отделах головного мозга. Агрегаты TDP-43 обнаруживают в лимбической системе, обонятельных луковицах, коре головного мозга, базальных ганглиях и стволе (рис. 1) [7].
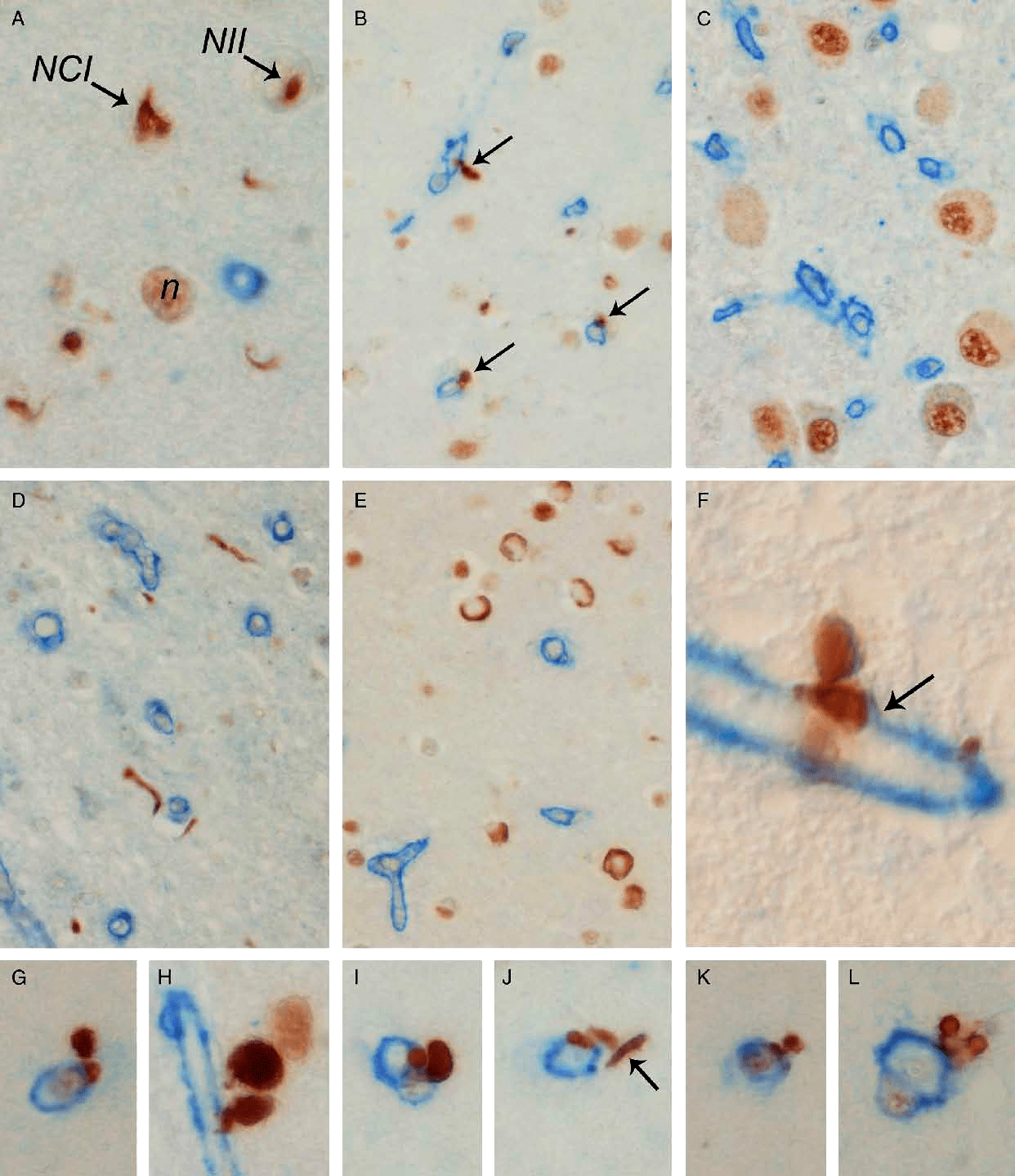
Рисунок 1. Включения TDP-43 (коричневый цвет) при лобно-височной дегенерации в различных отделах головного мозга. Голубым цветом окрашен коллаген 4-го типа.
На основании материалов вскрытий пациентов с LATE-энцефалопатией ученые выяснили этапность поражения головного мозга при этом расстройстве. На первом этапе изменению подвергаются миндалевидные тела, затем патологический процесс захватывает гиппокамп. Завершающие процессы происходят в средней лобной извилине. Для посмертной диагностики LATE-энцефалопатии рекомендовано проводить иммуногистохимическое исследование тканей из этих трех областей мозга.
Из-за сложностей нейровизуализации заболевание, к сожалению, обнаруживают уже на стадии структурных нарушений в гиппокампе. Способы нейровизуализации, которые широко доступны врачам и ученым, не обладают достаточной чувствительностью для выявления изменений в миндалевидных телах при LATE-энцефалопатии. Поэтому гиппокамп, лучше доступный для визуализации, получил особое внимание специалистов.
Очень важно было найти разницу между изменениями в гиппокампе при LATE-энцефалопатии, при болезни Альцгеймера и при гиппокампальном склерозе как отдельном состоянии.
Склеротические нарушения в структуре гиппокампа — первое обнаруженное, но не единственное отличие LATE-энцефалопатии от БА. Склероз гиппокампа — это потеря нервных клеток в основании гиппокампа и в области CA1 с последующим замещением глиальной тканью (рис. 2). Этот процесс не совпадает по объему с поражением гиппокампа при БА, которое имеет более обширный характер.
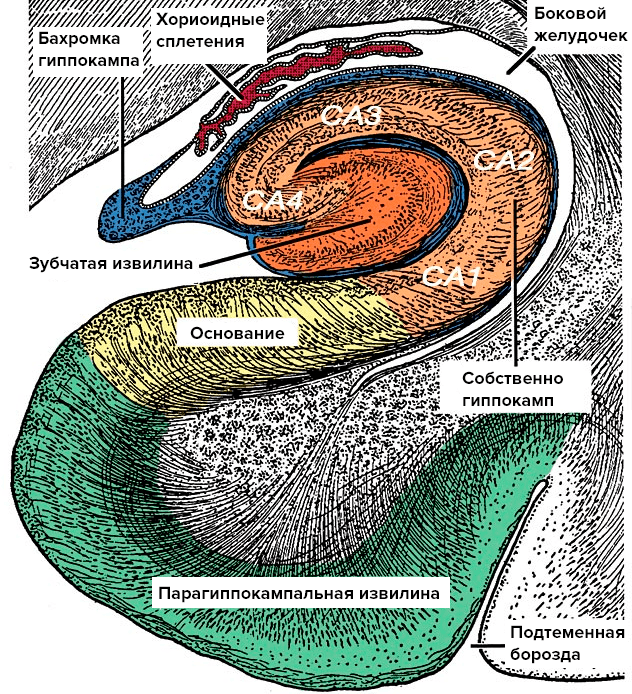
Рисунок 2. Анатомия гиппокампа. Гиппокамп — это сложно устроенная часть головного мозга, которая скрыта под толщей больших полушарий. При гиппокампальном склерозе патологический процесс затрагивает основание гиппокампа и область CA1.
Также необходимо отделить нарушения структуры гиппокампа при LATE-энцефалопатии от гиппокампального склероза. Склероз гиппокампа как самостоятельное структурное изменение встречается при эпилепсии, нейроинфекциях и некоторых нейродегенеративных заболеваниях. Существует два принципиальных различия между этими типами изменений гиппокампа:
- Поражение лимбических структур (гиппокампа и миндалевидных тел) при LATE-энцефалопатии происходит в большей степени, чем при гиппокампальном склерозе. При этомчем выраженнее структурные нарушения в миндалевидных телах, тем сильнее когнитивное снижение у пациента [8].
- Поражение гиппокампа, вызванное отложениями фосфорилированного TDP-43, всегда двустороннее, в отличие от гиппокампального склероза, который может быть односторонним.
Самостоятельный гиппокампальный склероз также может сопровождать LATE-энцефалопатию, и в этом случае прогрессирование деменции будет быстрым (рис. 3).
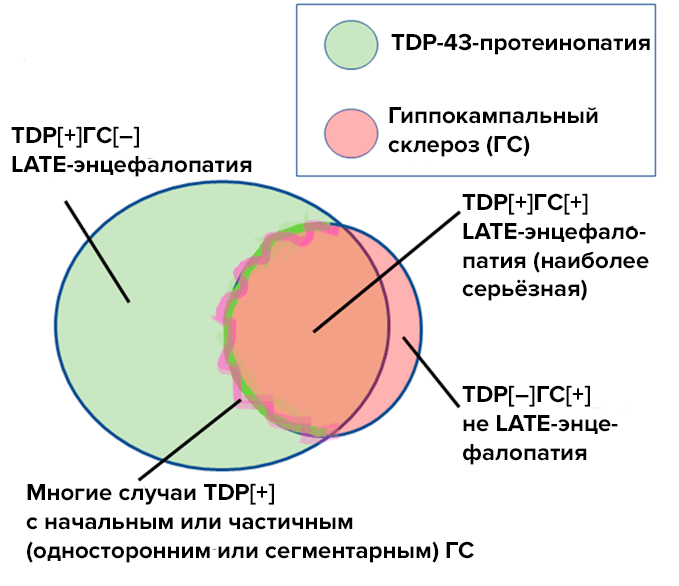
Рисунок 3. TDP-43-протеинопатия, или LATE-энцефалопатия (зеленый круг), и гиппокампальный склероз (розовый круг) — это самостоятельные заболевания. При сочетании этих патологий у пациентов ппоисходит быстрое прогрессирование деменции. Часть случаев LATE-энцефалопатии сопровождается частичным или односторонним гиппокампальным склерозом (розово-зеленая зона на границе розового круга).
Клиническая картина LATE-энцефалопатии
Ключевой признак LATE-энцефалопатии — нарушение эпизодической памяти у лиц старше 80 лет. Этот симптом сближает LATE-энцефалопатию с БА, и дифференциальный диагноз между ними — это сложная и не решенная до конца задача. Клинически LATE-энцефалопатия сопровождается преимущественным поражением памяти без нарушений настроения и поведения. Также при LATE-энцефалопатии в отличие от БА не возникает афазии (нарушений речи) и психотических симптомов (бреда и галлюцинаций). В этом свете течение LATE-энцефалопатии можно назвать доброкачественным, хотя сложно использовать это слово в отношении непрерывно прогрессирующего неврологического заболевания, приводящего к потере самостоятельности.
Куда более заметные различия можно обнаружить между LATE-энцефалопатией и лобно-височной деменцией, при которых происходит отложение TDP-43 в нервных клетках. LATE-энцефалопатия начинается в возрасте 80 лет и старше, а ЛВД поражает людей меньшего возраста, иногда даже в 50 лет. Последняя сопровождается эмоциональными изменениями, такими как уплощение эмоций или их огрубление и стереотипизацию. При ЛВД можно обнаружить нарушение социальной дистанции или сексуальную расторможенность. LATE-энцефалопатия не сопровождается подобными симптомами. При ней развивается деменция с преимущественным поражением памяти. Нейровизуализация при LATE-энцефалопатии обнаруживает также поражение лимбической системы мозга, чего не происходит при ЛВД. Лобно-височная деменция, в свою очередь, вызывает более обширные и выраженные изменения в коре головного мозга, чем LATE-энцефалопатия.
Что нам дает новый тип деменции?
Авторы отчета признают, что определение LATE-энцефалопатии как отдельного заболевания — это только начало пути. Впереди еще много исследований, которые должны пролить свет на возникновение и течение заболевания, а также открыть путь к его лечению. Однако признание LATE-энцефалопатии уже дало многое.
Сейчас в клинических исследованиях фиксируют большое количество пациентов пожилого возраста, которые демонстрируют признаки когнитивного снижения с преимущественным поражением памяти и атрофией гиппокампа, но при исследованиях у них не обнаруживают характерный для БА амилоидоз. Доля таких пациентов достигает 15-30% от числа людей, включенных в исследование [9]. Что с ними происходит? Чем они болеют? LATE-энцефалопатия становится ответом на этот вопрос.
Часть случаев деменции, которая диагностирована как проявление БА, может оказаться вызвана совсем не ею, а нейродегенеративным заболеванием, описанным в отчете. Это касается людей в возрасте 80 лет и старше — той возрастной группы, число представителей которой постепенно увеличивается благодаря достижениям медицины. К сожалению, пока не существует достоверных биомаркеров LATE-энцефалопатии за исключением определения отложений TDP-43 в нервных и глиальных клетках. Мы не можем брать биопсию головного мозга у всех пациентов с подозрением на LATE-энцефалопатию. По этой причине придется придумывать пока что-то более безопасное, чем инвазивное вмешательство.
Решением может стать внедрение системы ATN, которая помогает отделить случаи деменции при БА от других деменций с «альцгеймеровской» симптоматикой (рис. 4). При помощи различных способов нейровизуализации мы можем определить, есть ли у пациента бета-амилоид (A) и тау-протеин (Т), а также идет ли в мозге человека процесс нейродегенерации (N).
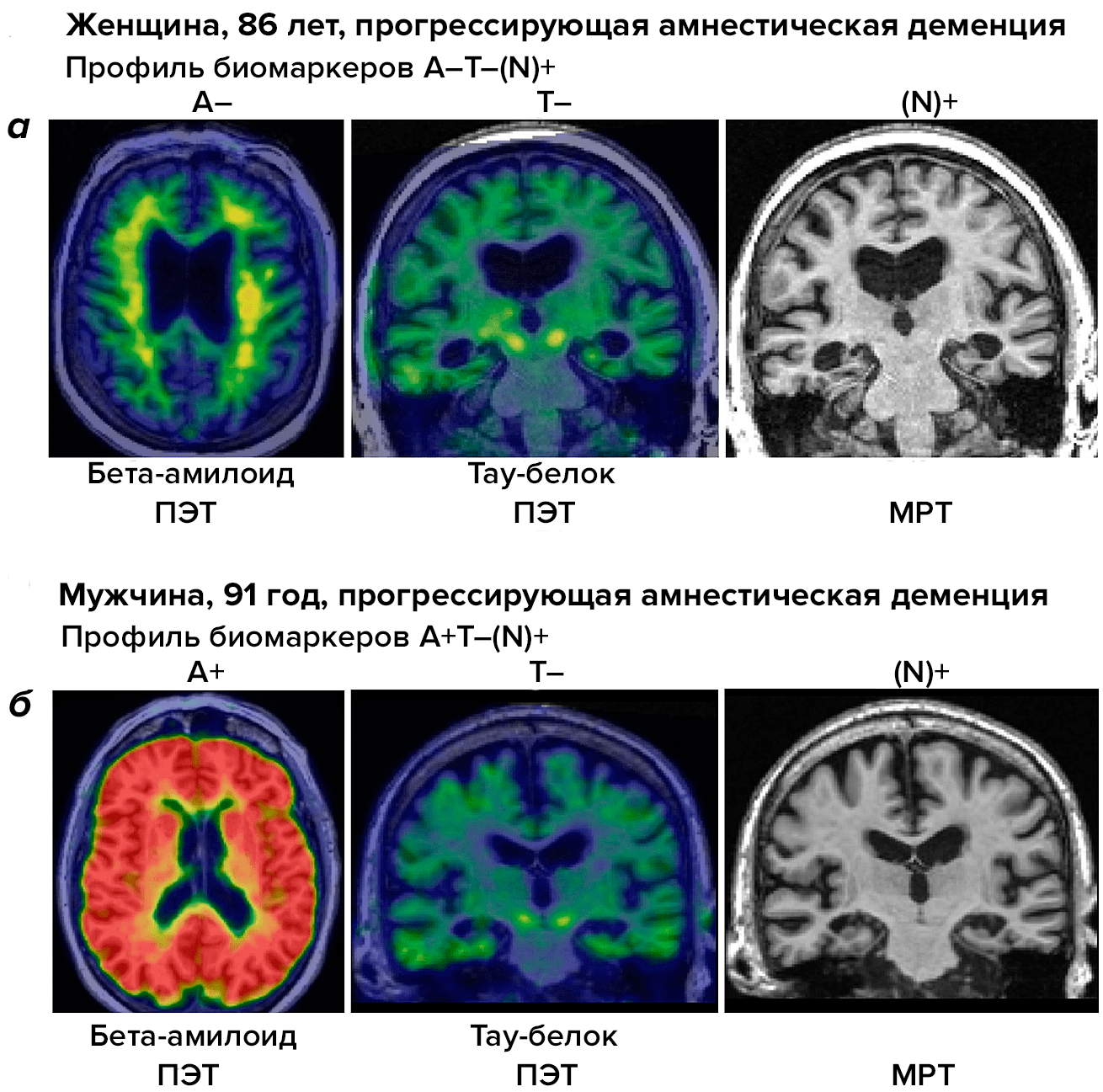
Рисунок 4. Система ATN для дифференциальной диагностики болезни Альцгеймера и других нейродегенеративных заболеваний у пожилых людей. На панели а видны результаты сканирования мозга при разных методах нейровизуализации у пациентки с подозрением на БА. ПЭТ (позитронно-эмиссионная томография) для выявления бета-амилоида (А) и тау-протеина (Т) не дает положительного результата. МРТ для выявления нейродегенеративного поражения (N) дает положительный результат. В последующем при вскрытии у пациентки диагностирована LATE-энцефалопатия. На панели б мы видим результаты сканирования мозга другого пациента с подтвержденной БА. ПЭТ на бета-амилоид и тау-протеин дает положительный ответ, как и МРТ, нацеленная на поиск нейродегенеративных изменений.
Те случаи, когда есть клиника альцгеймеровской деменции, но структурные и молекулярные изменения не соответствуют ей, формируют пул SNAP (Suspected Non-Alzheimer’s Pathology). Это деменции с патогенезом, отличным от патогенеза БА. Различия в патогенезе требуют разных подходов к лечению заболеваний. В последнее время амилоидная гипотеза БА получает серьезные удары: лекарства, нацеленные на уничтожение бета-амилоида или предотвращение его отложения, не показывают эффективности в клинических исследованиях. Основная причина, которую обсуждают специалисты, заключается в том, что отложение бета-амилоида не причина БА, а сопутствующий процесс. Мы еще не смогли обнаружить основной процесс патогенеза, а значит, не можем в него вмешаться. Описанная LATE-энцефалопатия дает второй, альтернативный ответ на вопрос «Почему при БА не эффективны препараты против амилоида?». Этот ответ звучит следующим образом: возможно, у кого-то из пациентов вовсе не болезнь Альцгеймера, а LATE-энцефалопатия. Если это окажется так, нам нужно будет разрабатывать новые методы лечения, отличные от уже известных способов терапии деменции.
Литература
- Masato Hasegawa, Tetsuaki Arai, Takashi Nonaka, Fuyuki Kametani, Mari Yoshida, et. al.. (2008). Phosphorylated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Ann Neurol.. 64, 60-70;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Возможно, ?-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- M. Neumann, D. M. Sampathu, L. K. Kwong, A. C. Truax, M. C. Micsenyi, et. al.. (2006). Ubiquitinated TDP-43 in Frontotemporal Lobar Degeneration and Amyotrophic Lateral Sclerosis. Science. 314, 130-133;
- Catalina Amador-Ortiz, Zeshan Ahmed, Cynthia Zehr, Dennis W. Dickson. (2007). Hippocampal sclerosis dementia differs from hippocampal sclerosis in frontal lobe degeneration. Acta Neuropathol. 113, 245-252;
- Peter T Nelson, Dennis W Dickson, John Q Trojanowski, Clifford R Jack, Patricia A Boyle, et. al.. (2019). Limbic-predominant age-related TDP-43 encephalopathy (LATE): consensus working group report. Brain. 142, 1503-1527;
- Wen-Lang Lin, Monica Castanedes-Casey, Dennis W. Dickson. (2009). Transactivation Response DNA-Binding Protein 43 Microvasculopathy in Frontotemporal Degeneration and Familial Lewy Body Disease. Journal of Neuropathology and Experimental Neurology. 68, 1167-1176;
- Nazanin Makkinejad, Julie A. Schneider, Junxiao Yu, Sue E. Leurgans, Aikaterini Kotrotsou, et. al.. (2019). Associations of amygdala volume and shape with transactive response DNA-binding protein 43 (TDP-43) pathology in a community cohort of older adults. Neurobiology of Aging. 77, 104-111;
- Brian A. Gordon, Tyler Blazey, Yi Su, Anne M. Fagan, David M. Holtzman, et. al.. (2016). Longitudinal ?-Amyloid Deposition and Hippocampal Volume in Preclinical Alzheimer Disease and Suspected Non–Alzheimer Disease Pathophysiology. JAMA Neurol. 73, 1192.
Источник: biomolecula.ru