Рассеянный склероз: иммунная система против мозга
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2020-08-31 15:45
Рассеянный склероз — серьезное и непредсказуемое заболевание, которое может возникнуть в любом возрасте, но чаще всего «под удар» попадают молодые люди в самую активную фазу жизни. И хотя эта болезнь может серьезно изменить привычный ход вещей, она всё же оставляет пациентам возможность жить полной жизнью, не останавливаться и не смиряться. Пример вдохновляющей жизненной позиции при диагнозе «рассеянный склероз» подает Ирина Ясина — журналист, публицист, правозащитник [1], [2]. В 2012 году она издала автобиографическую повесть «История болезни. В попытках быть счастливой», в которой описала свою болезнь как «сущее, которое изменило мою жизнь, не исковеркало, не обворовало, а медленно и неуклонно выбивало старые привычки, устоявшиеся интересы, меняло вкусы и отношение к дому, к вещам, к любви, к чужим слабостям. Отнимая одно, всегда щедро давало другое». Даже с такой тяжелой болезнью, как рассеянный склероз, человек может справляться, не теряя желания и способности сохранять активный образ жизни. Во многом это стало возможным благодаря достижениям современной медицины. В этой статье мы обсудим, у каких людей и при каких обстоятельствах может возникать рассеянный склероз, каковы механизмы развития болезни и способы ее лечения. Поговорим и о том, где искать хорошие источники информации о заболевании, и обсудим пациентские организации.
Что такое рассеянный склероз?
Рассеянный склероз (РС) впервые описал в 1868 году французский невролог Жан Мартен Шарко (Jean-Martin Charcot). Сейчас это одно из наиболее распространенных хронических заболеваний центральной нервной системы (ЦНС), поражающее людей практически всех возрастов во многих частях света, однако отдающее «предпочтение» молодым европеоидным женщинам, проживающим в северных широтах. При РС иммунная система организма атакует свой собственный миелин — оболочку, окружающую аксоны нервных клеток и влияющую на скорость передачи по ним электрического импульса (рис. 1) [3]. Оставшись без защитного миелинового слоя, волокна нервных клеток становятся уязвимыми и могут погибнуть. Снижение скорости нервных импульсов и гибель нервных волокон приводят к появлению неврологических симптомов (см. раздел «Симптомы рассеянного склероза»). Учитывая, что разные доли головного мозга отвечают за различные функции организма, в зависимости от того, в каком месте произошла демиелинизация аксонов, будут проявляться разные симптомы. Именно поэтому РС называют аутоиммунным (иммунная система работает против собственного организма), демиелинизирующим (разрушается миелин) и нейродегенеративным (повреждаются нервные волокна) заболеванием.

Рисунок 1. Здоровый нейрон и нейрон с поврежденным миелином. Скорость передачи электрического импульса по миелинизированным аксонам достигает 100 м/с, тогда как по немиелинизированным волокнам импульсы распространяются в 5–50 раз медленнее.
Так как демиелинизация и нейродегенерация происходят постепенно, развивающийся РС может длительное время никак не проявляться. Этот скрытый период болезни может продолжаться вплоть до нескольких лет. Диагностика РС достаточно сложна и требует времени, а кроме того, нет надежных методов прогнозирования заболевания и его лечения. Всё это наряду с широким распространением делает РС одним из самых социально значимых заболеваний, а его изучение — одной из важнейших медико-биологических задач.
Очаги демиелинизации при РС выглядят как уплотнения, которые врачи впервые обнаружили в 19 веке в мозге пациентов, умерших от РС. Эти очаги получили название «склероз», что в переводе с греческого означает «рубец». Сейчас патологи называют их «бляшками рассеянного склероза», и они являются важнейшим признаком заболевания. Размеры бляшек варьируют от нескольких миллиметров до нескольких сантиметров, и с течением болезни очаги демиелинизации могут появляться во всё новых местах ЦНС — рассеиваться. Именно поэтому болезнь называется «рассеянный склероз».
Факторы риска и эпидемиология
Большинство заболеваний человека считаются комплексными, то есть развивающимися вследствие взаимодействия генетических, эпигенетических и внешних факторов. К таким заболеваниям относится и РС. Он возникает у людей с генетической предрасположенностью в результате воздействия на организм факторов внешней среды, запускающих патологические механизмы. Генетическая предрасположенность отвечает за риск развития РС только на 30%. Оставшиеся 70% связаны с вкладом негенетических факторов. Ниже мы выясним, что может влиять на риск развития РС, однако ст?ит сразу упомянуть, что однозначно предсказать возникновение болезни по этим факторам невозможно.
Генетика и эпигенетика
Наиболее убедительно роль наследственности показана в близнецовых исследованиях. Если болезнь находится под генетическим контролем, то РС должен проявляться у однояйцевых близнецов (с полностью идентичным геномом) чаще, чем у разнояйцевых (с неидентичными геномами). Для однояйцевых близнецов вероятность развития РС составляет 25%, а для двойняшек — только 5% [4]. Семейные случаи РС достаточно редки (в среднем около 5%), и чем более далеких родственников мы рассматриваем, тем ниже риск заболевания.
За исключением семейных случаев, РС не передается по наследству. С вероятностью 98% у ребенка, родитель которого болен РС, болезнь НЕ разовьется. Однако наследуется генетическая предрасположенность к заболеванию: варианты генов (аллели), определяющие предрасположенность к РС, могут передаваться от родителей детям. Предрасположенность к РС складывается из эффекта нескольких генов, вклад каждого из которых невелик. У разных пациентов за развитие болезни могут отвечать разные комбинации генов. Таким образом, РС — это типичное полигенное заболевание [5].
Но для того чтобы развился РС, недостаточно одной генетической предрасположенности. Необходимо влияние и остальных факторов риска, к которым, помимо воздействий внешней среды (см. ниже), относят эпигенетическую регуляцию [6], [7], [8]. Сигналы из внешней среды с помощью эпигенетических механизмов (ковалентной модификации ДНК и/или гистонов и действия малых регуляторных РНК) определяют, какие именно гены будут активными, а какие — нет.
Возраст, пол и этническая принадлежность
РС — это болезнь молодых. Пик заболеваемости приходится на самый активный период жизни человека — 20–40 лет. Однако болезнь может развиться даже у детей. Как правило, чем позже начинается РС, тем тяжелее он протекает. Женщины заболевают примерно в три раза чаще мужчин, но зато у мужчин чаще развивается более тяжелая форма болезни.
Повышенная заболеваемость среди женщин характерна не только для РС, но и для некоторых других аутоиммунных патологий (например, ревматоидного артрита и системной красной волчанки [13]). Предполагают, что дело тут во влиянии половых гормонов, которые, помимо физиологических и поведенческих функций, регулируют еще и иммунный ответ. Например, у беременных пациенток с РС состояние существенно улучшается, однако после родов течение болезни вновь ухудшается, что может быть связано с падением уровня эстрогенов. Беременность относится к одним из самых сильных индукторов иммунологической толерантности, то есть способности «не замечать» возможные патогены. Гормоны беременности способствуют резкому увеличению количества регуляторных T- и B-лимфоцитов, которые ослабляют развитие иммунного ответа и снижают угрозу отторжения плода организмом матери [14]. Эти же клетки формируют временную толерантность к собственным антигенам (аутоантигенам) при РС, ослабляя проявления болезни.
РС встречается в большинстве этнических групп: европейской, африканской, азиатской, латиноамериканской. Заболеванию практически не подвержены эскимосы, венгерские цыгане, норвежские саамы, коренные жители Северной Америки, Австралии и Новой Зеландии и некоторые другие.
Факторы внешней среды
Территория проживания. В мире насчитывается около 2,5 млн пациентов с РС, из которых в России, по оценкам экспертов, проживает примерно 200 тысяч. Чаще всего РС встречается у жителей Северной Европы и Канады (рис. 2).
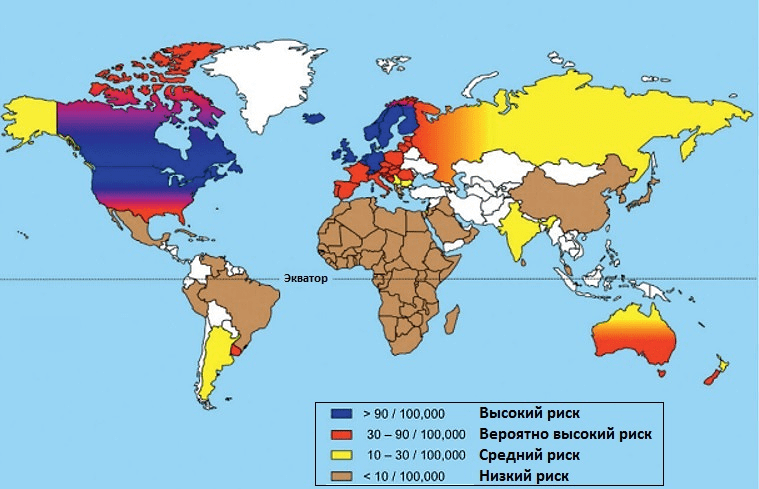
Рисунок 2. Распространенность рассеянного склероза в мирe. Самая высокая заболеваемость РС зафиксирована в Канаде: 291 случай на 100 000 населения. В России частота РС составляет 30–70 случаев на 100 000 населения (зона высокого и среднего риска). Чтобы увидеть рисунок в полном размере, нажмите на него.
Частота РС увеличивается по мере удаления от экватора на север. Чем дальше территория от экватора, тем меньше она получает солнечного света. Под действием ультрафиолетового излучения в коже синтезируется витамин D, который затем превращается в свою активную форму — кальцитриол. Это вещество обладает гормональной активностью и участвует в формировании костной ткани, регуляции клеточного деления и дифференцировки иммунных клеток. Дефицит витамина D сказывается на дифференцировке регуляторных Т-лимфоцитов, сдерживающих иммунный ответ на аутоантигены. Но, хотя низкий уровень витамина D повышает вероятность развития РС [15], это вовсе не означает, что постоянный прием витамина D предотвратит болезнь. Тем не менее у пациентов с РС, получавших этот витамин в качестве пищевой добавки, облегчалось течение болезни [16].
Установлено, что миграция людей из одного географического района в другой влияет на риск развития РС [17]. Иммигранты и их потомки, как правило, «принимают на себя» уровень риска, характерный для нового места жительства, причем, если переселение произошло в раннем детстве, новый риск дает о себе знать сразу, а если это случилось после пубертатного периода, то эффект проявится только в следующем поколении. Предполагают, что этот эффект опосредован изменением уровня гормонов во время полового созревания.
Инфекции. Риск развития РС могут повысить и инфекционные агенты, в первую очередь некоторые вирусы: вирус Эпштейна-Барр (вирус простого герпеса (ВПГ) типа 4), цитомегаловирус (ВПГ типа 5), ВПГ типа 6, некоторые ретро- и полиомавирусы [18]. Особое внимание исследователи уделяют вирусу Эпштейна-Барр [19], [20], [21], вызывающему мононуклеоз. У детей раннего возраста это заболевание, как правило, протекает легко или даже незаметно, в старшем возрасте клинические проявления неспецифичны, а к 40 годам 90% людей уже заражены этим вирусом, но совсем не обязательно из-за него болели. Однажды попав в организм, вирус остается там навсегда. Один из возможных механизмов провокации РС связан с проникновением вируса в ЦНС (в частности, в головной мозг), где он атакует клетки, производящие миелин, — олигодендроциты. Это может вызвать иммунный ответ, при котором CD8+ Т-лимфоциты, атакуя вирус, заодно повреждают олигодендроциты и нейроны «дружеским огнем». Дело тут может быть в молекулярной мимикрии — когда вирус «подделывается» под некоторые белки организма (например, миелин). Однако эта теория всё еще считается спорной.
Кишечный микробиом. Несмотря на то, что кишечный микробиом — не совсем фактор внешней среды, мы рассмотрим его в этом разделе, т.к. изменение его состава из-за внешних обстоятельств может быть связано с возникновением аутоиммунитета. Практически общепризнано, что наш кишечный микробиом активно участвует в развитии иммунной системы и поддержании ее работы [22]. Бактерии, населяющие кишечник, помогают иммунным клеткам распознавать антигены и игнорировать аутоантигены. В исследованиях на модельных животных и человеке показано, что иногда по роковой случайности антигены микроорганизмов пищеварительного тракта, которые для иммунных клеток служат этакими тренажерами по распознаванию бактериальных антигенов, провоцируют запуск аутоиммунных механизмов и прогрессирование демиелинизации [23], [24].
Другие внешние факторы риска — курение и диета. Курение увеличивает как риск возникновения болезни, так и скорость ее прогрессирования, а диета с преобладанием насыщенных/животных жиров может повышать риск возникновения РС. Впрочем, эти результаты пока лучше считать предварительными.
Патогенез рассеянного склероза
Что же происходит внутри организма пациента с РС? В этой статье речь пойдет только о ремиттирующей форме РС (см. ниже), в случае прогрессирующего РС механизмы несколько отличаются [25]. Чтобы лучше понимать изложенные далее молекулярные иммунологические детали, рекомендуем сначала ознакомиться с вводной статьей этого цикла: «Иммунитет: борьба с чужими и... своими» [26].
В какой момент начинается болезнь? Оказывается, несмотря на то что при РС повреждается прежде всего ЦНС, запуск аутоиммунных процессов происходит не в ней [27]. Активация аутореактивных Т- и В-лимфоцитов происходит на периферии — в первую очередь в лимфоузлах.
Откуда в организме аутореактивные лимфоциты?
Аутореактивные лимфоциты обладают повышенным аутоиммунным потенциалом, то есть готовы «палить по своим», уничтожая клетки собственного организма. Они всегда присутствуют в организме здоровых людей, но находятся под строгим контролем иммунной системы. Дело в том, что все Т-лимфоциты проходят «обучение» в тимусе; важной частью этого обучения является так называемая негативная селекция: иммунные клетки, нацеленные на аутоантигены, просто уничтожаются. Смысл этой операции заключается как раз в том, чтобы предотвратить аутоиммунные реакции, но несовершенство механизмов обучения приводит к тому, что часть Т-лимфоцитов, распознающих аутоантигены, всё-таки покидает пределы тимуса и может стать причиной неприятностей.
А теперь поэтапно разберем механизмы развития РС.
Первичная активация лимфоцитов
Для того чтобы аутореактивные лимфоциты смогли добраться до ЦНС, сначала должна произойти их активация вне ЦНС (рис. 3) [28]. Это позволит им преодолеть защитные механизмы головного мозга. Сигналом к первичной активации аутореактивных клеток служит презентация им антигена или аутоантигена антигенпрезентирующими клетками (АПК). Активировать аутореактивные Т- и B-лимфоциты могут бактериальные суперантигены — вещества, которые вызывают массовую неспецифическую активацию. Т-лимфоциты могут активироваться и по механизму молекулярной мимикрии (см. выше), а также собственными антигенами, иммуногенность которых повышена, например, при хроническом воспалении.
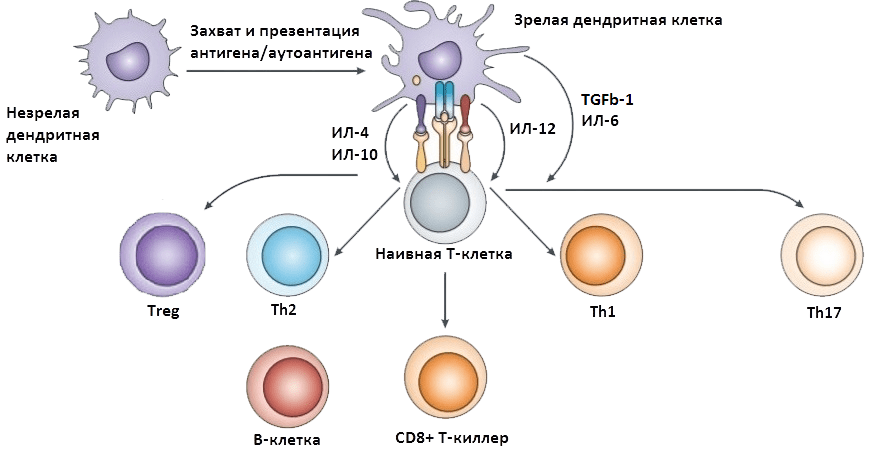
Рисунок 3. Первичная (периферическая) активация иммунных клеток. Незрелая антигенпрезентирующая клетка активируется при встрече с антигеном или аутоантигеном. Это приводит к нарушению баланса цитокинов, поддерживаемого Т-хелперами 2 типа (Th2) и регуляторными Т-клетками (Treg). В условиях повышенной продукции воспалительных цитокинов наивные T-лимфоциты, распознав антиген, дифференцируются под действием интерлейкина-12 (ИЛ-12) предпочтительно в Т-хелперы 1 типа (Th1), а под влиянием ИЛ-6 и трансформирующего ростового фактора бета 1 (transforming growth factor beta 1, TGFb-1) — в Т-хелперы 17 типа (Th17). Th1 вырабатывают интерферон-? и фактор некроза опухоли (ФНОa), а Th17 секретируют ИЛ-17; эти молекулы — мощные воспалительные цитокины. Распознав антиген, под действием ИЛ-12 также активируются CD8+ T-киллеры. При взаимодействии с антигеном или аутоантигеном активированный B-лимфоцит становится источником цитокинов, необходимых для активации патологических Th1 и Th17. Кроме того, из него образуются плазматические клетки, которые секретируют аутоантитела к компонентам миелина. Круг замыкается: активированные аутореактивные Т- и В-лимфоциты сами продуцируют цитокины — мощные индукторы воспаления. При определенных условиях такие клетки обретают способность мигрировать в ЦНС. Чтобы увидеть рисунок в полном размере, нажмите на него.
Активация аутореактивных Т- и B-лимфоцитов приводит к преобладанию патологических клеток над популяциями Тreg и Тh2, поддерживающими иммунологическое равновесие. Патологические клетки создают «воспалительный фон», необходимый для развития аутоиммунного повреждения, и сами приобретают способность воспринимать специальные сигналы, позволяющие им мигрировать в ЦНС, где они смогут нанести свой главный удар.
Отмена привилегий: как аутореактивные лимфоциты проникают в головной мозг
Многочисленные эксперименты показали, что инициировать иммунный ответ в ЦНС гораздо труднее, чем в других структурах тела: головной мозг называют иммунологически привилегированным органом [29]. С аутоантигенами нервной системы история очень интересная: во время обучения в тимусе Т-лимфоциты просто не встречаются с некоторыми из них (включая миелин), а значит, не учатся их распознавать (игнорировать) [30]. Организм так пытается предотвратить развитие иммунного ответа в головном мозге. Кроме того, Т-лимфоциты не способны распознавать аутоантигены здоровой ЦНС, так как в ее клетках синтезируется очень мало молекул главного комплекса гистосовместимости типов I и II, необходимых для презентирования. Еще одна линия защиты головного мозга — гематоэнцефалический барьер (ГЭБ), изолирующий ЦНС от кровеносного русла (рис. 4).
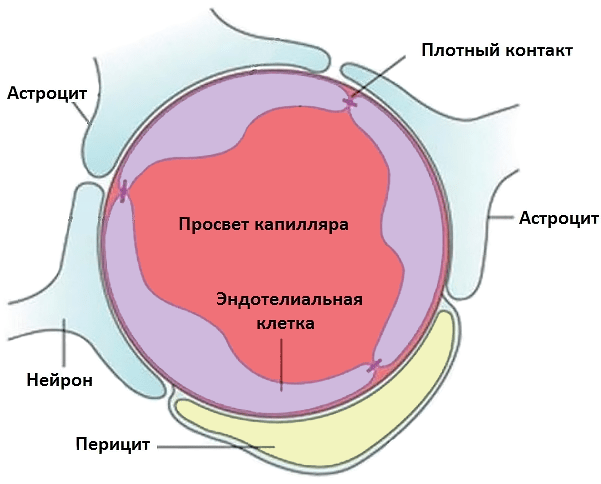
Рисунок 4. Строение капилляра головного мозга и структура гематоэнцефалического барьера. ГЭБ состоит из эндотелиальных клеток, соединенных плотными контактами, в комплексе с перицитами (компоненты сосудистой стенки) и астроцитами со стороны ЦНС. Эта «защитная броня» не пускает в ЦНС ненужные молекулы и иммунные клетки.
Сосуды головного мозга здоровых людей непроницаемы для циркулирующих в крови клеток. Однако некоторые иммунные клетки всё же способны преодолевать ГЭБ. Спинномозговую жидкость (ликвор) от кровеносного русла отделяет гематоликворный барьер. Т-лимфоциты в рамках иммунологического надзора «патрулируют» ликворосодержащие анатомические пространства головного и спинного мозга. Если в ЦНС всё в порядке, клетки уходят обратно в кровеносное русло через сосудистое сплетение. Из этого следует, что изоляция ЦНС не абсолютна.
Следующий (после первичной активации аутореактивных клеток) ключевой этап развития РС — увеличение проницаемости ГЭБ. Под действием воспалительных цитокинов, производимых активированными клетками Th1 и Th17, происходит целая череда роковых событий:
- различные иммунные клетки начинают производить хемокины (цитокины, регулирующие миграцию клеток иммунной системы), которые «созывают» лимфоциты в капилляры головного мозга;
- эндотелиальные клетки производят больше молекул адгезии на своей поверхности, что приводит к «заякориванию» лимфоцитов на стенках сосудов;
- развивающееся воспаление усиливает синтез ферментов (матриксных металлопротеиназ), которые нарушают плотные контакты в эндотелии, в результате чего в ГЭБ появляются бреши, облегчающие массовую миграцию патологических клеток из сосудистого русла в ЦНС.
Вторичная активация лимфоцитов
Итак, активированные Т- и В-лимфоциты, специфичные к компонентам миелина, преодолев ГЭБ, попадают в ЦНС, где во множестве представлены их мишени. В ЦНС миелиновая оболочка аксонов сформирована мембраной специализированных клеток — олигодендроцитов. Их отростки накручиваются на аксон по спирали наподобие изоляционной ленты [3]. С химической точки зрения миелин — это комплекс липидов (70–75%) с белками (25–30%). И именно белки миелина становятся основными аутоантигенами при РС. Активированные на периферии лимфоциты продолжают синтезировать воспалительные цитокины, которые, в свою очередь, активируют резидентные АПК — микроглиальные клетки и астроциты, которые презентируют аутоантигены миелина Т-хелперам, попавшим в ЦНС (рис. 5) [31]. Это и есть сигнал к повторной (вторичной) активации.

Рисунок 5. Основные стадии патогенеза РС. В ЦНС активированные Т- и В-лимфоциты, специфичные к компонентам миелина, наконец встречаются со своими мишенями. Из-за повсеместного воспалительного фона усиливается синтез молекул главного комплекса гистосовместимости, что ведет к активному презентированию CD4+ T-лимфоцитам аутоантигенов миелина. Так запускается повторная (вторичная) активация. Активированные Th1 и Th17 синтезируют воспалительные цитокины, которые активируют микроглию и макрофаги. Последние начинают усиленно поглощать аутоантигены миелина и повторно их презентировать. Кроме того, активированные макрофаги синтезируют активные формы кислорода (O2?) [32], монооксид азота (NO?), глутамат, ФНОa — нейротоксические вещества, напрямую повреждающие миелиновую оболочку. Одновременно с этим В-лимфоциты синтезируют антитела к белкам и липидам миелиновой оболочки. Эти антитела активируют комплекс белков, который называется системой комплемента. В результате образуется мембраноатакующий комплекс, повреждающий миелиновую оболочку. Активированные CD8+ Т-киллеры, специфичные к компонентам миелина, способны напрямую разрушать миелин, усугубляя повреждения в ЦНС. Разбушевавшиеся аутоиммунные процессы ведут к обострению РС. Противоборствуя им, лимфоциты субпопуляций Th2 и Treg продуцируют противовоспалительные цитокины (ИЛ-4, ИЛ-10, TGFb-1), а также факторы ремиелинизации (фактор роста нервов и нейротрофический фактор головного мозга), помогают сдержать аутоиммунное воспаление в ЦНС, давая надежду на выход из обострения и установление ремиссии. Чтобы увидеть рисунок в полном размере, нажмите на него.
Повторно активированные патологические клетки продолжают усиленно вырабатывать воспалительные цитокины, которые подстегивают презентацию аутоантигенов ЦНС. Кроме того, активированные макрофаги синтезируют разнообразные нейротоксические соединения, а В-лимфоциты — антитела к белкам и липидам миелиновой оболочки, повреждающие эту оболочку. В то же время Treg и Тh2 пытаются сохранить иммунологическое равновесие.
Нейродегенерация в центральной нервной системе
Нейродегенерация — это гибель нервных клеток, приводящая в конечном итоге к полной остановке передачи нервного импульса. При РС она развивается независимо от аутоиммунного воспаления [33]. Так, нейровизуализация (магнитно-резонансная томография, МРТ) фиксирует признаки нейродегенерации уже на ранних стадиях болезни.
Существует несколько возможных механизмов, ведущих к нейродегенерации при РС. Один из них — вызываемая глутаматом эксайтотоксичность, приводящая к гибели олигодендроцитов и нейронов. Глутамат — важнейший возбуждающий медиатор ЦНС [34] — сам по себе токсичен, и после того как выполнит свою функцию, должен быстро удаляться. Однако при РС по разным причинам этого не происходит. Более того, активированные T-лимфоциты сами служат источником глутамата. Не удивительно, что в головном мозге пациентов с РС обнаруживают повышенное его содержание.
Еще один механизм связан с перераспределением ионных каналов и изменением их проницаемости в аксонах нейронов, что приводит к нарушению ионного баланса, а для аксона заканчивается повреждением и гибелью.
И наконец, причиной нейродегенерации может стать нарушение баланса факторов ремиелинизации (фактора роста нервов и нейротрофического фактора головного мозга), необходимых для выживания олигодендроцитов и нейронов.
Перечисленные выше процессы могут вести к нейродегенерации, из-за которой нарушается передача нервного импульса и развивается характерная для РС симптоматика.
***
Итак, описанная череда патологических событий приводит к образованию на нервных волокнах участков демиелинизации, гибели олигодендроцитов и нейродегенерации. Снижается скорость передачи нервного импульса от нейрона к нейрону, в результате чего разные системы организма перестают получать сигналы из головного мозга, и возникают симптомы заболевания.
Cимптомы рассеянного склероза и постановка диагноза
То, как именно проявится РС, зависит от места и степени повреждения нервных волокон. Поэтому симптомы РС носят неврологический характер (рис. 6) и неспецифичны. Иными словами, они свойственны и ряду других неврологических патологий, а потому прямо на РС не указывают. Иногда пациенты ретроспективно отмечают эпизод(ы) появления тех или иных симптомов за несколько месяцев/лет до первого обращения к врачу. Некоторые из таких отдаленных симптомов в молодом возрасте зачастую списываются на усталость, последствия простуды и т.д. и не воспринимаются всерьез.
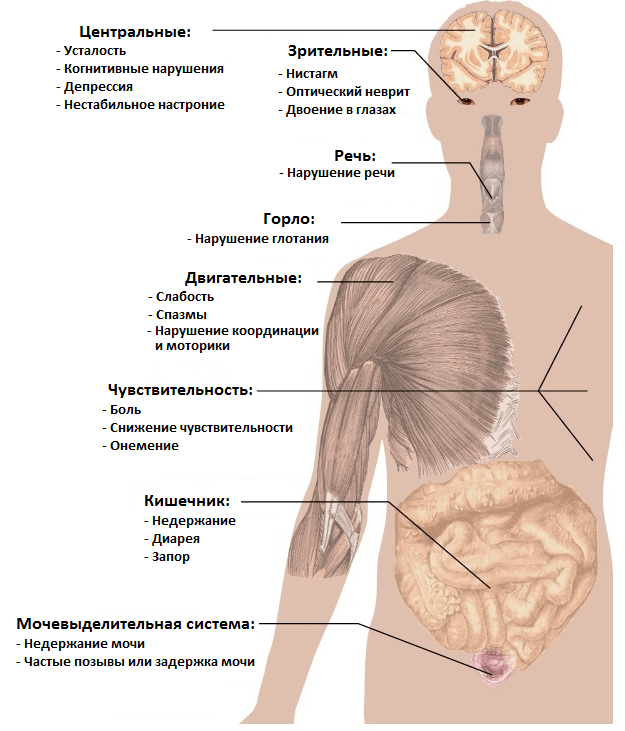
Рисунок 6. Основные симптомы рассеянного склероза.
Диагностика
Диагноз «рассеянный склероз» должен быть доказан. Ни один из симптомов, показателей физикального исследования или лабораторных тестов сам по себе не подтверждает наличие у человека РС. У пациентов с КИС врач может только заподозрить РС. Главный инструмент для постановки диагноза — нейровизуализация. Если в головном мозге пациента с КИС есть очаги демиелинизации (по данным МРТ), такой пациент имеет высокие шансы испытать второй эпизод неврологических симптомов с последующей постановкой диагноза «достоверный рассеянный склероз». Если на снимках пациента с КИС бляшек нет, то вероятность развития РС невелика. Для постановки диагноза «достоверный рассеянный склероз» врачу необходимо одновременно:
- найти признаки демиелинизации по крайней мере в двух разных областях ЦНС (рассеяние в пространстве);
- показать, что бляшки появились с разницей во времени;
- исключить все другие возможные диагнозы.
Таким образом, основным критерием достоверного РС является рассеяние очагов демиелинизации в пространстве и времени. После выявления на томограмме первого очага следующие снимки делают с интервалом 6 месяцев до появления второго очага (рис. 8) и только тогда ставят окончательный диагноз. Согласно ретроспективным оценкам, почти 50% пациентов к моменту постановки диагноза больны уже не менее пяти лет.
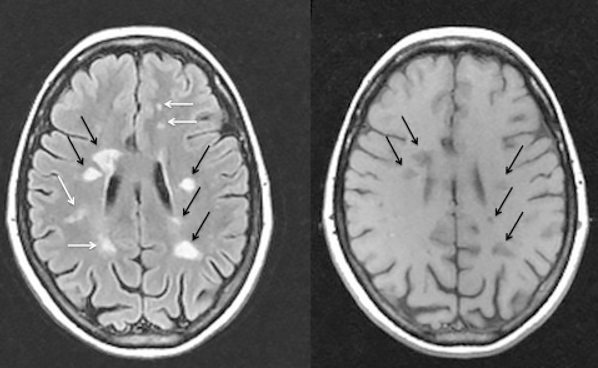
Рисунок 8. Магнитно-резонансные томограммы головного мозга пациента с рассеянным склерозом в разных режимах съемки. Черными и белыми стрелками показаны очаги демиелинизации (бляшки).
Лечение рассеянного склероза
Препараты, изменяющие течение рассеянного склероза
Рассеянный склероз требует пожизненного лечения. Если раньше всё сводилось к симптоматической терапии и попыткам подавить обострения заболевания, то в последние 20 лет, благодаря накопленным знаниям о механизмах развития болезни, появились препараты, изменяющие течение РС (ПИТРС; в англоязычной литературе их называют disease modifying treatments). Все ПИТРС снижают активность аутоиммунного воспаления и замедляют нейродегенерацию (см. врезку); их действие направлено на формирование у пациентов устойчивой и долгой ремиссии. Незамедлительное назначение ПИТРС сразу после постановки диагноза повышает шансы на успешное лечение.
В настоящее время в мире для лечения РС одобрено более 10 ПИТРС (рис. 9) [35]. Все они с разной степенью эффективности и риска возникновения побочных эффектов применяются для лечения ремиттирующей формы РС, некоторые — для лечения вторично-прогрессирующей формы. В марте 2017 года Управление по контролю качества продуктов питания и лекарственных средств США (FDA) одобрило первый препарат для лечения первично-прогрессирующего РС — окрелизумаб (ocrelizumab), эффективность которого была подтверждена клиническими испытаниями [36].
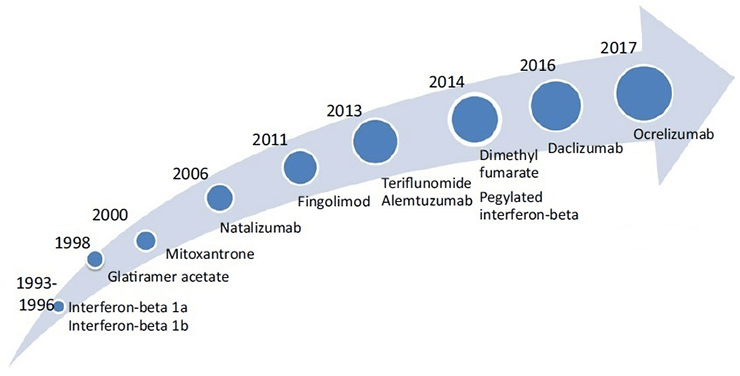
Рисунок 9. Препараты для лечения РС, одобренные FDA и/или EMA (Европейским агентством по лекарственным средствам).
Наиболее безопасными препаратами для лечения РС остаются интерферон-? (ИФН-?) и глатирамера ацетат (ГА), хотя их эффективность сильно варьирует у разных пациентов. Новые лекарства более эффективны, однако чем эффективнее препарат, тем выше вероятность побочных эффектов и развития осложнений.
Новые препараты для лечения рассеянного склероза
Российские исследователи под руководством академика РАН Александра Габибовича Габибова [37] из Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова сейчас разрабатывают новое лекарство для лечения РС, которое уже прошло две фазы клинических испытаний [38]. Препарат создан с использованием липосом — искусственных липидных пузырьков, содержащих специально отобранные фрагменты миелина (пептиды) и адресно доставляющих эти фрагменты в антигенпрезентирующие клетки. По всей видимости, презентирование пептидов из липосом активирует регуляторные клетки, способные подавлять аутоиммунное воспаление в ЦНС. Во второй фазе клинических испытаний новый экспериментальный препарат вводили пациентам с ремиттирующим и вторично-прогрессирующим РС, которым терапия препаратами первой линии не помогла. В результате зафиксировали стабилизацию состояния пациентов, хорошую переносимость и безопасность препарата. Эти многообещающие результаты позволяют надеяться, что в России будет одобрено новое средство для лечения РС.
Другой разрабатываемый подход направлен на активное восстановление поврежденного миелина в ЦНС. На поверхности олигодендроцитов есть белок LINGO-1, который блокирует способность этих клеток дифференцироваться и миелинизировать аксоны. В исследованиях на модельных животных показано, что моноклональные антитела блокируют LINGO-1 и таким образом обеспечивают восстановление миелина. В первой фазе клинических испытаний показана эффективность, безопасность и хорошая переносимость препарата [39]. Иной способ восстановления миелина при РС связан с активацией сигнальных путей, запускающих его синтез. Обеспечение адекватной ремиелинизации, по всей вероятности, станет частью арсенала терапии РС в будущем.
Еще одним кандидатом на роль лекарства является биотин (витамин H), высокие дозы которого, как показывают клинические испытания [40], [41], снижают темпы развития РС. Дело тут в том, что это вещество участвует в регуляции энергетического обмена и синтезе липидов, необходимых для продукции миелина олигодендроцитами. Однако ранее в исследованиях на животных моделях сообщалось о возможном тератогенном эффекте биотина, так что его судьба как лекарства при РС пока не определена.
Лечение рассеянного склероза стволовыми клетками
Аутологичная трансплантация гемопоэтических стволовых клеток
Одним из перспективных подходов к лечению РС считают «перезагрузку» иммунной системы. Идея основана на том, что изменения, приводящие к появлению патологических лимфоцитов, провоцирующих РС, происходят не на уровне стволовых клеток, а гораздо позже, при их дифференцировке. Это значит, что если «перезапустить» процесс, уничтожив опасные лимфоциты и позволив иммунной системе заново восстановить свои клетки, то можно достичь серьезных улучшений.
К сожалению, повлиять на патологические изменения, уже произошедшие в организме пациента с РС, невозможно, но есть шанс затормозить или остановить процесс демиелинизации. Однако перезапуск иммунной системы довольно опасен, так как требует введения в организм потенциально смертельных токсических веществ, уничтожающих все иммунные клетки. После этого пациенту проводят трансплантацию собственных, полученных заранее, гемопоэтических стволовых клеток (дающих начало клеткам крови) [42]. Это должно привести к полному обновлению пула миелоидных и лимфоидных клеток и перенастройкам иммунологической толерантности.
Такой подход, называемый аутологичной трансплантацией гемопоэтических стволовых клеток (АТГСК), изначально был разработан гематологами для лечения лейкозов, но уже достаточно давно исследуется в отношении РС. Пока что АТГСК рассматривают как своего рода крайнюю меру для пациентов с быстро прогрессирующим и не поддающимся терапии РС. Все испытания с участием больных РС проводились на небольших группах, что не позволяет сделать окончательных выводов об эффективности метода. Действительно, бывает так, что успешные результаты, полученные в исследованиях на малой выборке пациентов, не подтверждаются на больших группах. К сожалению, количество случаев успешного восстановления функций организма у пациентов с РС после проведения АТГСК ничтожно мало по сравнению с примерами неэффективного или осложнившегося лечения [43]. Это, однако, не мешает клиникам с сомнительной научной базой и врачам с невысокой квалификацией уже сейчас предлагать больным РС лечение АТГСК.
Клинические исследования АТГСК продолжаются, и за последнее десятилетие достигнут большой прогресс в снижении рисков, связанных с этой процедурой. После окончания рандомизированных контролируемых клинических испытаний можно будет окончательно судить о том, каким пациентам показан этот метод. По мнению экспертов, оценка пользы и риска АТГСК вкупе с доступностью эффективных препаратов моноклональных антител, позволяющих контролировать заболевание у пациентов с тяжелым течением РС, скорее всего, оставит эту пока еще не до конца проработанную технологию резервным методом лечения РС.
Применение индуцированных плюрипотентных стволовых клеток для восстановления структур ЦНС
Другие перспективные разработки для лечения РС основаны на применении индуцированных плюрипотентных стволовых клеток (ИПСК) для замещения погибших олигодендроцитов и нейронов. ИПСК, способные превращаться в разные типы клеток, можно получать с помощью «перепрограммирования», например, клеток кожи пациента. Эти исследования еще только начинаются. Так, недавно успешно завершились эксперименты по пересадке стволовых клеток, полученных из кожи больных РС, в мозг мышей, где они превратились в эффективных продуцентов миелина [44]. В другом исследовании сначала перепрограммировали стволовые клетки кожи мыши в нейронные стволовые клетки, а затем пересадили их в спинной мозг животных с демиелинизацией. В результате состояние животных улучшилось. По-видимому, пересаженные клетки выделяют вещества, стимулирующие процессы репарации ЦНС. Манипуляции со стволовыми клетками пока еще находятся на стадии детального изучения и далеки от внедрения в рутинную клиническую практику [45].
Узнать практически всё об ИПСК, технологиях их получения и рисках применения можно из статей: «Ствол и ветки: стволовые клетки» [46], «Была клетка простая, стала стволовая» [47], «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [48], «В поисках клеток для ИПСК — шаг за шагом к медицине будущего» [49]. — Ред.
***
За последние 20 лет достигнуты огромные успехи в лечении РС. На сегодняшний день, так или иначе, все ПИТРС из арсенала неврологов направлены преимущественно на подавление аутоиммунного воспаления. В ближайшем будущем ожидается одобрение применения в клинической практике первого препарата для лечения первично-прогрессирующего РС. Благодаря клеточным технологиям удалось достичь очень хороших результатов по восстановлению утраченных функций у пациентов с РС. Однако эти случаи пока еще можно назвать единичными, а риск побочных явлений всё еще очень велик.
Можно ли предсказать течение рассеянного склероза и эффективность его лечения?
Вопрос персонализации лечения РС стоит очень остро [50]. Течение болезни невозможно предсказать, основываясь на клинических проявлениях РС. Это осложняет выбор тактики ведения конкретного пациента и создает для последнего дополнительную психологическую нагрузку. Между разными формами РС есть генетические различия, и было найдено несколько генетических маркеров [51], позволяющих предсказывать, насколько тяжело будет протекать РС, но, увы, только в рамках отдельных этносов. Пока что большинство таких исследований в мире не увенчалось успехом.
Кроме того, у разных пациентов ответ на лечение ПИТРС может варьировать: эффективность может быть как высока, так и незаметна вовсе. Дело в том, что физиологические процессы, отвечающие за метаболизм лекарств, находятся под строгим генетическим контролем. Наука, которая изучает связь генетических вариантов с различиями в этих процессах, называется фармакогенетикой [52]. Фармакогенетические исследования проводятся для того, чтобы на основании генотипа конкретного пациента как можно раньше подбирать для него наиболее эффективный препарат. Подобные исследования в отношении РС с определенным успехом проводятся с 2001 года. Найдено несколько генетических маркеров эффективности лечения препаратами ИФН-? и ГА, но для разных этносов они различаются. Например, для «русской» популяции — пациентов славянского происхождения, считающих себя и своих ближайших родственников русскими, — найден комплексный маркер (определенный набор аллелей генов иммунного ответа), у носителей которого лечение препаратами ИФН-? будет с высокой вероятностью эффективным [53]. Найден и маркер, ассоциированный с низкой эффективностью ГА, — таким пациентам, скорее всего, показано назначение альтернативного препарата.
Исследования по поиску универсальных генетических маркеров прогноза течения и лечения РС ведутся под руководством профессоров Ольги Олеговны Фаворовой и Алексея Николаевича Бойко из Российского национального исследовательского медицинского университета им. Н.И. Пирогова [53], [54], [55]. Продолжение таких исследований (особенно с учетом появления новых препаратов) с привлечением тысяч пациентов из различных этнических групп может привести к созданию прогностических тестов. Это позволило бы врачу быть начеку и заранее определиться с тактикой ведения конкретного пациента.
Пациентские организации
Клинические проявления заболевания — далеко не единственное, с чем приходится бороться пациенту. Это всегда еще и страх, одиночество, чувство отчуждения и изоляции. Деятельность пациентских организаций необходима для информационной поддержки, защиты прав и интересов пациентов, решения проблем с лечением и социальной реабилитацией пациентов и членов их семей. Общероссийская общественная организация инвалидов — больных рассеянным склерозом является самой крупной российской пациентской организацией для страдающих РС. Своей главной целью она называет создание условий для повышения качества жизни граждан Российской Федерации с РС. Действительно, на своем сайте организация регулярно публикует фотоотчеты о социальных мероприятиях в разных городах России и поднимает важные вопросы, касающиеся качества жизни больных РС: там можно найти, например, обращение к министру здравоохранения с просьбой включить диметилфумарат в список жизненно необходимых лекарств.
На Информационном портале о рассеянном склерозе, созданном при поддержке фармацевтической компании Teva (производитель глатирамера ацетата), можно оставить заявку на получение психологической поддержки по телефону и письменной консультации квалифицированного юриста. На сайте есть информация о возможностях реабилитации, интервью и личные истории пациентов с РС, новости о культурных событиях Москвы.
Московское общество рассеянного склероза недавно запустило бесплатную программу реабилитации для пациентов с РС. Организованы регулярные групповые занятия йогой и лечебной физкультурой по специально разработанным методикам. Кроме того, при поддержке компании Teva создана «Карта доступности» московских медицинских, социальных, спортивных, культурных и развлекательных объектов, оборудованных для людей с ограниченной подвижностью.
На сайтах российских пациентских организаций, к сожалению, очень мало материалов, которые позволили бы больному РС узнать актуальную информацию о своем заболевании: причинах его развития, диагностике и современных методах лечения. На зарубежных пациентских порталах такая информация изложена доступным языком и очень хорошо систематизирована, там постоянно обновляются разделы о научных исследованиях в области РС. На сайтах пациентских организаций разных стран очень часто встречается информация о текущих клинических испытаниях новых препаратов и возможности зарегистрироваться для участия в них. Ниже перечислены основные англоязычные организации пациентов с РС:
- Великобритания: Multiple Sclerosis Society of Great Britain, Multiple sclerosis trust;
- Австралия: National Multiple Sclerosis Society of Australia;
- Канада: Multiple Sclerosis Society of Canada;
- США: National multiple sclerosis society, Multiple Sclerosis Association of America;
- Новая Зеландия: Multiple sclerosis. Society of New Zealand.
Сейчас большинство больных РС при условии своевременного и правильно подобранного лечения могут жить полной жизнью. Люди, находясь практически в любой точке земного шара, каждый день остаются в контакте друг с другом, находят друг у друга поддержку и понимание. Страница Ирины Ясиной на Фейсбуке обновляется практически каждый день. Можно только восхищаться тем, насколько активный образ жизни ведет автор, рассказывая о путешествиях, впечатлениях, делясь восприятием разных событий, оставаясь при этом открытой своей аудитории, а иногда и поддерживая ее. Решение о том, насколько использовать собственные возможности и участвовать в жизни общества, быть ли счастливыми и свободными, всегда зависит только от нас самих.
Источник: biomolecula.ru