Мы — Иные... Клеточный атипизм
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
Архив новостей
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Нейронные сети начинающим
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2020-01-12 17:45

Отсюда мораль: всякому овощу свое время. Или если сказать попроще… Никогда не думай, что ты иная, чем могла бы не быть иначе, чем будучи иной в тех случаях, когда иначе нельзя не быть.
Льюис Кэрролл, «Алиса в стране чудес»
Злокачественная трансформация клеток опосредована генетическими нарушениями. Опухолевые клетки приобретают особый, отличный от нормальных клеток фенотип, на выявлении которого основана морфологическая верификация онкологического диагноза.
Архитектурные перестройки в опухолевой ткани отмечаются на разных уровнях организации. Глобальные изменения, такие как нарушение соотношения паренхимы и стромы, изменение величины и формы тканевых структур, представляют явление тканевого атипизма. Но помимо масштабных нарушений, при «строительстве» опухоли используются и неправильные, атипичные «кирпичи»-клетки. Характерный комплекс цитологических критериев злокачественности формирует клеточный атипизм — одно из фундаментальных понятий в онкоморфологии. Для максимальной объективизации анализа материального субстрата патологического процесса используются критериальные системы оценивания, способствующие унификации, и, следовательно, упрощению исследования. У патоморфолога складывается «образ злокачественной клетки» — некая визуальная форма, достаточно яркая для быстрой идентификации. Рассмотрим на светооптическом уровне штрихи (критерии), из которых складывается этот образ.
1. Клетка:
- Увеличение размеров атипичных клеток, по сравнению с нормальными клетками ткани, вплоть до гигантских размеров; но это необязательный признак;
- Изменение формы клеток, вплоть до самых причудливых. В опухолевой массе может отмечаться как выраженный клеточный полиморфизм (различие размеров и формы), так и, напротив, упрощение строения — мономорфность (наблюдается в низкодифференцированных мезенхимальных опухолях);
- Нарушение ядерно-цитоплазматического соотношения (за счет увеличения ядра);
- Наличие многоядерных клеток с отчетливым ядерным полиморфизмом;
- Атипичная локализация ядра;
- Диссоциация в созревании ядра и цитоплазмы (молодое ядро в зрелой клетке, зрелое ядро в незрелой цитоплазме) [1].
2. Ядро:
- Увеличение размера;
- Изменение формы, ядерный полиморфизм;
- Контур ядра неправильный, неравномерно извилистый, иногда с глубокими вырезками, грубо очерчен;
- Нарушение строения ядерной мембраны: неравномерно утолщена, отмечаются разрывы [1, 2].
- Патология митотического режима. Митотический режим — это комплекс параметров, характеризующих различные аспекты митоза. Например, митотический индекс — процент делящихся клеток от всей популяции — показатель, который отражает митотическую активность; структура митотически активных клеток — процентное соотношение делящихся клеток, находящихся на разных стадиях митоза; относительное количество всех патологических митозов; процентное содержание отдельных видов патологических митозов.
Спектр патологии митоза крайне широк. Но отмечаются некоторые характерные особенности. В частности, под ударом при злокачественной трансформации оказывается метафаза. Отмечается проявление колхицинового митоза, или К-митоза (форма патологического митоза с торможением процесса в результате инактивации веретена деления под действием статокинетических ядов, к которым относится в т. ч. и колхицин), а именно — К-метафаза. Для нее характерны слипание или рассеивание гиперспирализованных хромосом, отставание хромосом и их фрагментов в метафазе. Встречаются трехгрупповые метафазы, при которых, помимо основной экваториальной пластинки, присутствуют еще две группы в области полюсов деления клетки. Возможны метафазы с рассеиванием и массовой фрагментацией хромосом, ассиметричные, многополюсные и моноцентрические митозы [3].
3. Ядрышки:
- Визуализируются при исследовании;
- Увеличены в размерах;
- Форма неправильная, нередко полиморфизм;
- Увеличение количества ядрышек.
4. Хроматин:
- Различные паттерны: нарушение распределения, соотношения эу- и гетерохроматина;
- Крупнозернистый, грубый (часто отмечается в различных опухолях);
- Тонкий, мелкодисперсный, нежный, бластный (например, при остром миелобластном лейкозе);
- Неравномерность распределения: мелкозернистый, сетчатый или мелкоглыбчатый (например, при гранулезоклеточных опухолях яичников);
- Высокая интенсивность окрашивания (гиперхромия) [4].
Выраженность цито- и гистологических нарушений увеличивается с ростом степени злокачественности.
Патологическая анатомия немыслима без визуализации информации, поэтому представим процесс озлокачествления клеток на конкретном примере. В доставленном материале — фрагмент ткани мочевого пузыря. В нормальных условиях уротелиальные клетки относительно мономорфны, содержат достаточный объем цитоплазмы и овальные ядра, имеют округлые гладкие контуры, нежный хроматин, мелкие или вовсе невидимые ядрышки (рис. 1) [5]..
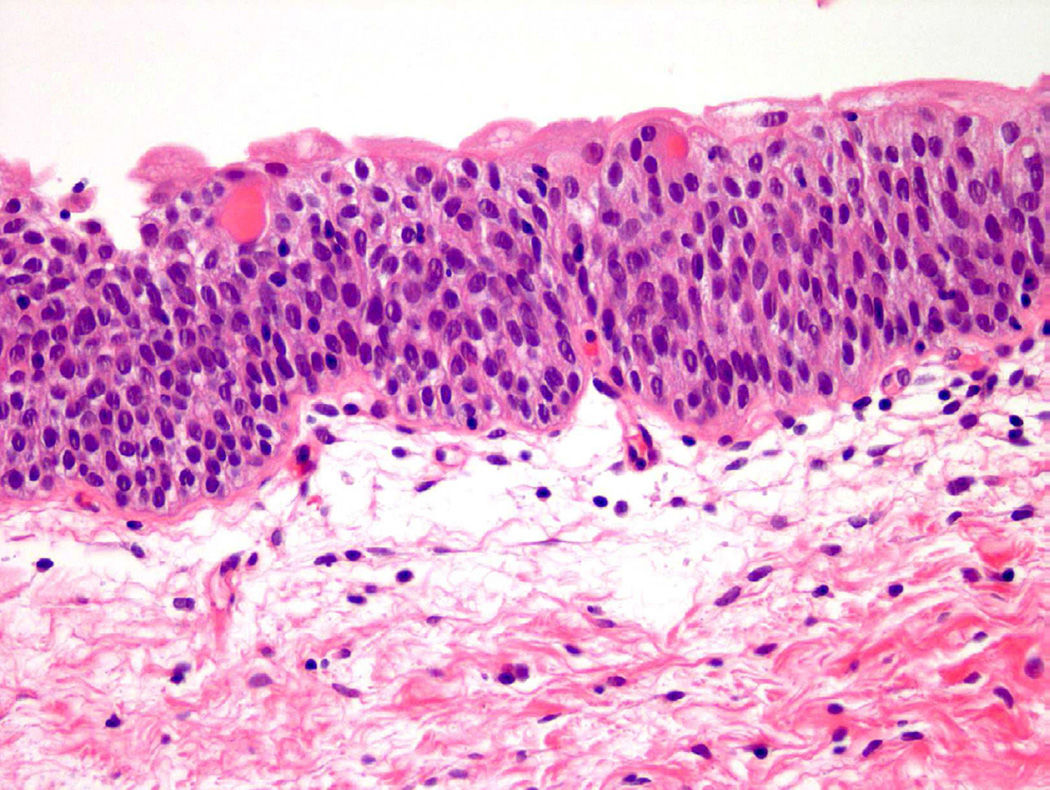
Рисунок 1 | Микроскопическая картина нормального уротелия [5]
Определимся с относительностью мономорфности клеток. Даже нормальным уротелиальным клеткам «разрешено» иметь определенные вариации в размерах. Особенно это характерно для самого поверхностного (апикального) слоя уротелия, который находится в постоянном контакте с содержимым мочевого тракта. Он представлен крупными зонтичными клетками с обильной эозинофильной цитоплазмой. Их наличие служит одним из критериев злокачественности уротелиальной карциномы. В опухолях High Grade (высокой степени злокачественности) они не определяются. Но в то же время физиологический фактор — растяжение мочевого пузыря — может привести к уплощению поверхностных зонтичных клеток до такой степени, что слой может быть трудно определить микроскопически, что дополнительно затрудняет морфологическую диагностику [6].
Несмотря на большое разнообразие морфологии нормальных уротелиальных клеток, определены специфические особенности, указывающие на атипию. Информативны не поверхностные и не дегенеративные уротелиальные клетки. Основной маркер — увеличение ядерно-цитоплазматического соотношения (более 0,5) [5]. Дополнительные критерии: гиперхромия, неравномерный, грубый хроматин, неравномерный контур ядра. Если ядерно-цитоплазматическое соотношение более 0,7 и присутствуют два дополнительных признака, необходимо заподозрить уротелиальную карциному высокой степени злокачественности (рис. 2) [6]..
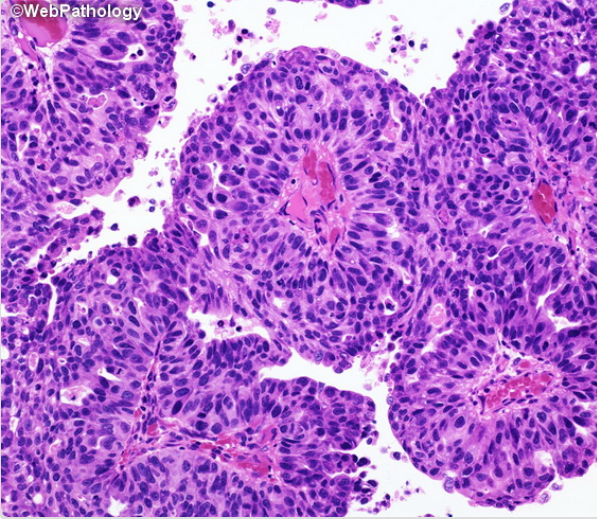
Рисунок 2 | Папиллярная уротелиальная карцинома High Grade
Выраженная тканевая и клеточная атипия. Внутри папиллярных структур опухолевые клетки расположены хаотично, с утратой полярности. Значительный полиморфизм ядер, гиперхромность, отчетливые ядрышки. Митотическая активность увеличивается, фигуры митоза отмечаются во всех слоях уротелия. Единичные очаги некроза [8].
Цитологические критерии уротелиальной карциномы высокой степени злокачественности: высокое ядерно-цитоплазматическое соотношение, неравномерный контур мембран ядер, эксцентрическая локализация ядра, крупные, полиморфные ядра, выраженные ядрышки (рис. 3.1, 3.2) [7], могут обнаруживаться признаки плоскоклеточной и железистой дифференцировки (рис. 4) [8]..
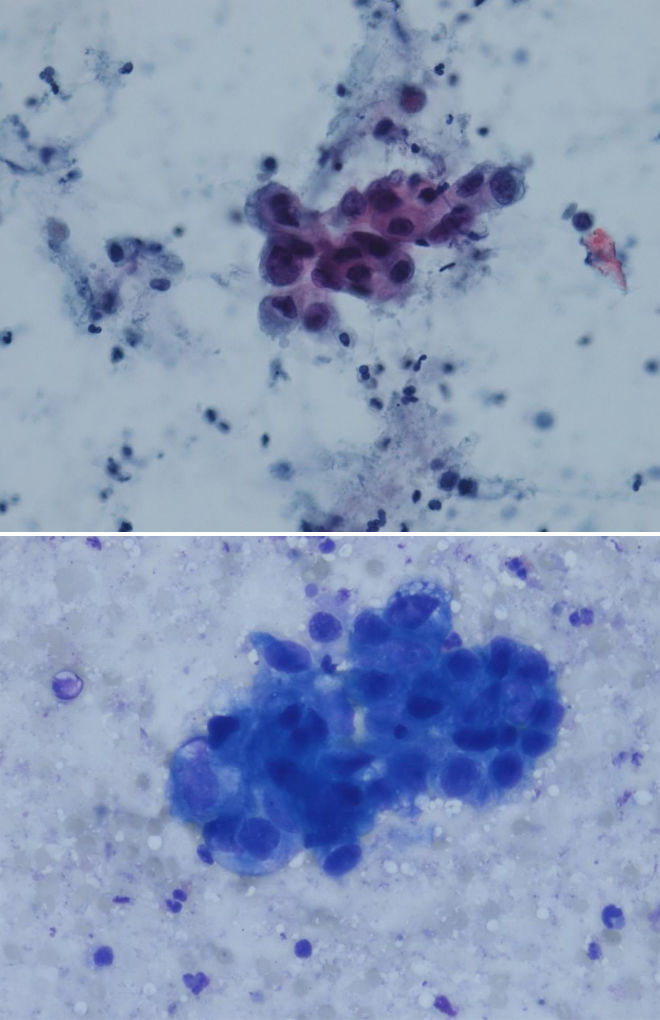
Рисунки 3.1 и 3.2 | Папиллярная уротелиальная карцинома High Grade
Крупные ядра с высоким ядерно-цитоплазматическим соотношением, грубый хроматин и нечеткие, размытые контуры ядра (окраска Papanicolaou и DiffQuik) [9]..
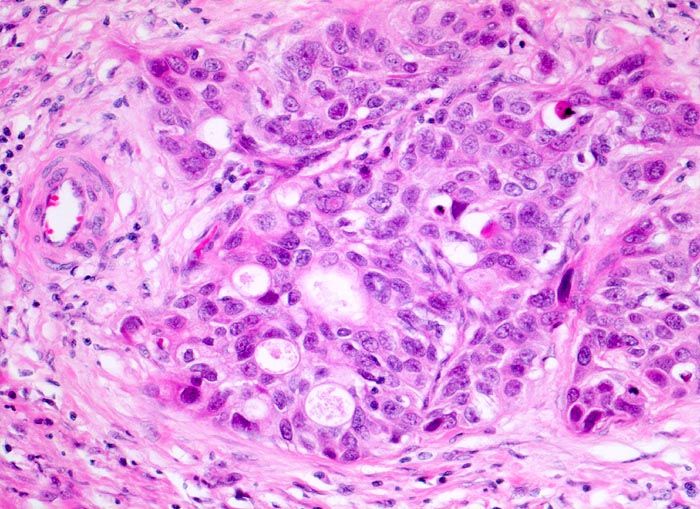
Рисунок 4 | Папиллярная уротелиальная карцинома High Grade с формированием железистых структур [10]
Фундаментальное понимание явления атипизма как отличия от нормы может рассматриваться в различных аспектах. Помимо морфологического атипизма, в опухолевой клетке наблюдается антигенный, функциональный, метаболический атипизм. Морфологию, в свою очередь, можно рассматривать на уровне электронной микроскопии, анализируя ультраструктуры клетки (патологию рибосом, митохондрий, мембранных структур, компонентов цитоскелета и т. д.). В рутинной практике большее значение имеет все же светооптический уровень исследования. Для снижения доли субъективизма в определении различных степеней «атипичности» в доставленном материале требуются как четкие критерии каждого этапа анапластических изменений, так и внедрение систем анализа изображений.
Источники:
- Liu J. The "life code": A theory that unifies the human life cycle and the origin of human tumors. Semin Cancer Biol. 2019; pii:S1044-579X(19)30053-7.
- Niu N., Mercado-Uribe I., Liu J. Dedifferentiation into blastomere-like cancer stem cells via formation of polyploid giant cancer cells. Oncogene. 2017;36(34):4887-4900.
- Orr B., Maiato H. No chromosome left behind: The importance of metaphase alignment for mitotic fidelity. J Cell Biol. 2019;218(4):1086–1088.
- Taipale J.The chromatin of cancer. Science. 2018;362(6413): 401-402.
- Sanfrancesco J., Jones J.S., Hansel D.E. Diagnostically challenging cases: what are atypia and dysplasia? Urol Clin North Am. 2013;40(2):281–293.
- Comp?rat E.M. et al. Grading of Urothelial Carcinoma and The New "World Health Organisation Classification of Tumours of the Urinary System and Male Genital Organs 2016". Eur Urol Focus. 2019;5(3):457-466.
- Tan T.Z., Rouanne M., Tan K.T., Huang R.Y., Thiery J.P. Molecular Subtypes of Urothelial Bladder Cancer: Results from a Meta-cohort Analysis of 2411 Tumors. Eur Urol. 2019;75(3):423-432.
- Изображение предоставлено Dharam М. Ramnani, MD; база электронных изображений WebPathology;
- Изображение предоставлено Nicole K. Andeen, M.D. и Maria Tretiakova, M.D;
- База электронных изображений the University of Basel;
Источник: medach.pro