Патофизиологические основы терапии рассеянного склероза
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-08-28 01:00

Рассеянный склероз (РС) — хроническое прогрессирующее заболевание центральной нервной системы с многоочаговой неврологической симптоматикой. Традиционно РС считается патологией белого вещества, однако очаги демиелинизации встречаются во всех отделах ЦНС, включая серое вещество коры и подкорковых ядер. Тяжесть течения и высокая степень инвалидизации определяется тремя основными компонентами: аутоиммунным (активация аутореактивных Т- и В-лимфоцитов), демиелинизирующим (деструкция миелина, обеспечивающего защиту аксонов и высокую скорость проведения нервного импульса), нейродегенеративным (гибель нервных волокон).
В клинической картине периоды обострений (появление новой неврологической симптоматики, выявляемой при клиническом обследовании, или усиление имевшихся ранее симптомов, продолжающееся более 24 часов) могут чередоваться с периодами ремиссии (отсутствие новой неврологической симптоматики) — такая волнообразная форма называется ремиттирующей. Далее она переходит во вторично-прогрессирующую форму с постоянным нарастанием тяжести симптомов. У 10–15 % пациентов наблюдается первично-прогрессирующая форма РС, при которой степень инвалидизации непрерывно увеличивается с момента дебюта заболевания без периодов острых обострений и угасания симптоматики [1].
Сложность основных патогенетических механизмов, отсутствие репрезентативных исследовательских моделей и противоречивые критерии, определяющие терапевтическую пользу, являются основными причинами, по которым эффективная терапия прогрессирующих форм РС все еще отсутствует.
Основа патогенеза РС — хроническое воспаление, которое возникает за пределами гематоэнцефалического барьера, с активацией микроглии и нарастающим вовлечением Т- и В-лимфоцитов. Постоянное высвобождение активных форм кислорода (АФК) и азота (АФА) обусловливает повреждение митохондрий в нейронах и глиальных клетках. Нарастает дефицит энергии, что в конечном итоге приводит к нейродегенерации. Более того, нервные волокна, лишенные миелина, изменяют спектр ионных каналов, что также способствует дегенеративным изменениям. Поддержание воспалительной активности нарушает ремиелинизацию, что усугубляет повреждение нервных волокон [2].
В настоящее время появляются новые стратегии лечения РС, которые нацелены на стимулирование иммунных реакций, предотвращение гибели нервных клеток (нейродегенерации), а также восстановление миелиновой оболочки аксонов (рис.1) [3]..
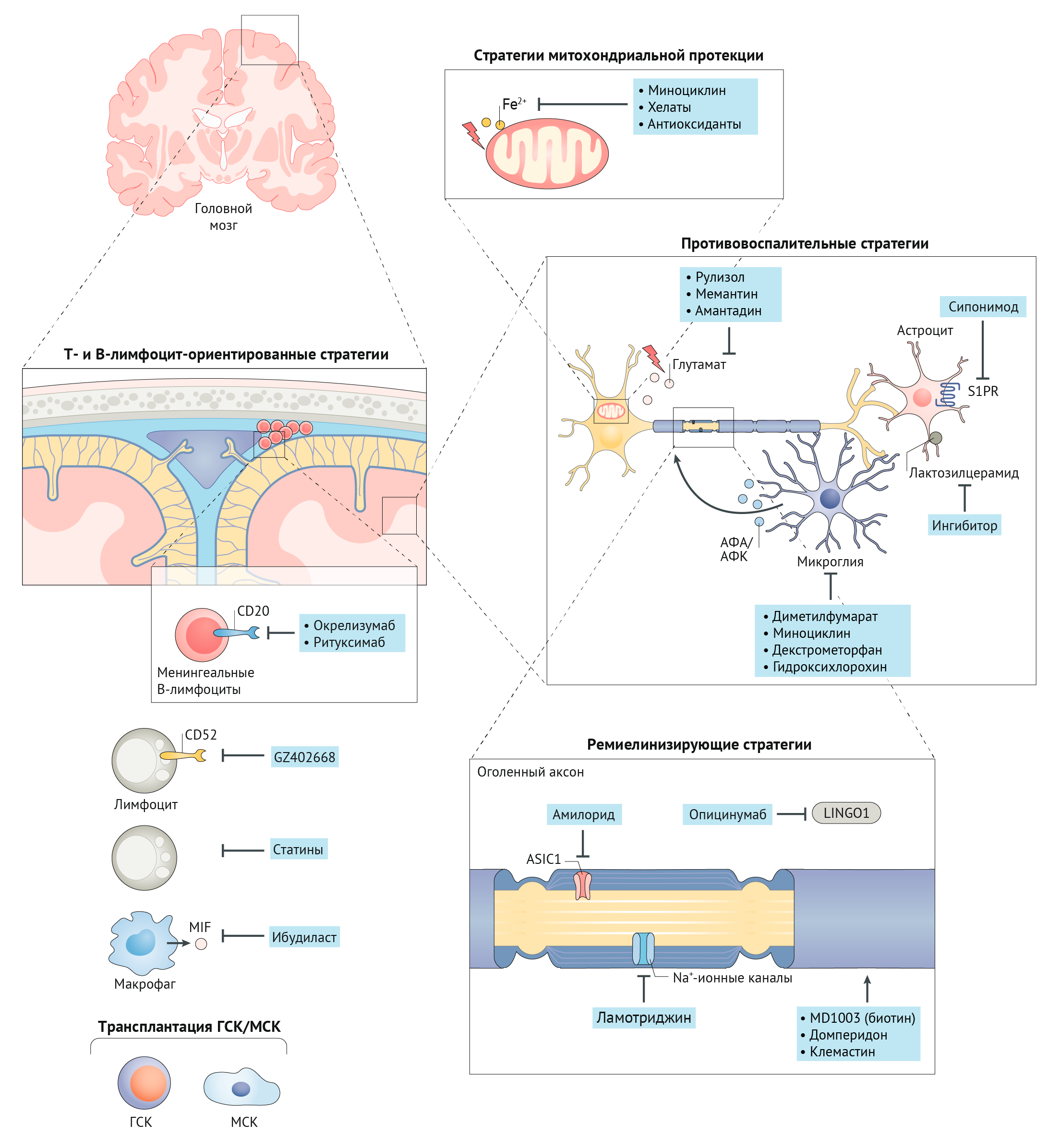
Рисунок 1. Подходы к терапии прогрессирующих форм рассеянного склероза
Стратегии митохондриальной протекции:
— использование миноциклина (полусинтетический антибиотик группы тетрациклинов),
— применение хелатообразующих соединений, связывающих ионы железа Fe2+ (дефероксамин, деферипрон и деферазирокс);
— использование антиоксидантов, уменьшающих окислительный стресс. Противовоспалительные стратегии, нацеленные на микроглию и астроциты:
— селективный модулятор рецептора сфингозин-1-фосфата (S1PR) сипонимод, который лицензирован Управлением по контролю за качеством пищевых продуктов и медикаментов (FDA) США в качестве терапии для вторично-прогрессирующего рассеянного склероза (ВПРС);
— ингибиторы иммунной клеточной активности микроглии: диметилфумарат, миноциклин, декстрометорфан и гидроксихлорохин, АФА (активные формы азота), АФК (активные формы кислорода). Аксон-протективные стратегии, основанные на регуляции работы протон-активируемых ионных каналов:
— амилорид (калий-сберегающий диуретик) блокирует кислоточувствительный канал 1 (ASIC1), активность которого повышена в аксонах и олигодендроцитах пораженных участков;
— ламотриджин (блокирует натриевые каналы). Ремиелинирующая терапия:
— опицинумаб — полностью человеческое моноклональное антитело, блокирующее нейрональный белок 1, содержащий иммуноглобулиноподобный домен и богатые лейцином повторы, LINGO1 (в активном состоянии этот белок ингибирует дифференцировку олигодендроцитов и их способность к миелинизации аксонов);
— домперидон (повышает уровень пролактина);
— клемастин (антигистаминный препарат первого поколения, блокирует мускариновые рецепторы);
— MD1003 (биотин, витамин Н) в высоких дозах способствует ремиелинизации, благодаря своей функции кофермента для карбоксилаз, необходимых для синтеза миелиновых липидов. Т- и В-лимфоцит-ориентированные стратегии:
— окрелизумаб — препарат на основе гуманизированных моноклональных антител к CD20 на поверхности В-лимфоцитов (одобрен для терапии первичного прогрессирующего рассеянного склероза, ППРС);
— ритуксимаб;
— препарат нового поколения анти-CD52-гуманизированных моноклональных антител GZ 402668;
— ибудиласт — ингибитор фосфодиэстеразы и фактора, ингибирующего миграцию макрофагов (MIF). Трансплантация стволовых клеток:
— гемопоэтических стволовых клеток (ГСК);
— мезенхимальных стволовых клеток (МСК);
Обеспечивает иммуномодуляцию и нейропротекцию (влияние на дифференцировку нейральных клеток-предшественников) [3].
Таргетирование нейровоспалительных процессов
Воспалительный компонент при прогрессирующих формах РС отличается от такового при ремиттирующем течении. Клеточный инфильтрат паренхимы ЦНС при прогрессирующем заболевании в меньшей степени представлен Т-клетками. При этом они накапливаются в мягкой мозговой оболочке. Основная популяция клеток воспалительного инфильтрата в ЦНС — моноциты, которые далее дифференцируются в макрофаги, опосредуя локальную активацию микроглии с нарастанием деструкции нервной ткани [3].
Контроль популяции Т-лимфоцитов при прогрессирующем РС остается сложным вопросом. Основным направлением является использование моноклональных антител. Например, в клиническом исследовании фазы III ASCEND применение натализумаба — селективного ингибитора молекул адгезии, связывающегося с ?4-субъединицей человеческого интегрина, не привело к снижению инвалидизации (по сравнению с группой плацебо) у пациентов с вторично-прогрессирующим РС.
При прогрессирующем рассеянном склерозе отмечается противовоспалительное действие статинов. Симвастатин способствует трансформации провоспалительного фенотипа Т-хелперов 1 (Th1) в противовоспалительный фенотип Th2. Также отмечалось снижение популяции Тh1 и Th17 и ингибирование перехода Тh17 в CD4+ Т-лимфоциты (потенциально агрессивные к антигенам миелина) in vitro [3]. Показано, что терапия статинами уменьшает атрофию белого вещества при прогрессирующем течении [4], но не оказывает значимого влияния при наличии в клинической картине острых симптомов: согласно данным Кокрановского обзора, комбинация симвастатина или аторвастатина с интерфероном не снижала частоту рецидивов, скорость прогрессирования заболевания или развитие МРТ-признаков активности воспалительного процесса [5].
Трансплантация стволовых клеток рассматривается как «перезагрузка» собственной иммунной системы. Формирование клонов патологических лимфоцитов происходит не на уровне полипотентных стволовых клеток, а при их дальнейшей дифференцировке. Иммуносупрессия с помощью высокодозной химиотерапии позволяет использовать клетку-предшественницу для нового пула здоровых лимфоцитов. Также используются стволовые клетки мезенхимального происхождения. Они имеют выраженное иммуномодулирующее действие. На фоне ингибирования Т-клеточного ответа, снижения экспрессии CD4+-активационных маркеров, CD25+, CD38+, CD69 и Т-клеточной активации наблюдается увеличение популяции Т-reg, ограничение пролиферации В-лимфоцитов и подавление продукции интерферона, интерлейкинов 4 и 10 [6].
Таргетирование В-лимфоцитов
При аутопсийном исследовании пациентов с вторично-прогрессирующими формами РС в образцах ткани мозговых оболочек обнаружена выраженная воспалительная инфильтрация с примесью большого количества В-клеток, на отдельных участках формирующих эктопичные лимфоидные фолликулы [7]. Наличие менингеальных В-клеток сочетается с субпиальной демиелинизацией серого вещества и микроглиальной активностью в корковых структурах [8].
Для контроля В-клеточной популяции используются моноклональные антитела. При использовании ритуксимаба (анти-CD20 антитело) отмечалось истощение очагов инфильтрации периферических В-лимфоцитов при интратекальном введении и при комбинации его с внутривенным [9].
Комбинированной активностью обладают анти-CD52 антитела, которые воздействуют как на Т-, так и на В-лимфоциты. Помимо применяемого в настоящее время алемтузумаба, к препаратам этой группы относится GZ402668. Это вещество связывается с различными эпитопами CD52, позволяя также уменьшить уровни фактора некроза опухоли и интерферона-? [10].
Таргетирование миелоидо-микроглиальной активности
Эта группа клеток является основным поставщиком активных форм кислорода и азота, провоспалительных цитокинов и хемокинов. К ингибиторам макрофаго-микроглиальной активности относятся гидроксихлорохин — противомалярийное лекарственное средство, которое блокирует липополисахарид-индуцированную продукцию провоспалительных цитокинов в микроглии. Соединение MIS416 создано при помощи методов биоинженерии и содержит два встречающихся в природе лиганда — нуклеотид-связывающий домен олигомеризации, включающий белок 2 (NOD2) и толл-подобный рецептор 9 (TLR9). Они взаимодействуют с цитозольными рецепторами миелоидных клеток, активируя сигнальные каскады, стимулирующие низкую выработку воспалительных цитокинов. [11].
Также отмечена активность препарата ибудиласт. Это неселективный ингибитор фосфодиэстераз 3, 4, 10 и 11, функциональный антагонист TLR4, блокатор фактора ингибирования миграции макрофагов (MIF). Ибудиласт обладает способностью ослаблять активность активированных глиальных клеток, смещая цитокиновый баланс в противовоспалительную сторону [12].
Для воздействия на агрессивные формы кислорода оправдано использование различных веществ с антиоксидантной активностью, например, липоевой кислоты или диметилфумарата, который обладает цитопротекторным действием. Также оправдывают себя стратегии антицитокиновой терапии [3].
Астроциты вносят большой вклад в поддержание хронического воспаления. Это наиболее распространенная популяция клеток в ЦНС, играющая значительную роль в патофизиологии РС из-за стимулирования склеротических процессов и высвобождения медиаторов воспаления. Для перехода нормальных астроцитов на «темную сторону» они должны быть активированы (А1). Такая «вербовка» осуществляется микроглиальной секрецией интерлейкинов, фактора некроза опухоли и комплемента C1q. В астроцитах гликосфинголипид лактозилцерамид способен стимулировать синтез хемокиновых фрагментов и гранулоцит-макрофаг-колониестимулирующего фактора, что поддерживает патологическую активность микроглии и макрофагов. Ингибирование лактозилцерамида ассоциировалось со снижением нейродегенерации.
Альтернативным методом воздействия на астроциты является модуляция плейотропного сфинголипидного медиатора сфингозин-1-фосфата (S1P). Этот биоактивный лизофосфолипид также регулирует циркуляцию лимфоцитов в крови и, в частности, выход Т- и В-клеток из лимфатических узлов. Для ремиттирующих форм подтверждена эффективность финголимода, подавляющего функцию S1P-рецепторов в лимфоцитах, что замедляет выход лимфоцитов из лимфатических узлов. Это в свою очередь снижает рециркуляцию Т-клеток в ЦНС, ограничивая воспаление и, соответственно, степень повреждения нервной ткани [13]. При вторично-прогрессирующем РС в снижении скорости инвалидизации отмечена эффективность сипонимода — селективного модулятора рецептора сфингозин-1-фосфата [14].
Обеспечение нейропротекции является ключевой задачей для уменьшения дегенерации аксонов и гибели нейронов. Основными целями нейропротективной терапии служат нормализация гомеостаза железа в мозговой ткани, регуляция экспрессии ионных каналов и коррекция повреждения митохондрий (рис. 1) [3].
Необходимо отметить, что одна из проблем выбора терапии прогрессирующего рассеянного склероза заключается в непоследовательных критериях эффективности, используемых в разных клинических исследованиях. Зачастую исследования опираются на различные цели, что означает, что терапевтический успех понимается и оценивается индивидуально в каждом отдельном случае. В идеале должны применяться единые критерии для сопоставимости результатов и обеспечения их достоверности.
Источники:
- Lassmann H. Pathogenic mechanisms associated with different clinical courses of multiple sclerosis. Front- Immxxnol.2018; 9: 3116.
- Reich D. S., Lucchinetti C. F., Calabresi P. A. Multiple sclerosis. N- Engl- J- Med. 2018;378:169–180.
- Faissner S., Plemel J.R., Gold R., Yong V.W. Progressive multiple sclerosis: from pathophysiology to therapeutic strategies. Nat Rev Drug Discov. 2019 [Epub ahead of print].
- Chataway J. et al. Effect of high-dose simvastatin on brain atrophy and disability in secondary progressive multiple sclerosis (MS-STAT): a randomised, placebo- controlled, phase 2 trial. Lancet. 2014;383:2213–2221.
- Wang J.et al.. Statins for multiple sclerosis. Cochrane Database Syst- Res. 2011;12: CD008386.
- Muraro P. A. et al. Long-term outcomes after autologous hematopoietic stem cell transplantation for multiple sclerosis. JAMA Nexxrol.2017;74:459–469.
- Magliozzi R. et al. B-cell enrichment and Epstein-Barr virus infection in inflammatory cortical lesions in secondary progressive multiple sclerosis. J- Nexxropathol- Exp- Nexxrol. 2013;72:29–41.
- Choi S. R. et al. Meningeal inflammation plays a role in the pathology of primary progressive multiple sclerosis. Brain. 2012;135:2925–2937.
- Naegelin Y. et al. Association of rituximab treatment with disability progression among patients with secondary progressive multiple sclerosis. JAMA Nexxrol.2019;76:274-281.
- Siders W. et al. GZ402668, a next-generation anti-CD52 antibody, displays decreased
proinflammatory cytokine release in vitro. Nexxrology;86 (Suppl. 16): P3.068. - White M. et al. Targeting innate receptors with MIS416 reshapes Th responses and suppresses CNS disease in a mouse model of multiple sclerosis. MLRWS RWNE. 2014;9:e87712.
- Cho Y. et al. Allosteric inhibition of macrophage migration inhibitory factor revealed by ibudilast. Mroc- Natl Acad- Sci- USA. 2010;2010107:11313–11318.
- Bigaud M. et al. Second generation S1P pathway modulators: research strategies and clinical developments. Biochim- Biophys- Acta. 2014;1841:745–758.
- Kappos L.et al.EXPAND Clinical Investigators. Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): a double-blind, randomised, phase 3 study. Lancet. 2018;391(10127):1263-1273.
Источник: medach.pro