Митохондриальный консенсус клеточной смерти
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2019-07-06 13:45

Митохондрия — центральный игрок апоптоза, авангард каскада смерти. При этом ключевой структурой ее функциональной активности является, несомненно, мембрана. На внутренней мембране локализована дыхательная цепь, которая посредством окислительного фосфорилирования обеспечивает выработку энергии для клетки. Целостность митохондриальной наружной мембраны имеет решающее значение для формирования компартмента белков проапоптотического межмембранного пространства. Важнейшими из этих белков являются цитохром с, способствующий сборке белкового комплекса, называемого апоптосомой (включает каспазу-9, связанную с активирующим фактором апоптотической протеазы 1 типа — APAF-1), и вторичный митохондриальный активатор каспаз Smac/DIABLO, который нейтрализует ингибирование каспаз, вызванное семейством белков-ингибиторов апоптоза (IAP), в частности XIAP. Весь комплекс белков этого ящика Пандоры приводит к деполяризации митохондрий и индукции гибели клеток при попадании в экстрамитохондриальное пространство.
Наружная мембрана митохондрий в физиологических условиях проницаема для молекул до 5 кДа. Во время пермеабилизации (повышения проницаемости) внешней мембраны митохондрии (MOMP) образуются поры, которые начинают пропускать белки массой более 100 кДа. Образование пор достигается за счет интеграции и конформационного взаимодействия активированных белков BCL-2 Х (BAX) и антагониста или киллера BCL-2 (BAK) [1]. В одной конкретной митохондрии этот процесс длится несколько секунд, но, поскольку начало MOMP для каждой митохондрии в клетке варьируется, обычно требуется около 5 минут для достижения проницаемости мембраны во всех митохондриях клетки. В некоторых случаях методы визуализации с высоким разрешением позволяли наблюдать волнообразное распространение MOMP внутри отдельных клеток. В регуляции митохондриальной проницаемости рассматривается роль уровня кальция, при этом данный процесс начинается со слабой митохондриальной деполяризации, которая в условиях повторного скачка уровня кальция запускает отсроченную кальциевую дисрегуляцию и стабильную деполяризацию мембраны [2]. Однако связь с белками семейства BCL-2 остается неясной, и MOMP, как и апоптоз, протекают чаще без повышения уровня внутриклеточного кальция.
Долгое время MOMP действует по принципу «все или ничего» — она считалась точкой невозврата, неизбежно ведущей к гибели клетки. В последних исследованиях отмечается, что внутриклеточная гетерогенность в вовлечении митохондрий в процесс MOMP влияет на выживание клеток, а также их дифференцировку. На настоящий момент описано два различных сценария частичной MOMP, которые не приводят к гибели клеток (рис.1). Возможны неполная MOMP, когда MOMP происходил в большинстве, но не во всех митохондриях внутри клетки, и MOMP меньшей части митохондрий («мини-MOMP»), при которой несколько митохондрий подвергаются MOMP после сублетального стресса.
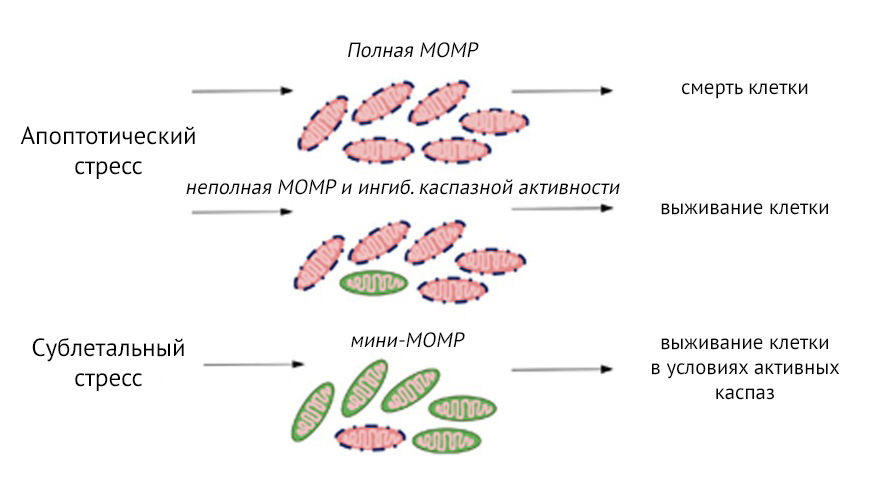
Рисунок 2 | Варианты пермеабилизации внешней мембраны митохондрий (MOMP).Апоптотический стресс приводит к полной MOMP и гибели клеток. Варианты частичной MOMP: неполная MOMP, в этом случае клетки могут выжить при ингибировании активности каспаз, и MOMP, вовлекающая меньшинство митохондрий (мини-MOMP). Последняя версия приводит к выживанию клеток, но при этом может произойти активирование каспаз-зависимых сигнальных путей, вызывающих повреждение ДНК в выживших клетках, которое может привести к их злокачественной трансформации [3].
Выживание клетки, которая сталкивается с апоптотическим стрессом и неполной MOMP, зависит от отсутствия или ингибирования активности каспаз. Было высказано предположение, что неполная MOMP является результатом неравномерной экспрессии в митохондриях антиапоптотического белка BCL-2, что поддерживает выживание клеток даже при получении разнообразных апоптотических стимулов при условии ингибирования активности каспаз. Напротив, мини-MOMP индуцирует каспазную активность, но на сублетальных уровнях. Данное «закаливание» клетки в условиях сублетальной каспазной активности способствует повреждению ДНК и запуску неапоптотических сигнальных путей каспаз, которые могут привести к онкогенной трансформации клетки [3]. В исследовании H. L. Tang с соавторами изучался апоптоз поздней стадии в различных клеточных линиях (гепатоцитах, кардиомиоцитах, макрофагах, фибробластах, клетках HeLa рака шейки матки и нейронах головного мозга). После воздействия индуктора апоптоза клетки проявляли множественные морфологические и биохимические признаки апоптоза поздней стадии, включая митохондриальную фрагментацию, активацию каспазы-3 и повреждение ДНК. Далее подавляющее большинство умирающих клеток задерживало апоптотический процесс и после удаления использованного индуктора апоптоза восстанавливалось, при этом некоторые клетки сохраняли приобретенные в ходе этого стресса генетические изменения и затем подвергались онкогенной трансформации (с большей частотой, чем контрольные клеточные линии). Такой механизм назвали «анастасисом» (греч. anastasis — «возвращение к жизни, воскрешение»). Обсуждается также роль выживания клеток в аспекте повышения генетического разнообразия как значительное эволюционное преимущество [4].
Такое «неудачное» завершение апоптоза фактически может способствовать инициации и прогрессированию рака. Описано истощение каспаз в раковых клетках, что также может позволить им выживать при различных апоптотических стимулах при невозможности достичь уровня полной MOMP. Кроме того, риск возникновения вторичных злокачественных новообразований, например, лейкемии при химиотерапии или сарком, ассоциированных с облучением, может быть повышен посредством индукции MOMP в меньшинстве митохондрий клетки [5].
Митохондриальная проницаемость — динамическое и мультирегулируемое явление, которое изменяет судьбу клетки с возможностью выбора различных альтернативных путей, порой противоречащих друг другу.
Источники:
1. Csordas G., Weaver D., Hajnoczky G. Endoplasmic Reticulum-Mitochondrial Contactology: Structure and Signaling Functions. Trends Cell Biol. 2018;28(7):523–540.
2. Garcia-Perez C., Roy S.S., Naghdi S., Lin X., Davies E., Hajnoczky G. Bid-induced mitochondrial membrane permeabilization waves propagated by local reactive oxygen species (ROS) signaling. Proc Natl Acad Sci USA 2012; 109: 4497–4502.
3. Kalkavan H., Green D.R. MOMP, cell suicide as a BCL-2 family business. Cell Death Differ. 2018;25(1):46–55.
4. Tang H.L., Tang H.M., Mak K.H., et al. Cell survival, DNA damage, and oncogenic transformation after a transient and reversible apoptotic response. Mol Biol Cell. 2012;23(12):2240–2252.
5. Labi V., Erlacher, M. How cell death shapes cancer. Cell death & disease.2015;6(3):e1675.
Источник: medach.pro