Парацитофагия: захват без обнаружения
МЕНЮ
Искусственный интеллект
Поиск
Регистрация на сайте
Помощь проекту
ТЕМЫ
Новости ИИ
Голосовой помощник
Городские сумасшедшие
ИИ в медицине
ИИ проекты
Искусственные нейросети
Слежка за людьми
Угроза ИИ
Компьютерные науки
Машинное обуч. (Ошибки)
Машинное обучение
Машинный перевод
Реализация ИИ
Реализация нейросетей
Создание беспилотных авто
Трезво про ИИ
Философия ИИ
Генетические алгоритмы
Капсульные нейросети
Основы нейронных сетей
Распознавание лиц
Распознавание образов
Распознавание речи
Техническое зрение
Чат-боты
Авторизация
2017-09-07 12:00

Статья на конкурс «био/мол/текст»: Внутриклеточные патогены предпочитают не попадать во внеклеточное пространство. О том, как использовать чужие ресурсы, маскироваться и не выходить из тени, расскажет Listeria monocytogenes.
Природа хитра на выдумки: даже организмы, состоящие всего из одной клетки, — бактерии — таят в себе массу удивительных способов выживания в окружающей среде, которая им не рада. Они подавляют фагоцитоз, направленный против них, разрушают мембраны клеток-хозяев, блокируют выброс нейромедиаторов, маскируются, экспрессируя (выставляя на поверхность) белки, аналогичные естественным белкам макроорганизма, продуцируют токсины. Но все это — внеклеточная суета, где существует строгий надсмотрщик в виде иммунной системы . А как насчет тех, кто живет внутри клетки? Как эти патогены обеспечивают себе распространение от клетки к клетке в обход наружной среды?
Введение в основы ее функционирования сделано в статье «Иммунитет: борьба с чужими и... своими» [1].
Сегодня речь пойдет об изобретательности Listeria monocytogenes из рода листерий — грамположительной подвижной палочки, внутриклеточного патогена, которая прекрасно сохраняется в контаминированных (то есть зараженных) молочных и мясных продуктах. При отсутствии должной термической обработки она способна вызвать такие тяжелые поражения желудочно-кишечного тракта, каких врагу не пожелаешь. Смертность от листериоза до сих пор составляет от 20% до 60% в разных странах. Например, при последней вспышке листериоза в Дании (в 2015 г.) летально закончились 25% случаев заражения [2]. Давайте разберемся, чем же так зловреден листериоз.
Как уже было упомянуто, заражение происходит пищевым путем. После попадания бактерий в кишечник они проникают в кровоток, разносясь по всему организму, оседая преимущественно в печени и сосудах мозга, но часть из них остается паразитировать в кишечнике.
Благодаря способности проникать в соседние клетки — одну за другой — они могут заражать ткани, до которых не добрались с кровотоком. Все, на что способна иммунная система в борьбе с внутриклеточными паразитами, — убийство зараженной клетки. Уничтожение зараженной ткани сопровождается некрозом, воспалением и, как следствие, потерей клеточного материала: если это происходит в кишечнике, возникают сильные боли, нарушения пищеварения и обезвоживание из-за рвоты и диареи. Воспаление в мозговых оболочках приводит к различным нарушениям в работе мозга. Для борьбы с бактериями, находящимися в кровотоке, выделяются цитокины и другие медиаторы иммунного ответа, что сопровождается сильным повышением температуры и сепсисом.
Беда не только в том, что листериоз сложно вылечить, но и в том, что путей заражения чрезвычайно много: L. monocytogenes обитает в почве, воде и даже растениях. Употребляя их, заражаются крупный и мелкий рогатый скот и птицы. После всех манипуляций с животными на комбинатах, получившиеся продукты животного происхождения хранятся в холоде. Мы все привыкли хранить подобные продукты в холодильнике, ведь так большинство бактерий размножается гораздо менее интенсивно. Но только не листерия! Она способна поддерживать репродуктивную функцию (и не просто поддерживать, а даже усиливать ее) в диапазоне температур +4–10 градусов, и даже замораживание не оказывает заметного влияния на ее жизнеспособность, а убить листерий возможно лишь в ходе трёхминутного нагревания до 100 °C — вот уж настоящие мастера выживания в экстремальных условиях!
Еще хуже ситуация становится в случае, если беременная женщина решит употребить зараженные продукты: Listeria может проникать через плаценту [3], [4] благодаря способности свободно путешествовать от клетки к клетке [5], провоцируя преждевременные роды, или заражать плод в процессе родов, после чего проникает сквозь его мозговые оболочки, вызывая менингит или сепсис у новорожденных (большая часть которых заканчивается фатально).
Заражение каждой новой клетки означает, что патоген успешен, а мера успешности микроба — реализация способности к размножению. После деления в эукариотической клетке становится тесно, и дочерние клетки вынуждены покинуть клетку-мишень в поисках нового места жительства.
Цель и средства
Но если микроорганизм способен существовать только внутри клетки-хозяина, то каким же образом ему удается покинуть дом и заразить соседние клетки, минуя внеклеточную среду? Почему такие инфекции плохо поддаются лечению, почему против них сложно создать эффективные вакцины и почему эти бактерии так ловко ускользают от иммунитета? Ответы на все эти вопросы кроются в более пристальном взгляде на способы распространения листерий в зараженном организме. Преимущество листерии заключается в том, что она находит путь из клетки в клетку, вовсе минуя межклеточное пространство.
Делает она это путем индукции процесса, называемого парацитофагией. Это такой способ обмена клеточным материалом, при котором одна клетка поглощает выступы, образованные мембраной ее соседки (рис. 1) [6]. Почему бы и нет, как говорится: дают — бери! В полученной везикуле (отпочковавшемся пузырьке), правда, может содержаться некий материал, который таким образом активно передается от клетки к клетке. Впервые этот процесс описали как раз в ходе исследований способов и механизмов межклеточного распространения листерий [7], а позже обнаружили и у других патогенных микроорганизмов, таких как Shigella flexneri, вызывающая дизентерию, и Rickettsia conorii [8]. В физиологически нормальных процессах парацитофагия не наблюдается, и наиболее близкое к ней событие — образование синцития, когда мембраны соседних клеток сливаются, а ядра функционирует отдельно. При этом образуется огромная многоядерная клетка, поэтому при индукции листерией слияния мембран с дальнейшим подобием эндоцитоза не вызывает никаких подозрений со стороны нормальных клеток. Таким образом, бактерии маскируют не себя или свои компоненты, а целый процесс.
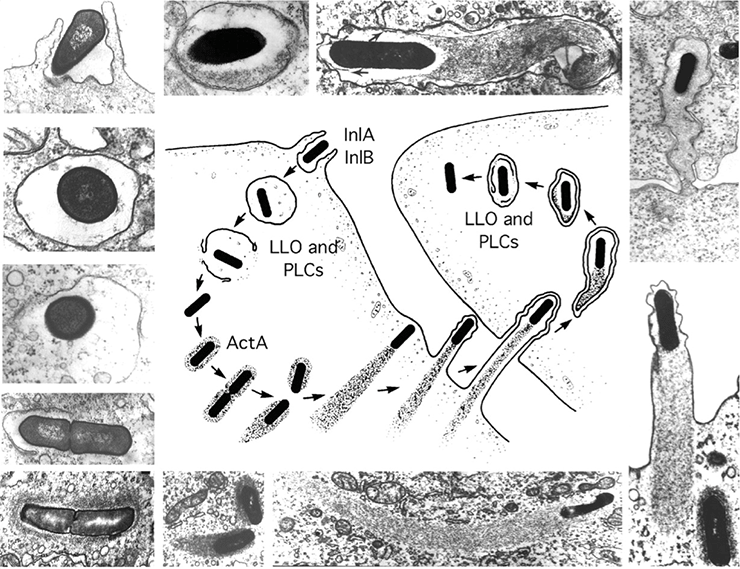
Рисунок 1. Этапы перемещения листерии от клетки к клетке. В центре — схематичное изображение процесса, по краям — микрофотографии, по которым восстановлен ход событий. Снимки получены с помощью электронного микроскопа.
Начало
Проследим алгоритм перемещений листерии с самого начала: попав в желудочно-кишечный тракт с некачественной пищей, листерия должна иметь способность к адгезии на эпителиальных клетках кишечника. Адгезия — это процесс «прилипания» одного объекта к другому, и в живых организмах он подобен функционированию «липучки» на кроссовках или одежде. Одни молекулы играют роль «крючков», другие — «петелек», и называются «рецептор» и «лиганд» соответственно. Листерия продуцирует на своей поверхности один из необходимых компонентов, а мембрана клетки-мишени — другие. Лигандами являются белки бактерии — интерналин А (InlA) и В (InlВ) (рис. 2, этап 1; далее упоминаемые этапы относятся к этому рисунку). Они взаимодействуют с молекулой адгезии, экспрессирующейся на поверхности клетки-мишени — Е-кадгерином [9] (этап 2), причем взаимодействие с одной такой адгезионной молекулой вызывает «подтягивание» в эту область нескольких аналогичных, что возможно благодаря текучести клеточной мембраны и ее способности к образованию рафтов. Ведь образования одного комплекса лиганд—рецептор в случае взаимодействия с целой бактерией недостаточно, и эукариотическая клетка попросту не уверена, что игра стоит свеч. Процесс перемещения еще нескольких молекул Е-кадгерина к области первичной стимуляции называется кластеризацией (этап 2), и только после образования еще как минимум двух комплексов Inl с кадгерином клетка готова к дальнейшим действиям (этап 3).
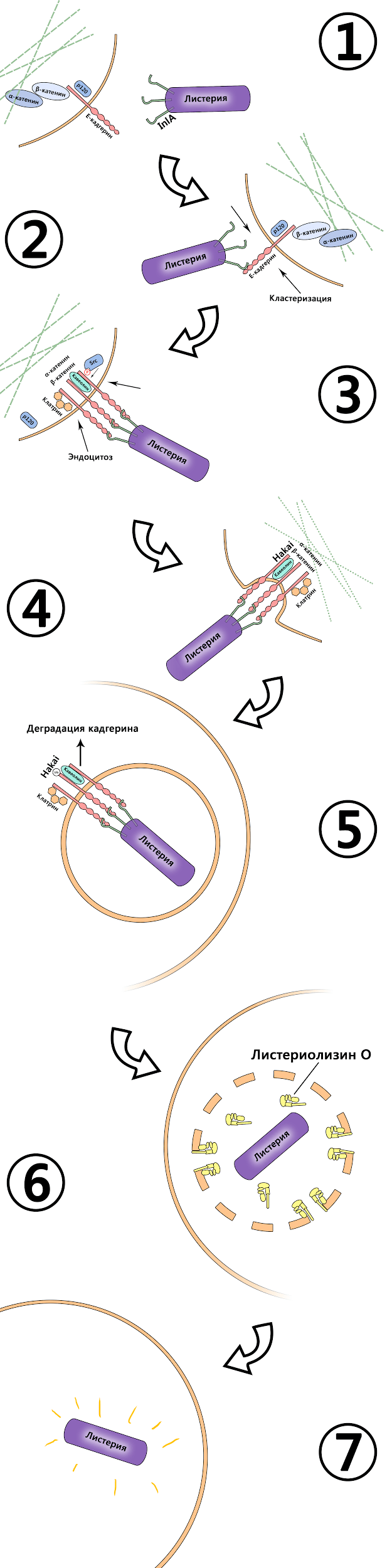
Рисунок 2. Молекулярные взаимодействия между бактерией и клеточными белками. 1 — Основные участники процесса. 2 — Взаимодействие между интерналином и кадегрином, кластеризация. 3, 4 — Эндоцитоз и белки, определяющие его механизм. 5 — Уже проникшая в клетку Listeria, переставшая зависеть от компонентов цитоскелета. 6, 7 — Момент истины: ферментативное расщепление везикулы и выход бактерии непосредственно в цитозоль. Теперь она может питаться, размножаться и, впоследствии, распространяться.
рисунок Шамсудина Насаева
В свою очередь, Е-адгерин, взаимодействуя с лигандом, подвергается интернализации, то есть «заворачиваться» внутрь с образованием везикулы в цитоплазме. Это обеспечивается следующим каскадом событий (этап 4): при связывании внеклеточного участка кадгерина с интерналином происходят конформационные изменения в структуре рецептора, приводящие к взаимодействию его цитоплазматического домена с белками семейства катенинов, которые обеспечивают связь кадгерина с цитоскелетом [10], что крайне важно при формировании контактов между соседними клетками (собственно, основная роль Е-кадгерина в организме [11]). Связь эта обеспечивается взаимодействием катенинов с цитоплазматическим доменом кадгерина [12]: первым делом, после его взаимодействия с интерналином, катенин р120 стабилизирует кадгерин в плазматической мембране.
Далее существуют два варианта развития событий:
- С еще стабильным кадгерином связываются другие белки-катенины — альфа и бета, — которые обеспечивают его прочную конструктивную связь с актиновым цитоскелетом [13].
- Взаимодействие кадгерина с лигандами на поверхности листерии приводит к активации Src-киназы, которая фосфорилирует цитоплазматический домен кадгерина, дестабилизируя его, и определяет дальнейшую интернализацию комплекса «кадгерин—листерия». Другим эффектм фосфорилирования Е-кадгерина является отщепление р120, а с освободившимся сайтом вступает во взаимодействие убиквитинлигаза Hakai [14] (этап 4) — фермент, который отправляет адгезионную молекулу в «последний путь». Он катализирует присоединение специального белка — убиквитина — на молекулы, подлежащие деструкции. Убиквитин является «черной меткой», сигнализирующей о необходимости деградации макромолекулы в лизосомах (этап 5).
Помимо этого на мембране всегда присутствуют мембранные белки кавеолин и клатрин. Их роль заключается в управлении путями протекания эндоцитоза (кавеолин обеспечивает течение рецептор-независимого эндоцитоза, клатрин — рецептор-опосредованного). В процессе образования везикулы с листерией внутри участие принимает, в основном, клатрин [15], который полимеризуется на поверхности образующейся везикулы, контролирует процесс ее отрыва от внешней мембраны и обеспечивает ее слияние с внутриклеточными эндосомами, опосредуя доставку материала из внеклеточной среды в цитозоль.
Таким образом, операция по адгезии и последующему проникновению бактерии внутрь клетки осуществлена. Теперь, будучи окруженной мембраной, ей остается только проникнуть в цитоплазму. Это обеспечивается секрецией бактериального токсина листериолизина О (ЛЛО) — порообразующего агента (этап 6) (а еще он является непосредственно сигнальной молекулой и способен активировать, например, ядерный фактор kB — тот самый NfkB, который недавно поздравляли с юбилеем [16]). ЛЛО вызывает лизис мембраны везикулы, и бактерия попадает непосредственно в цитоплазму (этап 7). Следующим шагом в ее жизненном цикле становится распространение от клетки к клетке, и вот тут мы и подходим к самому интересному — способу, которым листерия обеспечивает себе непрерывное внутриклеточное существование, при этом производя смену клеток-мишеней.
Цитоскелет: молекулярные аспекты
Для должного понимания этого процесса необходимо знать основы функционирования актинового цитокселета: актин находится в клетке в неактивной, мономерной форме в виде G-актина (глобулярного актина). С каждой из таких глобул связана молекула аденозинтрифосфата (АТФ) — основного источника энергии в любой клетке. В процессе «магических» взаимодействий (о них ниже) актин быстро полимеризуется, образуя филаменты — двунитчатые «канаты» (в этот момент он становится F-актином — филаментным), внутри которых молекулы актина удерживаются нековалентными связями (рис. 3). Невысокая прочность нековалентных связей компенсируется их количеством, благодаря чему клетка получает довольно прочный и при этом эластичный конструктивный материал.
В чем же заключаются те «магические» взаимодействия, которые управляют полимеризацией актина в нужном месте и в нужное время? Первое звено в этом процессе — белок профилин: он связывается с мономерами G-актина, занимая в них богатые пролином места, которые в дальнейшем будут участвовать в образовании контактов между молекулами актина. Это важно, ведь пролин — не совсем аминокислота: правильнее называть его иминокислотой. Благодаря химическим особенностям, пролин обеспечивает пептидные последовательности гибкими участками, являясь подобием шарнира. В присутствии Mg2+ профилин (на рисунке 3 — Рi) обеспечивает гидролиз АТФ до АДФ (на рисунке 3 актин в комплексе с АТФ — Т, с АДФ — D). В результате этого выделяется энергия, что значительно облегчает и ускоряет полимеризацию.
Помимо актина в клетках присутствуют актин-подобные белки, среди которых различают несколько подсемейств (Arp1, Arp2, Arp3 и т.д.). Некоторые из этих белков участвуют в манипуляциях с актином, а некоторые вовсе не способны с ним взаимодействовать — к последним относятся Arp2 и Arp3. Если быть точнее, поодиночке не взаимодействуют, а вот вместе образуют комплекс Arp2/3, который играет одну из ключевых ролей [17] — служит матрицей для сборки актина, но уже «с торца» или сбоку от уже образовавшейся нити, обеспечивая удлинение или разветвление микрофиламентов. Это позволяет ускорить полимеризацию актина в 2–3 раза, но этой скорости хватает, чтобы прямо на глазах «вытолкнуть» клеточную мембрану в нужном направлении.
И последним ключевым участником этого процесса является белок WASP (Wiskott-Aldrich Syndrome Protein, или формин), который имеет центры связывания как мономерного актина, так и комплекса Arp2/3. Связывая оба эти компонента и меняя конформацию, WASP обеспечивает их пространственное сближение, еще больше облегчая и ускоряя полимеризацию. Помимо этих центров связывания он несет и другие, регуляторные участки, в том числе для связи с фосфолипидами и для связи цитоскелета с мембраной, играя важную роль в процессах адгезии и межклеточных сообщений, выполняя ряд сигнальных функций [18].
Вы еще не забыли про Listeria?
Весь вышеописанный экскурс в полимеризацию актина имеет прямое отношение к ее жизнедеятельности. Как мы помним, для эффективного выживания этой бактерии необходимо постоянно находиться внутри клетки-хозяина. В то же время патогенам нельзя допустить перенаселения, и часть из них вынуждена искать новый дом. Чтобы не попасть в межклеточное пространство и избежать атаки иммунитета, листерия манипулирует актином клетки-хозяина. На одном конце своего «тела» бактерия секретирует ActA (actin assembly-inducing protein — белок, индуцирующий сборку актина), который... имитирует эукариотический WASP [19], [20]! Визуализация того, что из этого получается — на рисунке 3, теоретическое описание — в тексте.

Рисунок 3. Визуализация процесса парацитофагии. Полимеризующийся актин образует так называемый «хвост кометы» и выступает в роли реактивного двигателя: под его давлением бактерия движется вперед и вперед, а конструкция цитоскелета обеспечивает выпячивание мембраны в том же направлении. Образующийся выступ «врезается» в соседнюю клетку, в дальнейшем превращаясь в везикулу, которую бактерия расщепляет ферментативным путем.
Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок Шамсудина Насаева
Экспрессия этого белка вызывает индукцию Arp2/3-опосредованной полимеризации актина, которая оказывается настолько мощной и быстрой, что буквально выталкивает прокариотическую клетку в направлении ее противоположного полюса, оставляя позади нее «хвост кометы» из актина [21]. И если этот процесс происходит в достаточной близости от мембраны эукариотической клетки, она начинает выпячиваться, образуя выступ размером от 3 до 18 мкм. Достигая его, листерия взаимодействует с мембраносвязанным белком эзрином, который «пришивает» кометный хвост актина к мембране клетки-хозяина, обеспечивая пристеночное прикрепление бактерии [22].
А продолжающаяся полимеризация актина всё дальше выталкивает листерию из клетки хозяина. К этому моменту выступ клеточной мембраны зараженной клетки принимает такую вытянутую форму, что буквально впивается в соседнюю клетку (в эпителиальной выстилке кишечника — одной из основных обителей Listeria monocytogenes — клетки расположены вплотную друг к другу), и последней ничего не остается, кроме как захватить везикулу с патогеном внутри путем эндоцитоза, получая «кота в мешке».
При этом листерия все еще движется вперед, до тех пор, пока в ее «скафандре» не кончится прихваченный из старой клетки АТФ и G-актин. Получившийся мембранный «кокон» листерия расщепляет с помощью вырабатываемых уже известного вам листериолизина О и фосфолипаз, и — вуа-ля! — бактерию можно поздравить с новосельем, в процессе которого ее не засекли иммунные клетки, не затронул ни один из компонентов внеклеточного матрикса и даже сама клетка, являющаяся новым хозяином, не смогла понять, что вместо «кота» ей достался настоящий дьявол.
Что мы имеем?
Таким образом, иммунитет способен среагировать на листерию только до того, как она впервые адгезируется на клетку-мишень и проникнет в нее. Учитывая, что заражение происходит главным образом через ЖКТ, где иммунных клеток много, но все они не лежат на поверхности эпителиальной выстилки, а антигены доставляются к ним путем трансцитоза через другие специализированные клетки, можно сделать вывод, что шансов у иммунитета крайне мало. К тому же, листерия способна подавлять иммунный ответ, направленный в ее сторону, заставляя иммунные клетки совершать самоубийство (индуцируя в них апоптоз) [23].
Основным оружием иммунитета пока что остается система комплемента [24], когда разрушается вся зараженная клетка, ценой собственной жизни спасая соседние клетки от заражения. Соответственно, попытки создать вакцину не увенчиваются весомым успехом, а методы лечения ограничиваются терапией антибактериальными препаратами с наиболее выраженной способностью проникать через мембраны, что является фактором повышенной частоты побочных эффектов из-за системности их влияния на организм — ведь они проникают и в здоровые клетки. Остается только выбирать качественные продукты животного происхождения и проводить тщательнейшую термическую обработку.
Заключение
В чем же актуальность такой проблемы как листериоз, и почему по сей день продолжаются исследования и выясняются механизмы молекулярных взаимодействий? Как уже было упомянуто, заболевание это не из приятных (особенно, когда заканчивается летально). Человек, заболевший листериозом, на длительное время теряет работоспособность — острый период заболевания длится до двух недель. При этом не только страдает работоспособность, но и появляются физический, психологический и социальный дискомфорт. Грустно еще и то, что этому заболеванию подвержены наиболее уязвимые группы людей: беременные женщины, лица с иммунодефицитами, новорожденные и пожилые люди. В случае беременности заражение листериозом может привести к выкидышу, мертворождению или преждевременным родам, в результате которых с большой вероятностью родится уже зараженный ребенок. К несчастью, большинство случаев заражения не ограничивается кишечной формой — у младенцев наиболее часто встречаются менингит и энцефалит, что приводит к дальнейшим нарушениям в работе центральной нервной системы, и конъюнктивальная форма заболевания, когда происходит заражение слизистой оболочки глаза, что приводит к развитию кератоконъюнктивита (и очень повезет тем, у кого не разовьются дальнейшие осложнения). Переболевший человек становится более подверженым оппортунистическим инфекциям (которые вызываются представителями нормальной микрофлоры, не являющимися патогенными при здоровом состоянии иммунной системы).
Учитывая, что лечение неспецифичное и, зачастую, симптоматическое, в ход идут и реакции, обусловленные приемом лекарств: жаропонижающие и противовоспалительные препараты создают повышенную нагрузку на ферментные системы печени и почек, а антибиотики отрицательно действуют на микрофлору человеческого организма и способствуют развитию антибиотикорезистентности патогенных микроорганизмов. В общем, кроме истребления патогенных микроорганизмов в промежуток времени, соответствующий острой фазе болезни, ничего хорошего от антибиотиков ждать не приходится.
К тому же, если пациент пропивает неполный курс антибиотиков или неверно подбирает дозировку, листериоз может перейти в хроническую форму, что будет сопровождаться дисбалансом в иммунной системе, а сам пациент станет дополнительным резервуаром инфекции.
Все эти последствия инфицирования вкупе с легкостью заражения диктуют необходимость разработки новых, более действенных и, в идеале, более безопасных методов лечения и профилактики. Так, уже достигнуты некоторые успехи в разработке препаратов, ингибирующих бактериальные киназы — одни из важнейших ферментов листерий [25], а вакцина на основе ослабленных Listeria оказалась не только действенным методом в предотвращении листериоза, но и показала способность усиливать эффективность противоопухолевой терапии [26].
Понимание механизмов распространения внутриклеточных патогенов является, возможно, толчком к разработке новых лекарственных препаратов, чьей мишенью станут белки, взаимодействующие с цитоскелетом или молекулами адгезии, или, к примеру, лизины. Такие препараты дадут возможность действовать на разные звенья патогенеза, ограничивая проникновение, распространение и размножение паразитов. Кто знает, возможно, в будущем механизм парацитофагии или подобный ему поможет понять и описать нормальные физиологические или патологические процессы?
Литература
- Иммунитет: борьба с чужими и… своими;
- О вспышке листериоза в Дании. (2015). Роспотребнадзор;
- Anna I. Bakardjiev, Brian A. Stacy, Daniel A. Portnoy. (2005). Growth ofListeria monocytogenesin the Guinea Pig Placenta and Role of Cell?to?Cell Spread in Fetal Infection. J INFECT DIS. 191, 1889-1897;
- M. Lecuit, D. M. Nelson, S. D. Smith, H. Khun, M. Huerre, et. al.. (2004). Targeting and crossing of the human maternofetal barrier by Listeria monocytogenes: Role of internalin interaction with trophoblast E-cadherin. Proceedings of the National Academy of Sciences. 101, 6152-6157;
- Olivier Disson, Sol?ne Grayo, Eug?nie Huillet, Georgios Nikitas, Francina Langa-Vives, et. al.. (2008). Conjugated action of two species-specific invasion proteins for fetoplacental listeriosis. Nature. 455, 1114-1118;
- Daniel A. Portnoy, Victoria Auerbuch, Ian J. Glomski. (2002). The cell biology ofListeria monocytogenesinfection. J Cell Biol. 158, 409-414;
- Jennifer R. Robbins, Angela I. Barth, H?l?ne Marquis, Eugenio L. de Hostos, W. James Nelson, Julie A. Theriot. (1999). Listeria monocytogenesExploits Normal Host Cell Processes to Spread from Cell to Cell?. J Cell Biol. 146, 1333-1350;
- Gouin E., Gantelet H., Egile C., Lasa I., Ohayon H., Villiers V. et al. (1999). A comparative study of the actin-based motilities of the pathogenic bacteria Listeria monocytogenes, Shigella flexneri and Rickettsia conorii. J. Cell Sci. 112, 1697–1708;
- J.-L. Gaillard, P. Berche, C. Frehel, E. Gouln, P. Cossart. (1991). Entry of L. monocytogenes into cells is mediated by internalin, a repeat protein reminiscent of surface antigens from gram-positive cocci. Cell. 65, 1127-1141;
- Mirna Perez-Moreno, Colin Jamora, Elaine Fuchs. (2003). Sticky Business. Cell. 112, 535-548;
- Saurabh D Patel, Chien Peter Chen, Fabiana Bahna, Barry Honig, Lawrence Shapiro. (2003). Cadherin-mediated cell–cell adhesion: sticking together as a family. Current Opinion in Structural Biology. 13, 690-698;
- L. Shapiro, W. I. Weis. (2009). Structure and Biochemistry of Cadherins and Catenins. Cold Spring Harbor Perspectives in Biology. 1, a003053-a003053;
- Frauke Drees, Sabine Pokutta, Soichiro Yamada, W. James Nelson, William I. Weis. (2005). ?-Catenin Is a Molecular Switch that Binds E-Cadherin-?-Catenin and Regulates Actin-Filament Assembly. Cell. 123, 903-915;
- Soichiro Yamada, Sabine Pokutta, Frauke Drees, William I. Weis, W. James Nelson. (2005). Deconstructing the Cadherin-Catenin-Actin Complex. Cell. 123, 889-901;
- Esteban Veiga, Pascale Cossart. (2005). Listeria hijacks the clathrin-dependent endocytic machinery to invade mammalian cells. Nat Cell Biol. 7, 894-900;
- Qian Zhang, Michael J. Lenardo, David Baltimore. (2017). 30 Years of NF-?B: A Blossoming of Relevance to Human Pathobiology. Cell. 168, 37-57;
- Sandra Sousa, Didier Cabanes, Laurence Bougn?res, Marc Lecuit, Philippe Sansonetti, et. al.. (2007). Src, cortactin and Arp2/3 complex are required for E-cadherin-mediated internalization of Listeria into cells. Cell Microbiol. 9, 2629-2643;
- Olga Alekhina, Ezra Burstein, Daniel D. Billadeau. (2017). Cellular functions of WASP family proteins at a glance. J Cell Sci. 130, 2235-2241;
- Welch M.D., Rosenblatt J., Skoble J., Portnoy D.A., Mitchison T.J. (1998). Interaction of human Arp2/3 complex and the Listeria monocytogenes ActA protein in actin filament nucleation. Science. 281, 105–108;
- C. Kocks, E. Gouin, M. Tabouret, P. Berche, H. Ohayon, P. Cossart. (1992). L. monocytogenes-induced actin assembly requires the actA gene product, a surface protein. Cell. 68, 521-531;
- V. B. Shenoy, D. T. Tambe, A. Prasad, J. A. Theriot. (2007). A kinematic description of the trajectories of Listeria monocytogenes propelled by actin comet tails. Proceedings of the National Academy of Sciences. 104, 8229-8234;
- M. Bonazzi, M. Lecuit, P. Cossart. (2009). Listeria monocytogenes Internalin and E-cadherin: From Bench to Bedside. Cold Spring Harbor Perspectives in Biology. 1, a003087-a003087;
- Erin Theisen, John-Demian Sauer. (2017). Listeria monocytogenes-Induced Cell Death Inhibits the Generation of Cell-Mediated Immunity. Infect. Immun.. 85, e00733-16;
- Daniel G. Calame, Stacey L. Mueller-Ortiz, Rick A. Wetsel. (2016). Innate and adaptive immunologic functions of complement in the host response to Listeria monocytogenes infection. Immunobiology. 221, 1407-1417;
- Schaenzer A.J., Wlodarchak N., Drewry D.H., Zuercher W.J., Rose W.E., Striker R., Sauer J.D. (2017). A screen for kinase inhibitors identifies antimicrobial imidazopyridine aminofurazans as specific inhibitors of the Listeria monocytogenes PASTA kinase PrkA. J. Biol. Chem. pii: jbc.M117.808600;
- Jia Y.Y., Tan W.J., Duan F.F., Pan Z.M., Chen X., Yin Y.L., Jiao X.A. (2017). A genetically modified attenuated Listeria vaccine expressing HPV16 E7 kill tumor cells in direct and antigen-specific manner. Front. Cell Infect. Microbiol. 7, 279.
Источник: biomolecula.ru